8.4.5: Energías de ionización y afinidades de electrones
- Page ID
- 75850
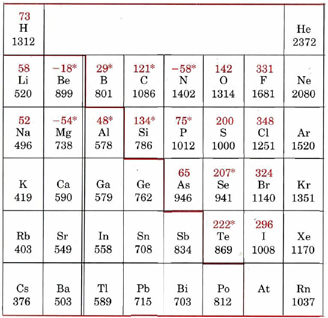
* Las afinidades de electrones marcadas con un asterisco (*) se han obtenido a partir de cálculos teóricos en lugar de mediciones experimentales. La línea coloreada pesada separa los metales (energía de ionización generalmente por debajo de aproximadamente 800 kJ mol —1) de los no metales.
Esta tabla da energías de ionización y afinidades de electrones para elementos comunes, y muestra la información en términos de la tabla periódica. Las energías de ionización están en negro, con afinidades de electrones en rojo. Para las energías de ionización surgen dos tendencias generales. Primero, a medida que uno baja un grupo dado en la tabla periódica, la energía de ionización disminuye. Segundo, a medida que uno se mueve de izquierda a derecha a través de la tabla periódica (de un átomo de metal alcalino a un gas noble), la energía de ionización aumenta en su conjunto. Si bien las afinidades de electrones muestran menos regularidades en la mesa, las tendencias sí existen. Todos los halógenos tienen valores de aproximadamente 300 kJ mol—1 mientras que los no metales del grupo VI tienen valores algo menores, en la región de 200 kJ mol—1 o menos.
A las energías de ionización | A las afinidades de electrones