8.4.5.1: Afinidades de electrones
- Page ID
- 75864
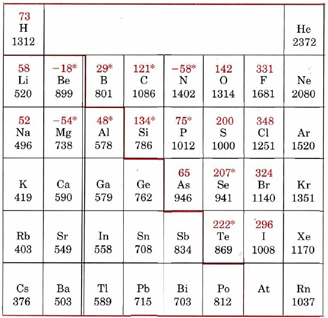
Las afinidades de los electrones son más difíciles de medir experimentalmente que las energías de ionización, y hay muchos menos valores disponibles. La relación de la tabla periódica con aquellas afinidades de electrones que se han medido o estimado a partir de cálculos se puede ver en la tabla de energías de ionización y afinidades de electrones, que se ve a continuación.
* Las afinidades de electrones marcadas con un asterisco (*) se han obtenido a partir de cálculos teóricos en lugar de mediciones experimentales. La línea de color pesado separa los metales (la energía de ionización generalmente por debajo de aproximadamente 800 kJ mol—1) de los no metales.
No es fácil discernir muchas regularidades obvias en esta tabla, especialmente porque algunos de los valores de afinidad de electrones citados son negativos, lo que indica que a veces se requiere energía para forzar un electrón extra a un átomo. Sin embargo, es bastante obvio cuál de los grupos periódicos corresponde a las mayores afinidades de electrones. Todos los halógenos tienen valores de aproximadamente 300 kJ mol —1 mientras que los no metales del grupo VI tienen valores algo menores, en la región de 200 kJ mol —1 o menos. Las altas afinidades de electrones de los halógenos son el resultado de que tienen una capa externa casi completa de electrones. El elemento flúor, por ejemplo, tiene la estructura 1 s 2 2 s 2 p 5, en la que uno de los orbitales de 2 p contiene solo un electrón. Si se agrega un electrón extra a este átomo para formar un ion fluoruro, el electrón puede emparejarse con el electrón en el orbital medio lleno de 2 p. El electrón agregado estará blindado del núcleo por los electrones de 1 s, pero los electrones 2 s y 2 p están en la misma cáscara y lo blindarán bastante mal. Habrá así una carga nuclear efectiva bastante grande (una estimación aproximada es +5) atrayendo el electrón agregado. Debido a esta atracción general, la energía se liberará cuando el electrón sea capturado por el átomo de flúor. Razonamiento similar también explica por qué el oxígeno también tiene una alta afinidad electrónica. Aquí, sin embargo, la carga nuclear es menor, y la atracción por el electrón agregado claramente menor.
Colaboradores
Ed Vitz (Kutztown University), John W. Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (University of Minnesota Rochester), Tim Wendorff, and Adam Hahn.