8.16.2: Conexiones culturales- El comercio de la canela
- Page ID
- 75757
La canela es conocida desde hace miles de años. Una de las primeras veces que se menciona es en el Antiguo Testamento cuando Moisés usa canela en aceite santo. El uso de canela en aceite santo muestra lo preciada que era esta especia en la antigüedad. De hecho, en Grecia la canela se usaba como sacrificio a los dioses como Apolo. Aunque la canela se utilizó en el Mediterráneo, se originó en Sri Lanka. La canela viajó por la ruta de las especias, y los orígenes reales de la canela se mantuvieron tranquilos. Al no permitir que otros comerciantes supieran la fuente de la especia los cultivadores pudieron mantener un monopolio y controlar el precio (a uno alto por supuesto). En el siglo XVI Portugal finalmente llegó a Sri Lanka. En 1518 se instaló allí un fuerte comercial. Los holandeses lucharon contra los portugueses y finalmente ganaron el control del comercio de canela en 1658. Los británicos finalmente tomaron el control de la isla en 1796 pero para entonces la canela no era tan apreciada.
A través del comercio de especias, la canela salió de Sri Lanka y entró en las cocinas y culturas del resto del mundo. En México especialmente la canela es una gran parte de su cocina. De hecho, México es el principal importador de canela cruda. La mayor parte de esta canela se utiliza en la elaboración del chocolate. Además, la canela en México se usa en postres, chocolate caliente y muchas otras cosas. La especia se usa en el mismo tipo de platillos en Estados Unidos, así como cosas como el cereal. En Oriente Medio la canela se utiliza para dar sabor a cordero así como sopas e incluso como sabor en decapado. El sabor único de la canela y la capacidad de ser utilizada como especia es la razón por la que se ha incorporado a culturas de todo el mundo. El componente en la canela que le da sus propiedades es la presencia de cinamaldehído.
El aceite esencial que compone la canela es más del 90% de cinamaldehído. El cinamaldehído es un compuesto orgánico que también se puede clasificar como aldehído. El cinamaldehído es único ya que también contiene un anillo de benceno y un doble enlace, como se ve en la estructura de la Figura 1. El cinamaldehído también se usa en muchos otros alimentos como saborizante. Si bien el cimmaldehído se puede sintetizar, la principal fuente del mismo es de la corteza de canela.
Más sobre Aldehídos y Cetonas
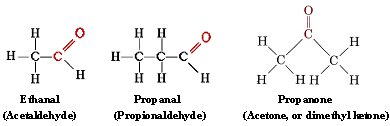
El grupo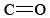 funcional que se encuentra en el formaldehído se denomina grupo carbonilo. Se pueden distinguir dos clases de compuestos sobre la base de la ubicación del grupo carbonilo. En los aldehídos se encuentra al final de una cadena carbonada y tiene al menos un hidrógeno unido. En las cetonas el grupo carbonilo está unido a dos átomos de carbono. Algunos ejemplos son
funcional que se encuentra en el formaldehído se denomina grupo carbonilo. Se pueden distinguir dos clases de compuestos sobre la base de la ubicación del grupo carbonilo. En los aldehídos se encuentra al final de una cadena carbonada y tiene al menos un hidrógeno unido. En las cetonas el grupo carbonilo está unido a dos átomos de carbono. Algunos ejemplos son
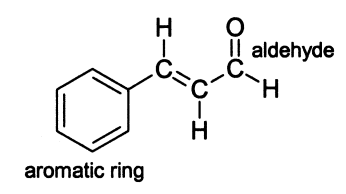 cinamaldehído
cinamaldehído
Se pueden realizar pruebas químicas para determinar la presencia de un grupo carbonilo. En el siguiente video, se agrega una solución de 2,4-dinitrofenilhidrazina a tubos de ensayo que contienen 2-propanol, un alcohol; 2-propanona (acetona), una cetona; y ácido propiónico un ácido carboxílico. La 2,4-dinitrofenilhidrazina solo reacciona con el grupo carbonilo de la 2-propanona, formando un precipitado naranja.
La reacción que se produce es:
Otra prueba puede distinguir entre aldehídos y cetonas. Aquí un video de la Prueba de Tollens de Espejo Plateado para Aldehídos:
El reactivo Tollens es una solución acuosa de nitrato de plata, hidróxido de sodio y un poco de amoníaco. (En el video el amoníaco proviene de la reacción de iones amonio en nitrato de amonio e iones hidróxido de hidróxido de sodio para formar agua y NH 3.) Si se agrega un aldehído, en este caso, glucosa, a la solución, el Ag + se reduce por el aldehído, y el aldehído se oxida en un ácido carboxílico. Esto produce metal plateado, que recubre el matraz y crea el espejo. Una reacción similar no ocurre para las cetonas, por lo que solo los aldehídos producen el espejo de plata. La ecuación para la reacción en el video es:
Las terminaciones al y uno significan al dehído y ket uno, respectivamente. La fórmula general para un aldehído es,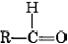 mientras que para una cetona lo es. Tenga en cuenta que cada cetona es isomérica con al menos un aldehído. La acetona, por ejemplo, tiene la misma fórmula molecular (C 3 H 6 O) que el
mientras que para una cetona lo es. Tenga en cuenta que cada cetona es isomérica con al menos un aldehído. La acetona, por ejemplo, tiene la misma fórmula molecular (C 3 H 6 O) que el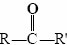 propanal.
propanal.
Las moléculas de aldehído y cetona no pueden formar enlaces de hidrógeno entre sí por la misma razón que los éteres no pueden, no contienen hidrógenos unidos a átomos altamente electronegativos. El grupo carbonilo es bastante polar, sin embargo, ya que la diferencia entre las electronegatividades del carbono (2.5) y el oxígeno (3.5) es bastante grande, y generalmente no hay otros dipolos en una molécula de aldehído o cetona para cancelar el efecto de C==O.
Por lo tanto, los puntos de ebullición de aldehídos y cetonas son intermedios entre los de alcanos o éteres por un lado y los alcoholes por otro. El acetaldehído, CH 3 CH 2 CHO, hierve a 20.8°C a medio camino entre propano (—42°C) y etanol (78.5°C). Los puntos de ebullición del propanal y la acetona se comparan con otros compuestos orgánicos en la tabla de los puntos de ebullición de compuestos orgánicos comparables lo que muestra la misma tendencia.
De todos los aldehídos y cetonas, el formaldehído y la acetona son de mayor importancia comercial. Ya se han mencionado usos del formaldehído. Al igual que otras cetonas, la acetona es principalmente útil como solvente, y es posible que la hayas usado para este propósito en el laboratorio. La acetona y otras cetonas son algo tóxicas y no deben manejarse descuidadamente.
De ChemPrime: 8.15: Aldehídos y Cetonas


