8.17: Ácidos Carboxílicos
- Page ID
- 75587
Servir vino generalmente implica una ceremonia bastante elaborada en la que el anfitrión prueba el vino antes de servirlo para los invitados. Una razón de esto es la posibilidad de que el vino haya sido estropeado por la exposición al aire.
Ciertas enzimas bacterianas son capaces de convertir etanol en ácido etanoico (ácido acético) cuando hay oxígeno presente:
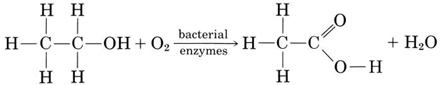
La misma reacción ocurre cuando la sidra se convierte en vinagre, que contiene de 4 a 5 por ciento de ácido acético. El ácido acético le da al vinagre su sabor agrio y olor acre y puede hacerle lo mismo al vino.
El ácido acético, CH 3 COOH, es un ejemplo de la clase de compuestos llamados ácidos carboxílicos, cada uno de los cuales contiene uno o más grupos carboxilo, COOH. La fórmula general de un ácido carboxílico es RCOOH. Algunos otros ejemplos son
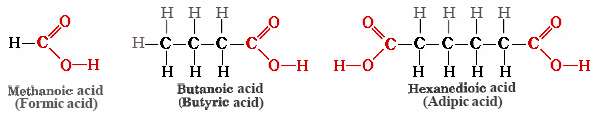
El ácido fórmico (el nombre proviene del vocablo latino formica que significa “hormiga “) está presente en las hormigas y abejas y es responsable del dolor ardiente de sus picaduras y picaduras. El ácido butírico, un componente de la mantequilla rancia y el queso Limburger, tiene un olor vil. El ácido adípico es un ejemplo de un ácido dicarboxílico, tiene dos grupos funcionales, y se usa para fabricar nylon.
Dado que el grupo carboxilo contiene un grupo altamente polar así como un grupo OH, los enlaces de hidrógeno son extensos entre las moléculas de los ácidos carboxílicos. El ácido acético puro se llama ácido acético glacial porque su punto de fusión de 16.6°C es lo suficientemente alto como para que pueda congelarse en un laboratorio frío. Como puede ver en la tabla de puntos de ebullición, el ácido acético hierve a una temperatura más alta que cualquier otra sustancia orgánica cuyas moléculas sean de tamaño comparable y tengan solo un grupo funcional. También es bastante grueso y almibarado debido a los extensos enlaces de hidrógeno.
como un grupo OH, los enlaces de hidrógeno son extensos entre las moléculas de los ácidos carboxílicos. El ácido acético puro se llama ácido acético glacial porque su punto de fusión de 16.6°C es lo suficientemente alto como para que pueda congelarse en un laboratorio frío. Como puede ver en la tabla de puntos de ebullición, el ácido acético hierve a una temperatura más alta que cualquier otra sustancia orgánica cuyas moléculas sean de tamaño comparable y tengan solo un grupo funcional. También es bastante grueso y almibarado debido a los extensos enlaces de hidrógeno.
A continuación se muestra un modelo Jmol de ácido acético. En el menú general de la izquierda, da clic en cargos parciales. A cada átomo de la molécula se le asignará una carga parcial. Es claro que los átomos de oxígeno están compartiendo electrones de manera desigual y provocando que otras partes de la molécula ganen una carga positiva parcial en el carbono carboxilo y el hidrógeno. Además, esto induce una carga negativa parcial en el carbono de metilo, lo que lleva a cargas positivas en los átomos de hidrógeno de metilo.
Una manera aún mejor de ver la distribución de electrones es con las opciones de Superficie de Potencial Electrostático Molecular (MEP). Se puede observar “MEP en superficie isopotencial”, que muestra superficies donde el potencial electrostático es el mismo, pero la opción más informativa aquí es el botón de radio “MEP on Van der Waals Surface”. Esto muestra el potencial a lo largo de la superficie de van der Waals de la molécula. Cuanto más cerca del rojo en el espectro de color, cuanto más negativo es el potencial en esa superficie, más cerca del azul, más positivo. Se puede ver que ambos átomos de oxígeno son centros de carga negativa parcial, mientras que el átomo de hidrógeno ácido tiene una carga positiva parcial sustancial, y el grupo metilo también tiene una carga positiva parcial. Una forma más de mirar la molécula, es usar el botón “MEP en un avión”. Elija el plano XY y luego haga clic en “Establecer ecuación de plano”. Esto mostrará el potencial electrostático a lo largo del eje de simetría para la molécula. Si bien dos átomos de hidrógeno en el grupo metilo están fuera del plano, esta visión aún permite ver cómo se distribuye la carga parcial a lo largo de la cadena principal de la molécula de una manera que la superficie de van der Waals no lo hace. A partir de este modelado de la molécula de ácido acético, ojalá quede claro cómo surgen las propiedades macroscópicas que discutimos.
El ácido acético se sintetiza comercialmente de acuerdo con la reacción mostrada anteriormente, pero se usa plata como catalizador en lugar de enzimas bacterianas. También se prepara leyendo aire con propano separado del gas natural. El acetaldehído líquido obtenido en esta reacción se combina luego con oxígeno en presencia de acetato de manganeso (II) para elaborar ácido acético. Alrededor de la mitad del ácido acético producido en Estados Unidos va al acetato de celulosa del que se elaboran las fibras de acetato.


