8.25: Polímeros de Condensación
- Page ID
- 75674
Cuando se forman polímeros de adición, no resultan subproductos. La formación de un polímero de condensación, por otro lado, produce H 2 O, HCl, o alguna otra molécula simple que escapa como gas. Un ejemplo familiar de un polímero de condensación es el nylon, que se obtiene de la reacción de dos monómeros.
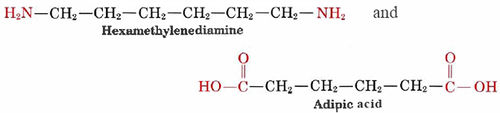
Estas dos moléculas pueden unirse entre sí porque cada una contiene un grupo funcional reactivo, ya sea una amina o un ácido carboxílico que reacciona para formar un enlace amida. Combinan de la siguiente manera:
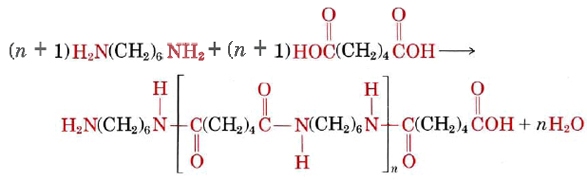
A continuación se muestra un video de la reacción para formar nylon. Esta reacción está ligeramente modificada de la descrita anteriormente, ya que se utiliza como reactivo cloruro de adipoílo, no ácido adípico. Así se produce HCl, no H 2 O. Esto también significa que la cadena termina en un cloruro de ácido, en lugar del ácido carboxílico mostrado anteriormente. Obsérvese que todavía se forma un enlace amida.
Se vierte una solución de cloruro de adipoílo en ciclohexano sobre una solución acuosa de 1,6-diaminohexano en un vaso de precipitados. La poliamida de nylon (6,6) se forma en la interfaz de los dos líquidos inmiscibles y se extrae cuidadosamente de la solución y se coloca sobre una varilla de vidrio. Luego se hace girar la varilla y se hace girar la poliamida Nylon (6,6) sobre la varilla.
Los polímeros de condensación conocidos distintos del nylon son Dacron, Baquelita, Melamina y Mylar. El nailon produce hilos y fibras extremadamente fuertes porque sus moléculas de cadena larga tienen fuerzas intermoleculares más fuertes que las fuerzas londinenses del polietileno. Cada grupo N-H en una cadena de nylon puede unirse por hidrógeno al O de un grupo C=O en una cadena vecina, como se muestra a continuación. Por lo tanto, las cadenas no pueden deslizarse unas tras otras fácilmente.
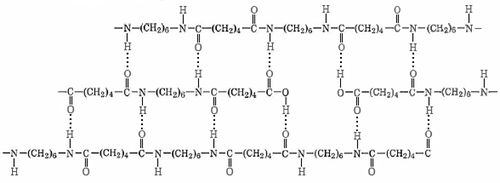
Si tiras de ambos extremos de un hilo de nylon, por ejemplo, solo se estirará ligeramente. Después de eso resistirá fuertemente a romperse porque una gran cantidad de enlaces de hidrógeno mantienen unidas las cadenas superpuestas. Lo mismo no es cierto de un hilo de polietileno en el que solo las fuerzas londinenses atraen juntas cadenas superpuestas, y esta es una de las razones por las que el polietileno no se usa para hacer hilo.


