13.12: Efecto de la adición de un reactivo o producto
- Page ID
- 75163
Si tenemos un sistema que ya está en equilibrio, la adición de una cantidad extra de uno de los reactivos o uno de los productos arroja al sistema fuera de equilibrio. Entonces ocurrirá la reacción directa o la inversa con el fin de restablecer las condiciones de equilibrio. Podemos decir fácilmente cuál de estas dos posibilidades sucederá desde el principio de Le Chatelier. Si sumamos más de uno de los productos, el sistema se ajustará para compensar la ganancia en concentración de este componente. La reacción inversa ocurrirá en un grado limitado para que parte del producto agregado pueda consumirse. Por el contrario, si se agrega uno de los reactivos, el sistema se ajustará permitiendo que la reacción directa ocurra en cierta medida. En cualquier caso se consumirá parte del componente agregado.
Vemos este principio en funcionamiento en el caso de la descomposición de HI a altas temperaturas:
\[\text{2HI}(g) \rightleftharpoons \text{H}_2(g) + \text{I}_2(g) \nonumber \]
La adición de H 2 ha incrementado la concentración de este componente. En consecuencia, el principio de Le Chatelier predice que el sistema logrará un nuevo equilibrio de tal manera que se reduzca esta concentración. La reacción inversa ocurre en un grado limitado. Esto no sólo reduce la concentración de H 2 sino también la concentración de I 2. Al mismo tiempo se incrementa la concentración de HI. El sistema finalmente termina con las concentraciones calculadas en el Ejemplo 2 a partir del Cálculo de la extensión de una reacción, a saber,
\[\frac{\text{ }\!\![\!\!\text{ H}_{\text{2}}]\text{ }\!\!]\!\!\text{ }\!\![\!\!\text{ I}_{\text{2}}\text{ }\!\!]\!\!\text{ }}{\text{ }\!\![\!\!\text{ HI }\!\!]\!\!\text{ }^{\text{2}}}=\frac{\text{0}\text{.1018 mol L}^{-\text{1}}\text{ }\times \text{ 0}\text{.001 82 mol L}^{-\text{1}}}{\text{(0}\text{.0963 mol L}^{-\text{1}}\text{)}^{\text{2}}\text{ }}=\text{0}\text{.02}=K_{c} \nonumber \]
La forma en que este sistema responde a la adición de H2 también se ilustra esquemáticamente en la Figura 1. La extensión real del cambio es exagerada en esta figura para el efecto diagramático.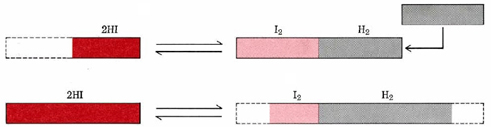
El principio de Le Chatelier también se puede aplicar a los casos en los que se retira uno de los componentes. En tal caso el sistema responde produciendo más del componente eliminado. Consideremos, por ejemplo, la ionización del ácido diprótico débil H 2 S:
\[\ce{H_{2}S + 2H_{2}O \rightleftharpoons 2H_{3}O^{+} + S^{2-}} \nonumber \]Dado que H 2 S es un ácido débil, se producen muy pocos iones S 2—, pero se puede obtener una concentración mucho mayor de iones S2 — agregando una base fuerte. La base consumirá la mayor parte de los iones H 3 O +. Como resultado, más H 2 S reaccionará con H 2 O para suplir la deficiencia de H 3 O +, y también se producirán más iones S 2—. Este truco de eliminar uno de los productos para aumentar la concentración de otro producto suele ser utilizado por los químicos, y también por los sistemas vivos.
Anteriormente, hemos investigado el efecto de agregar/restar un producto/reactivo en términos matemáticos. El siguiente video le permite ver visualmente los cambios en los cambios de equilibrio que ocurren al agregar un reactivo o producto, cortesía de la North Caroline School of Science and Mathematics.
Cuando una mezcla de 1 mol de N2 y 3 mol H2 se pone en equilibrio sobre un catalizador a 773 K (500°C) y 10 atm (1.01 MPa), la mezcla reacciona para formar NH 3 de acuerdo con la ecuación
\(\text{N}_2(g) + \text{3H}_2(g) \rightleftharpoons \text{2NH}_3(g)\)Δ H m = — 94.3 kJ El rendimiento de NH 3, sin embargo, es bastante pequeño; solo alrededor del 2.5 por ciento de los reactivos se convierten. Sugerir cómo se podría mejorar este rendimiento (a) alterando la presión; (b) alterando la temperatura; (c) eliminando un componente; (d) encontrando un mejor catalizador.Solución:
a) El aumento de la presión impulsará la reacción en la dirección de menos moléculas. Desde Δn = - 2, se fomentará la reacción hacia adelante, incrementando el rendimiento de NH 3. b) El aumento de la temperatura conducirá la reacción en dirección endotérmica, en este caso en sentido inverso. Para incrementar el rendimiento, por lo tanto, necesitamos bajar la temperatura. c) Al retirar el producto NH 3 se desplazará la reacción hacia la derecha. Esto generalmente se hace enfriando la mezcla de reacción para que el NH 3 (l) se condense. Luego se agregan más N 2 (g) y H 2 (g), y la mezcla de reacción se recicla a una condición de temperatura suficientemente alta para que la velocidad se vuelva apreciable. d) Si bien un mejor catalizador aceleraría el logro del equilibrio, no afectaría la posición del equilibrio. Por lo tanto, no tendría ningún efecto sobre el rendimiento.Nota: Como se menciona en los Chaps. 3 y 12, el NH 3 es un químico importante por su uso en fertilizantes. En el diseño de una planta de proceso Haber para fabricar amoníaco, se intenta utilizar una presión lo más alta y una temperatura lo más baja posible. La presión suele ser del orden de 150 atm (15 MPa), mientras que la temperatura no suele ser inferior a 750 K. Aunque una temperatura más baja daría un mayor rendimiento, la reacción iría demasiado lenta para ser económica, al menos con los catalizadores actuales. El descubridor de un mejor catalizador para esta reacción sin duda se convertiría en millonario durante la noche.
Agradecimientos:
Dos de las ecuaciones de este artículo fueron creadas usando la ayuda de https://www.latex4technics.com/.


