13.13: La visión molecular del equilibrio
- Page ID
- 75137
En otras secciones, mostramos que existen constantes de equilibrio, cómo se pueden determinar y cómo se pueden usar, pero no hemos explicado por qué a veces son grandes y otras pequeñas. Para responder a esta y otras preguntas relacionadas debemos cambiar nuestro punto de vista del nivel macroscópico al microscópico.
El isomerismo cis-trans del difluoroeteno proporciona un ejemplo sencillo para el examen a nivel molecular. Como vimos anteriormente, si 1 mol de isómero cis de este compuesto se calienta a 623 K, se transforma gradualmente en la mezcla de equilibrio de ⅔ mol de isómero cis y ⅓ mol de isómero trans. Desde un punto de vista macroscópico, podríamos concluir que la reacción se detiene una vez que se alcanza el equilibrio, pero a nivel microscópico, tal afirmación es obviamente falsa.
A medida que las moléculas cis se mueven alrededor de un contenedor a 623 K, ocasionalmente sufren una colisión con suficiente energía para voltearlas a la conformación trans (para una vista microscópica de este proceso, ver Figura\(\PageIndex{1}\)). Este proceso de conversión no se detiene repentinamente cuando se ha alcanzado el equilibrio. Hay muchas moléculas cis presentes en la mezcla de equilibrio, y continúan colisionando con sus semejantes moléculas y por lo tanto volteando de la conformación cis a la trans. Así, la reacción hacia adelante
\[cis-\text{C}_2\text{H}_2\text{F}_2 \rightarrow trans-\text{C}_2\text{H}_2\text{F}_2 \nonumber \]
debe continuar ocurriendo en la mezcla de equilibrio.
Si esta fuera la única reacción que tiene lugar en el matraz, el resultado final sería que todo el isómero cis se convertiría en el isómero trans y no resultaría ninguna mezcla de equilibrio. Esto no sucede porque la reacción inversa
\[trans-\ce{C_{2}H_{2}F_{2} \rightarrow} cis-\ce{C_{2}H_{2}F_{2}} \nonumber \]
también está ocurriendo al mismo tiempo. Las moléculas trans en la mezcla de equilibrio también están siendo bombardeadas continuamente por sus semejantes moléculas. Muchas de estas colisiones tienen suficiente energía para voltear la molécula trans de nuevo a la forma cis. Así, las moléculas cis no solo se están consumiendo sino que también se producen en el matraz. La concentración de las moléculas cis permanece constante porque la velocidad a la que se consumen se equilibra exactamente con la velocidad a la que se están produciendo.
En otras palabras, por cada molécula cis que voltea a la conformación trans en una parte del contenedor, habrá en promedio una molécula de isómero trans volteando en la dirección inversa en otra parte del recipiente. Esta reorganización constante de moléculas entre las formas cis y trans puede continuar indefinidamente sin ningún cambio neto en la concentración de ninguna de las especies.
Esta interpretación molecular del equilibrio no se limita al ejemplo particular de isomería cis-trans o incluso solo a reacciones químicas. En la sección sobre transiciones de fase describimos equilibrios vapor-líquido en los que la condensación de vapor apenas equilibró la evaporación del líquido. Cualquier estado de equilibrio corresponde a una situación en la que la velocidad a la que se produce la reacción directa es exactamente igual a la velocidad a la que se produce la reacción inversa. Dado que estas tasas son iguales, no hay cambio neto en la concentración de ninguno de los reactivos o productos con el tiempo. Debido a que un equilibrio corresponde a un equilibrio entre la reacción hacia adelante y la inversa de esta manera, utilizamos flechas dobles (\(\rightleftharpoons\)) en la ecuación.
Como otro ejemplo de equilibrio químico, tomemos una solución 0.001 M de ácido acético a 25°C. Como se ve en la sección sobre ácidos débiles, algo más del 10 por ciento de las moléculas de ácido acético en esta solución se han ionizado de acuerdo con la ecuación
\[\text{CH}_3\text{COOH} + \text{H}_2\text{O} \rightleftharpoons \text{CH}_3\text{COO}^{-} + \text{H}_3\text{O}^{+} \nonumber \]
Aunque las concentraciones de todas las especies en esta solución permanecen constantes con el tiempo, esto no significa que las moléculas de ácido acético hayan dejado de transferir protones a moléculas de agua. Las concentraciones permanecen constantes porque la reacción inversa (transferencia de un protón de un ion hidronio a un ion acetato) se está produciendo a la misma velocidad que la reacción directa. Por cada ion hidronio producido por una transferencia de protones en algún lugar de la solución, otro ion hidronio está perdiendo su protón en otro lugar. El resultado neto es que la concentración del ion hidronio permanece constante, y con ello las concentraciones de las otras especies involucradas.
La visión microscópica del equilibrio como una reorganización constante de especies químicas a menudo recibe un nombre especial y se le conoce como equilibrio dinámico. Es importante darse cuenta de que una vez que se ha establecido un equilibrio dinámico, un átomo en particular a veces aparece como parte de una de las moléculas del producto y a veces como parte de una de las moléculas reaccionantes.
En el equilibrio de ionización del ácido acético recién considerado, supongamos por el bien del argumento que podríamos identificar un átomo de oxígeno en particular de alguna manera. Si pudiéramos seguir ahora la historia de este átomo, encontraríamos que a veces formaría parte de una molécula de ácido acético, CH 3 CO*OH y a veces parte de un ion acetato, CH 3 CO*O —. Dado que el ácido está aproximadamente 10 por ciento ionizado, encontraríamos en promedio que nuestro oxígeno etiquetado pasaría solo el 10 por ciento de su tiempo como parte de un ion acetato y el 90 por ciento restante como parte de una molécula de ácido acético.
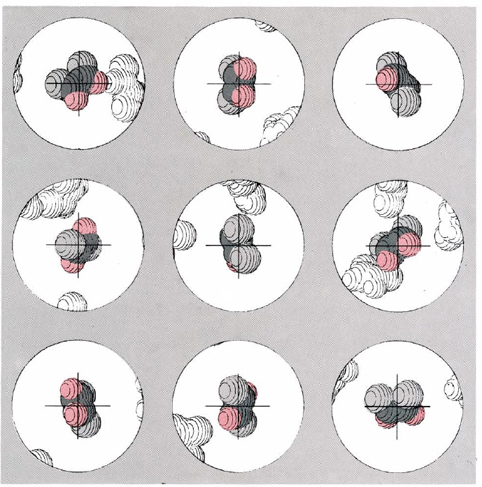
La Figura\(\PageIndex{1}\) da una simulación por computadora de esta vista dinámica del equilibrio para el equilibrio de isomerización cis-trans de difluoroeteno a 623 K. Supongamos que fue posible colorear una de las moléculas en la mezcla de equilibrio y fotografiarla a intervalos regulares a partir de entonces bajo una alta potencia microscopio. La figura muestra el tipo de resultados que podríamos esperar. En cada “fotografía” la molécula aparece en una orientación diferente ― entre las fotos ha sido rebotada bastante por colisiones con otras moléculas. Una inspección cuidadosa revela un hecho más importante. Tres de las nueve fotografías muestran la molécula tamizada en la conformación trans, mientras que en las otras seis la molécula tiene la conformación cis. Si continuáramos tomando un gran número de fotografías de esta molécula, encontraríamos en promedio que se conservaría esta proporción. En promedio un tercio de las fotografías mostraría la conformación trans, mientras que los otros dos tercios mostrarían la forma cis. La situación es como si tuviéramos una matriz cúbica convencional de seis caras con la palabra trans impresa en dos caras y la palabra cis impresa en las otras cuatro. Si rodamos este dado un número suficiente de veces, saldrá cis el doble de veces que trans.
Ahora podemos comenzar a ver por qué es que la constante de equilibrio para esta reacción es 0.5 a 623 K. No solo la molécula tamizada, sino también todas las demás moléculas en la mezcla de equilibrio, pasa un tercio de su tiempo en la conformación trans y dos tercios en la conformación cis. En un momento dado, por lo tanto, encontraremos una mezcla en la que un tercio de las moléculas son trans mientras que los otros dos tercios son cis. La relación de trans a cis será 1:2, o 0.5, como se encuentra experimentalmente.
Tal explicación todavía no es toda la historia. Todavía necesitamos explicar por qué los dados están cargados contra la conformación trans de una molécula de difluoroeteno. ¿Por qué es que es menos probable que este isómero ocurra en la reorganización constante entre las dos conformaciones causadas por las continuas colisiones aleatorias de moléculas entre sí en la mezcla de equilibrio? La razón es que el isómero trans es ligeramente mayor en energía que la forma cis. El cambio de entalpía Δ H m para la reacción
\[cis-\text{C}_2\text{H}_2\text{F}_2 \rightarrow trans-\text{C}_2\text{H}_2\text{F}_2 \nonumber \]
tiene el valor pequeño, pero positivo, de +3.88 kJ mol —1.
En cualquier colección de moléculas, la energía se transfiere constantemente de una molécula a otra a medida que chocan. En este intercambio continuo de energía, inevitablemente algunas moléculas adquieren más energía cinética o potencial que sus otras moléculas. Sin embargo, al considerar la distribución de la energía cinética, la probabilidad de que una molécula adquiera una energía determinada depende de la magnitud de esa energía. Cuanto mayor sea la energía, menos probable es que ocurra. En la constante reorganización de energías, las moléculas que son incluso ligeramente más altas en energía que sus compañeros ocurren con poca frecuencia. En el caso bajo consideración, dado que una molécula de trans-difluoroeteno es 3.88 kJ mol —1 más alta en energía que la forma cis, ocurrirá con menos frecuencia que la forma cis en una mezcla de equilibrio en la que cada molécula está constantemente volteando hacia adelante y hacia atrás entre las dos formas. En otras palabras, el dado se carga contra la configuración trans porque es mayor en energía.
Ahora también podemos entender por qué la posición de equilibrio para esta reacción varía con la temperatura. A una temperatura muy baja será raro que una molécula adquiera los 3.88 kJ mol —1 adicionales necesarios para que tenga la configuración trans. En consecuencia, se espera que la mezcla de equilibrio contenga muchas menos moléculas trans que las moléculas cis y la constante de equilibrio
\[K_{c}=\frac{\text{ }\!\![\!\!\text{ }trans\text{-C}_{\text{2}}\text{H}_{\text{2}}\text{F}_{\text{2}}\text{ }\!\!]\!\!\text{ }}{\text{ }\!\![\!\!\text{ }cis\text{-C}_{\text{2}}\text{H}_{\text{2}}\text{F}_{\text{2}}\text{ }\!\!]\!\!\text{ }} \nonumber \]
para ser bastante pequeño. En efecto, si fuera posible bajar el sistema a cero absoluto, no serían posibles moléculas trans y el valor de K c sería cero. A medida que aumenta la temperatura, la probabilidad de que una molécula adquiera suficiente energía para asumir la configuración trans aumenta, y aumenta junto con ella. Sin embargo, K c no puede aumentar indefinidamente.
Si la temperatura es lo suficientemente alta, la diferencia de energía entre las configuraciones cis y trans se vuelve insignificante en comparación con la energía cinética promedio de una molécula. Ambas formas serán entonces casi igualmente probables, y el valor de K c será muy ligeramente inferior a 1.
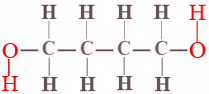
Muy pocos equilibrios químicos son tan simples como el isomerismo cis-trans del difluoroeteno. En casi todos los demás casos la posición de equilibrio se rige no sólo por la diferencia de energía entre reactivos y productos sino también por un factor de probabilidad que es independiente de la energía. Un ejemplo simple de tal factor de probabilidad es proporcionado por el equilibrio entre las formas de anillo y cadena del 1,4-butanodiol. La fórmula de proyección para este alcohol es
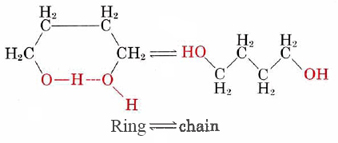
\[K_{c}=\frac{\text{ }\!\![\!\!\text{ chain }\!\!]\!\!\text{ }}{\text{ }\!\![\!\!\text{ ring }\!\!]\!\!\text{ }}=\text{1}\text{.22} \nonumber \]
De manera que hay cerca de 22 por ciento más moléculas de cadena que moléculas de anillo en la mezcla de equilibrio a esta temperatura. Esto es contrario a lo que uno esperaría si la energía fuera el único factor involucrado en la determinación de la posición de equilibrio. La forma de cadena de la molécula es obviamente mayor en energía que la forma de anillo, ya que la energía debe suministrarse para romper el enlace de hidrógeno. De hecho, Δ H m para la Ec. (1) se encuentra que es +13.5 kJ mol —1. Sobre la base de nuestro argumento anterior, si la forma de cadena es mayor en energía, debería ser menos probable que la forma de anillo y K c debería ser menor que 1. El hecho experimental de que K c es mayor que 1 significa que hay algún otro factor que hace que la forma de la cadena sea más probable de lo que sería el caso si la energía sola fuera responsable.Para ver cuál es este otro factor, supongamos que de alguna manera podemos investigar nuestro sistema a una temperatura que es tan alta que la diferencia de energía entre el anillo y la forma de la cadena es insignificante. (En la práctica, el disolvente tetracloruro de carbono se desprendería por ebullición mucho antes de que se obtuviera esta temperatura). A tal temperatura, si la diferencia de energía entre las dos formas fuera el único factor que determina su probabilidad relativa, esperaríamos que las formas de anillo y cadena (que se ven a continuación) sean igualmente probables. Sin embargo, es fácil ver por qué este no sería realmente el caso.
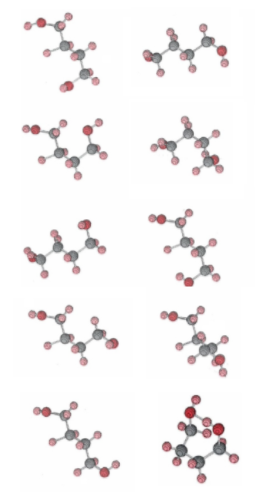
La forma de cadena del 1,4-butanodiol es una molécula muy flexible debido a la rotación libre que es posible alrededor de los tres enlaces carbono-carbono y los dos enlaces carbono-oxígeno. Al colisionar con sus semejantes moléculas, puede adoptar un número muy grande de conformaciones diferentes. La siguiente figura ilustra algunas de estas conformaciones, seleccionadas al azar por una computadora. Nuevamente podemos tomarlas como representativas de una serie de fotografías de la misma molécula tomadas a intervalos regulares, digamos cada 5 min. En aras de la claridad, sin embargo, hemos mantenido la misma posición de dos de los átomos de carbono para cada fotografía. De hecho, la molécula estaría rotando así como flexionándose, y la orientación del enlace que une estos dos átomos de carbono estaría cambiando continuamente. También debemos recordar que la molécula ha sufrido muchísimas colisiones entre fotografías sucesivas.
Figura\(\PageIndex{2}\) La forma de cadena del butanodiol. Debido a que varios segmentos de la molécula son libres de rotar alrededor de los enlaces carbono-carbono y carbono-oxígeno, la molécula puede adoptar un gran número de conformaciones. Se muestra una selección aleatoria de nueve de estos. Tenga en cuenta que en ninguno de estos están los dos átomos de oxígeno lo suficientemente cerca para que el hidrógeno se unan entre sí y formen un anillo. La forma de anillo de butanodiol. está en la parte inferior derecha. Los dos átomos de oxígeno en la parte superior del anillo están unidos por hidrógeno. Desde un punto de vista estrictamente geométrico se trata de una conformación bastante improbable para la molécula. Es sólo por la disminución de la energía causada por la formación de un enlace de hidrógeno que esta forma de anillo resulta ser ligeramente más probable en la mezcla de equilibrio que la forma de cadena a bajas temperaturas.
Lo importante a notar sobre esta selección aleatoria de nueve conformaciones que se muestra en la Figura\(\PageIndex{2}\) es que en ninguna de ellas están los dos átomos de oxígeno lo suficientemente cerca como para permitir la formación de un enlace de hidrógeno. A esta alta temperatura, debido a la gran cantidad de formas en que una molécula de butanediol puede disponerse en el espacio, sólo ocasionalmente adoptará una conformación de anillo como la que se muestra en la Figura\(\PageIndex{3}\) en la que los dos átomos de oxígeno están lo suficientemente cerca para que el hidrógeno se unan entre sí. En la mezcla de equilibrio a alta temperatura, por lo tanto, habrá muchas más moléculas de cadena que moléculas de anillo y K c será mucho mayor que 1.
Esta situación comienza a cambiar a medida que se reduce la temperatura. Con la disminución de la temperatura, una fracción cada vez más pequeña de las moléculas tendrá suficiente energía para romper un enlace de hidrógeno. En consecuencia la forma del anillo será más probable. Una vez formado, un anillo podrá sobrevivir a bastantes colisiones con otras moléculas antes de que se vuelva a abrir. En efecto, si pudiéramos reducir la temperatura de nuestro sistema cerca del cero absoluto sin que el disolvente se congelara, entonces encontraríamos que prácticamente todas las moléculas de butanodiol estaban en forma de anillo. Una vez formado, un anillo casi nunca experimentaría una colisión que fuera lo suficientemente enérgica como para abrirla. A una temperatura tan baja el valor de K c estaría muy cerca de cero.
Los dos equilibrios que acabamos de describir han sido ambos ejemplos muy sencillos, sobre todo porque cada uno involucraba solo un reactivo y un producto. Sin embargo, los principios que hemos descubierto al discutirlos se aplican a todos los equilibrios químicos. Siempre podemos interpretar la constante de equilibrio de una reacción química como el producto de dos factores, cada uno de los cuales tiene un significado a nivel microscópico:
K = factor de energía × factor de probabilidad (2)El factor energético toma en cuenta el hecho de que o bien los productos o los reactivos son mayores en energía y por lo tanto menos probables en la reorganización constante de la energía que se produce entre las moléculas. El factor de probabilidad toma en cuenta el hecho de que aunque no hubiera diferencia energética entre productos y reactivos, uno u otro seguiría siendo más probable. Esta mayor probabilidad surge por el mayor número de formas en las que los productos (o reactivos) pueden realizarse a nivel molecular.
En general el factor energético tiene el mayor efecto sobre el valor de la constante de equilibrio a bajas temperaturas. Cuanto menor es la temperatura, mucho menor es la probabilidad de que una especie de alta energía ocurra por casualidad en la reorganización de energía constante. A temperaturas más altas el efecto del factor de energía se vuelve menos pronunciado y el factor de probabilidad se vuelve más importante. Si la temperatura puede elevarse lo suficientemente alta, finalmente predomina el factor de probabilidad.


