18.12: Catálisis Heterogénea
- Page ID
- 76228
Nuestra discusión previa se ha concentrado en catalizadores que se encuentran en la misma fase en la que se cataliza la reacción. Este tipo de catálisis se llama catálisis homogénea. Muchos procesos industriales importantes se basan en catálisis heterogénea, en la que el catalizador se encuentra en una fase diferente. Por lo general, el catalizador es un sólido y los reactivos son gases, y así la etapa limitante de velocidad ocurre en la superficie sólida. Por lo tanto, la catálisis heterogénea también se conoce como catálisis superficial.
Los mecanismos detallados de la mayoría de las reacciones heterogéneas aún no se entienden, pero ciertos sitios en la superficie del catalizador parecen ser capaces de debilitar o romper enlaces en las moléculas reaccionantes. Estos se denominan sitios activos. Un ejemplo de catálisis heterogénea es la hidrogenación de un compuesto orgánico insaturado tal como etano (C2H4) por catalizadores metálicos tales como Pt o Ni:
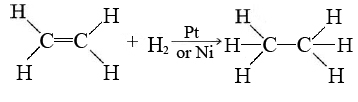 El mecanismo actualmente aceptado para esta reacción implica la débil unión de H 2 y C 2 H 4 a átomos en la superficie metálica. Esto se llama adsorción. Las moléculas H 2 se disocian a átomos de H individuales, cada uno de los cuales está débilmente unido a un átomo de Pt:
El mecanismo actualmente aceptado para esta reacción implica la débil unión de H 2 y C 2 H 4 a átomos en la superficie metálica. Esto se llama adsorción. Las moléculas H 2 se disocian a átomos de H individuales, cada uno de los cuales está débilmente unido a un átomo de Pt:
-
- \[\ce{H2 + 2Pt (surface) -> 2H ---Pt(surface)} \nonumber \]
Los catalizadores heterogéneos se utilizan ampliamente en la industria petrolera. Un ejemplo es la combinación de SiO 2 y Al 2 O 3 utilizada para acelerar el craqueo de hidrocarburos de cadena larga en las moléculas más pequeñas necesarias para la gasolina. Otro es el catalizador de Pt utilizado para reformar cadenas de hidrocarburos en estructuras de anillos aromáticos. Esto mejora el índice de octanaje de la gasolina, haciéndola más adecuada para su uso en motores de automóviles. Otras industrias también hacen uso efectivo de catalizadores. El SO 2, obtenido al quemar azufre (o incluso a partir de la quema de carbón), se puede oxidar a SO 3 sobre pentóxido de vanadio, V 2 O 5. Este es un paso importante en la fabricación de H 2 SO 4.
Otro catalizador heterogéneo importante se utiliza en el proceso Haber para la síntesis de NH 3 a partir de N 2 y H 2. Como ocurre con la mayoría de los catalizadores industriales, su composición exacta es un secreto comercial, pero es principalmente Fe con pequeñas cantidades de Al 2 O 3 y K 2 O agregadas.
El catalizador de superficie con el que es más probable que esté familiarizado se encuentra en los sistemas de escape de muchos automóviles construidos desde 1976. Dicho convertidor catalítico contiene de 1 a 3 g de Pt en una capa fina sobre la superficie de una estructura similar a un panal o pequeñas perlas hechas de Al 2 O 3. El catalizador acelera la oxidación de hidrocarburos no quemados y CO que de otro modo se emitirían desde los gases de escape como contaminantes del aire. Aparentemente lo hace adsorbiendo y debilitando el enlace en la molécula O 2. Los átomos de O individuales se transfieren más fácilmente a moléculas de CO o hidrocarburos, produciendo CO 2 y H 2 O. Esta acción de la superficie catalítica puede inhibirse o envenenarse si los átomos de plomo (del tetraetilplomo en la gasolina con plomo) reaccionan con la superficie. De ahí la prohibición del uso de combustible con plomo en automóviles equipados con convertidores catalíticos.


