20.13: Los Aminoácidos
- Page ID
- 75133
En total hay 20 aminoácidos que ocurren comúnmente en todos los organismos. En la mayoría de las circunstancias los aminoácidos existen como zwitteriones y tienen la fórmula general
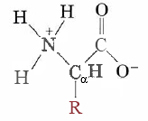
R representa un grupo llamado cadena lateral que varía de un aminoácido a otro. Un aspecto de la estructura de aminoácidos no obvio en la representación anterior es la estereoquímica. Observe en la imagen de arriba el carbono marcado con un α, tiene 4 grupos diferentes unidos a él, y así los aminoácidos son quirales. Uno de los objetos quirales más familiares son las manos y, por lo tanto, a menudo se piensa en la quiralidad en términos de mano. A continuación se presentan los dos enantiómeros del aminoácido alanina, L-alanina y R-alanina, por lo que se puede ver la diferencia.
Los dos enatiómeros de alanina, L-alanina y R-alanina. Por más que intentes, es imposible poner estas dos moléculas exactamente en la misma posición, son imágenes especulares. La forma L es el isómero que se ve en los organismos.
¿Cómo se sabe la diferencia entre los dos enantiómeros? Si bien la mayoría de los químicos utilizan el sistema de prioridad R y S para distinguir entre enantiómeros, muchos compuestos bioquímicos, incluyendo aminoácidos y azúcares utilizan el sistema D y L. Esto se basa en un método histórico para determinar enatiómeros usando gliceraldehído. El gliceraldehído es un azúcar quiral de tres carbonos. con una forma clasificada como D y la otra como L. Los aminoácidos y azúcares se pueden sintetizar a partir de gliceraldehído. Los enantiómeros sintetizados a partir de la forma D del gliceraldehído también están etiquetados como D, mientras que los de la forma L, L. Para determinar si un aminoácido es L o D, observe el carbono α, de manera que el átomo de hidrógeno esté directamente detrás de él. Esto debería colocar a los otros tres grupos funcionales en un círculo. Siga de CO OH a R a N H 2, o CORN. Si esto es en sentido contrario a las agujas del reloj, el aminoácido está en el isómero L. Si este orden es en el sentido de las agujas del reloj, el aminoácido es un isómero D. Prueba este truco con los dos modelos de alanina.
Si asignó prioridad y utilizó el sistema R, S, encontrará que la mayoría de los aminoácidos son isómeros S. Sin embargo, hay una excepción, que es la cisteína. el azufre en el grupo R le da prioridad sobre el grupo ácido carboxílico. Este es un isómero R en el sistema R, S, pero un isómero L en el sistema D, L.
Las estructuras de los 20 grupos R diferentes se dan en la Figura \(\PageIndex{1}\), donde se muestran como parte de una cadena polipeptídica. La figura también muestra el código de tres letras y el código de una letra que se utilizan a menudo para identificar aminoácidos en una cadena polipeptídica.
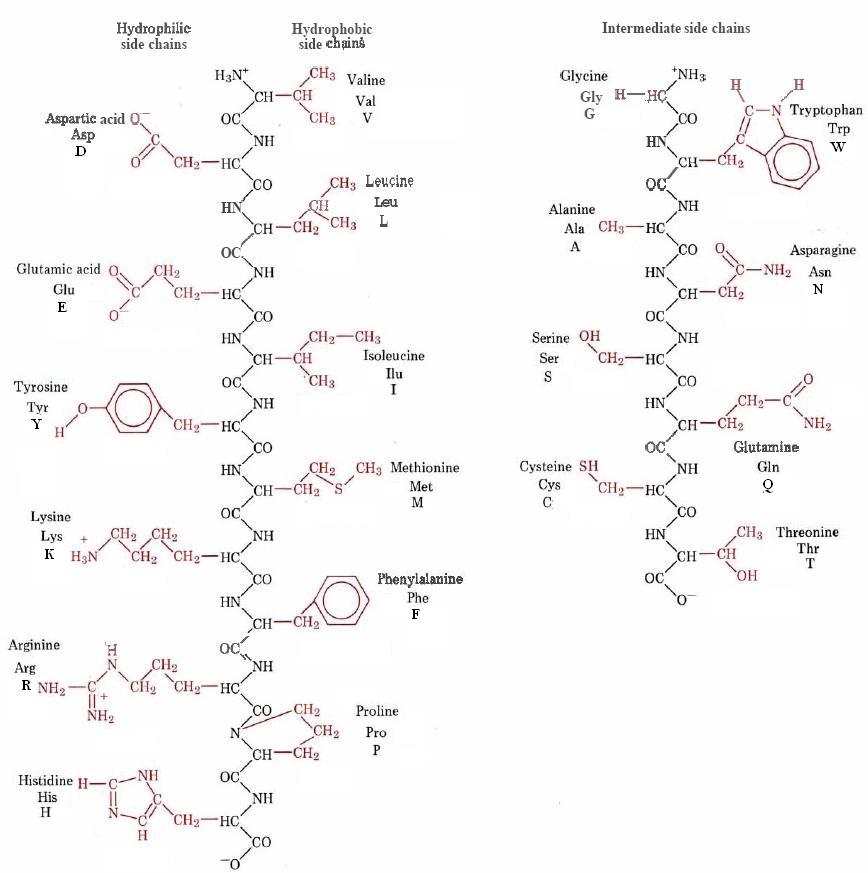
Aunque cada cadena lateral de aminoácidos tiene sus propias propiedades individuales, es útil dividirlas en varias categorías. En la Figura \(\PageIndex{1}\)esto se ha hecho sobre la base de cuán fuertemente hidrófilos o hidrófobos son. En el extremo izquierdo de la figura se encuentran las seis cadenas laterales más hidrófilas. Todos son polares, y cuatro son realmente iónicos a un pH de 7. A continuación en la figura están las seis cadenas laterales más hidrofóbicas. Todos estos son grandes y no polares y no contienen átomos altamente electronegativos como el nitrógeno y el oxígeno. Las ocho cadenas laterales restantes contienen pequeños grupos no polares o grupos de polaridad bastante limitada, y por lo tanto no son muy fuertemente hidrófilas o muy fuertemente hidrófobos.
Si una cadena lateral es hidrófila o hidrófoba tiene una influencia considerable en la conformación de la cadena polipeptídica. Al igual que las colas de hidrocarburos de las moléculas de ácidos grasos, las cadenas laterales de aminoácidos hidrófobos tienden a evitar el agua y se agrupan junto con otros grupos no polares. En una proteína globular como la tripsina, por ejemplo, la mayoría de los residuos hidrófobos se encuentran entre las cadenas retorcidas en lo profundo de la molécula. Las cadenas laterales hidrófilas, por el contrario, tienden a ocupar posiciones en la superficie exterior, donde entran en contacto con las moléculas de agua circundantes. Los enlaces de hidrógeno y las fuerzas dipolares atraen estas moléculas de agua y ayudan a solubilizar la proteína globular. Si todos los grupos R no polares estuvieran expuestos al medio acuoso, la proteína sería mucho menos soluble.


