20.15: Estructura de Proteína Secundaria
- Page ID
- 75168
Uno podría esperar que una molécula de proteína de cadena larga sea bastante flexible, adoptando una variedad de formas moleculares y cambiando rápidamente de una conformación a otra. En la práctica esto rara vez ocurre. En cambio, la cadena proteica permanece más o menos en la misma conformación todo el tiempo. Se mantiene en esta forma por el efecto cooperativo de un gran número de enlaces de hidrógeno entre diferentes segmentos de la cadena.
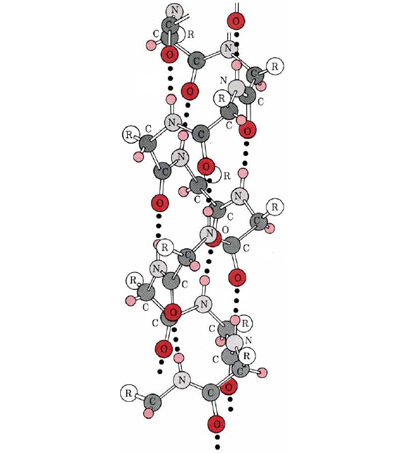
Una conformación particularmente importante de la cadena polipeptídica es la estructura espiral mostrada en la Figura \(\PageIndex{1}\). Esto se llama hélice α. Muchas proteínas fibrosas como el cabello, la piel y las uñas consisten casi en su totalidad en hélices α. También en las proteínas globulares, aunque la estructura general es más compleja, las longitudes cortas de la cadena suelen tener esta configuración. En una hélice a, la cadena polipeptídica se tuerce en una espiral derecha, la cadena gira en sentido horario a medida que uno se mueve a lo largo de ella. La espiral se mantiene unida por enlaces de hidrógeno desde el grupo amido () de un enlace peptídico al grupo carbonilo de un enlace peptídico tres residuos más alejados a lo largo de la cadena. Dos factores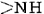 contribuyen a hacer de esta una
contribuyen a hacer de esta una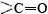 estructura particularmente estable. Una es la implicación de todos los
estructura particularmente estable. Una es la implicación de todos los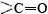 grupos
grupos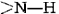 y en la cadena en el enlace de hidrógeno. Las espirales con un poco más o un poco menos de giro no lo permiten. El segundo factor es la forma en que las cadenas laterales se proyectan hacia afuera desde una hélice α. Por lo tanto, las cadenas laterales voluminosas no interfieren con los enlaces de hidrógeno, lo que permite formar un cilindro bastante rígido.
y en la cadena en el enlace de hidrógeno. Las espirales con un poco más o un poco menos de giro no lo permiten. El segundo factor es la forma en que las cadenas laterales se proyectan hacia afuera desde una hélice α. Por lo tanto, las cadenas laterales voluminosas no interfieren con los enlaces de hidrógeno, lo que permite formar un cilindro bastante rígido.
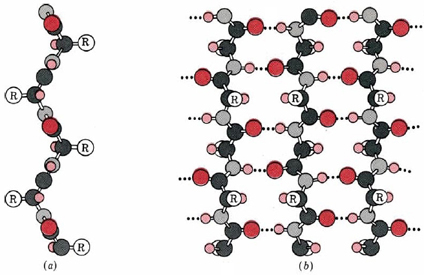
Una segunda disposición regular de la cadena polipeptídica es la lámina β, la estructura β-queratina que se encuentra en la seda y se muestra en la Figura \(\PageIndex{2}\). Al igual que en la hélice α, esta estructura permite que todos los grupos amido y carbonilo participen en enlaces de hidrógeno. Esta estructura de enlaces de hidrógeno se puede lograr de dos maneras, ya sea una lámina β paralela o antiparalela, las cuales se comparan en la Figura \(\PageIndex{3}\). Sin embargo, a diferencia de la hélice α, las cadenas laterales se aprisionan bastante juntas en una disposición de lámina plisada. En consecuencia, las cadenas laterales muy voluminosas hacen que la estructura sea inestable. Esto explica por qué la seda está compuesta casi en su totalidad por glicina, alanina y serina, los tres aminoácidos con las cadenas laterales más pequeñas. La mayoría de las otras proteínas contienen una colección mucho más fortuita de residuos de aminoácidos.


