20.16: Estructura de orden superior
- Page ID
- 75134
Varias de las cadenas laterales de aminoácidos son difíciles de encajar en los tipos de estructura de hélice α o lámina β. Un ejemplo obvio es la prolina, en la que el grupo R es un anillo e incluye nitrógeno unido al carbono α. Cuando la prolina está involucrada en un enlace peptídico, todos los hidrógenos desaparecen del nitrógeno, sin dejar sitio para el enlace de hidrógeno.
Otro problema involucra las cadenas laterales que tienen la misma carga, como las de lisina y arginina o ácido glutámico y ácido aspártico, que se repelen entre sí considerablemente. Cuando ocurren juntos, estos grupos también pueden desestabilizar una hélice α o una estructura laminar β. La presencia de varios grupos del tipo recién mencionado permite que una cadena proteica se doble bruscamente en lugar de colocarla plana o rizarse regularmente en espiral. Tales curvas afiladas conectan secciones de hélice α o estructuras de lámina β en las proteínas globulares. Permiten que la cadena polipeptídica se doble sobre sí misma, plegando la proteína en una forma muy compacta, casi esférica. La naturaleza de este plegamiento se conoce como estructura terciaria, ya que implica un tercer nivel organizacional por encima de la secuencia de aminoácidos primaria y la hélice α secundaria o lámina β.
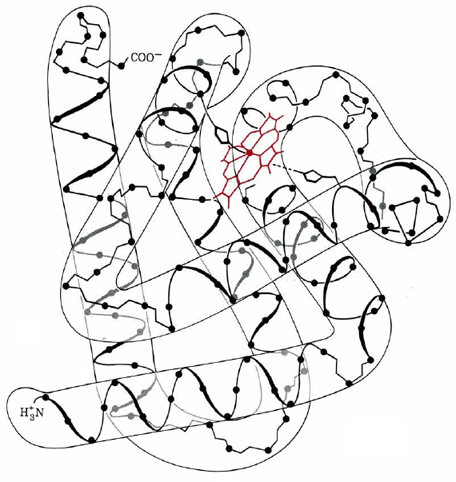
Un excelente ejemplo de estructura terciaria en una proteína globular es proporcionado por la vista tridimensional de la mioglobina esperma-ballena en la Figura \(\PageIndex{1}\). La estructura molecular consiste en ocho segmentos relativamente rectos de una hélice. El más largo de estos contiene 23 aminoácidos, el más corto solo 7. Menos de 50 de los 153 aminoácidos de la mioglobina se encuentran en las curvas entre las hélix, pero todos los residuos de prolina entran en esta categoría, al igual que muchos de los otros que desestabilizan la hélice α o lámina β. (Aunque solo la hélice α es prominente en la estructura de la mioglobina, se encuentra que otras proteínas globulares tienen regiones que consisten en láminas β).
Se pueden hacer varias otras generalizaciones importantes sobre la estructura de la mioglobina. Incluso en regiones donde la cadena se tuerce en una hélice α, casi todos los grupos R no polares apuntan hacia el interior de la molécula. Aquí se amontonan tan estrechamente que solo cuatro moléculas de agua pueden entrar. La superficie exterior de la proteína, sin embargo, contiene todos los grupos R polares. Estos interactúan fuertemente con las muchas moléculas de agua que normalmente rodean la mioglobina en el tejido muscular.
Aunque las mioglobinas aisladas de una variedad de mamíferos difieren ligeramente en su estructura primaria, todas parecen tener casi la misma forma molecular general. Aparentemente algunos de los aminoácidos son mucho más importantes que otros en la determinación de los puntos de flexión y otras características cruciales de la estructura terciaria. Las sustituciones en posiciones menos importantes no provocan grandes variaciones en la capacidad de la proteína para llevar a cabo su función biológica.
Finalmente, la Figura \(\PageIndex{1}\)muestra claramente que la mioglobina contiene un grupo protésico. En este caso se trata del grupo hemo, el cual contiene un átomo de hierro rodeado por cuatro nitrógenos en una estructura anular plana conocida como porfirina. El anillo de porfirina no está unido covalentemente a la cadena proteica, sino que encaja perfectamente en un “bolsillo” rodeado por varios segmentos de hélice. Un átomo de nitrógeno en una cadena lateral de histidina en una hélice forma un enlace covalente coordinado con el hierro en el grupo hemo, pero aparte de esto, el grupo protésico se posiciona únicamente por la forma en que se pliega la cadena proteica.
El hierro en el grupo hemo marca el sitio activo en el que se logra la función de almacenamiento de oxígeno de la mioglobina. El hierro, al igual que otros iones de metales de transición de primera fila, normalmente forma seis enlaces dirigidos hacia las esquinas de un octaedro. En la mioglobina solo se encuentran cinco enlaces al hierro. La sexta posición (opuesta al nitrógeno de histidina) puede ser ocupada por una molécula de oxígeno, proporcionando un sitio de almacenamiento conveniente. Si la concentración de oxígeno cerca de la proteína cae, esta unión se invierte, liberando oxígeno para reponer el suministro.
Si un ion de hierro puede unirse a una molécula de oxígeno, puede preguntarse por qué son necesarias las complicadas estructuras de porfirina y proteínas. Es para evitar la oxidación del hierro en el grupo hemo del hierro (II) al estado de oxidación del hierro (III). Debido a que la molécula de oxígeno necesita ganar dos electrones para oxidarse mientras que el hierro (II) solo puede suministrar uno, no se produce transferencia de electrones. Si el átomo de hierro (II) en el hemo no estuviera rodeado por la cadena proteica, una molécula de agua podría tomar parte como intermediario en el mecanismo de transferencia de electrones y podría ocurrir una reducción del oxígeno. Sin embargo, tal como están las cosas, la molécula de oxígeno no se puede reducir hasta que sea liberada por la mioglobina. Así, los efectos combinados de la estructura terciaria de la proteína, el grupo protésico y un sitio activo especializado permiten que la mioglobina cumpla con su función biológica de almacenar moléculas de oxígeno hasta que sea necesario, sin permitir que se reduzcan durante el almacenamiento.
En algunas proteínas todavía hay un cuarto nivel de organización, marcada estructura cuaternaria. Esto puede ser ilustrado por la hemoglobina, cuya función como portador de oxígeno en el torrente sanguíneo es bien conocida. La hemoglobina consiste esencialmente en cuatro moléculas de mioglobina empaquetadas juntas en una sola unidad. Cuatro cadenas polipeptídicas separadas se pliegan cada una como en la mioglobina y luego anidan juntas. La forma en que estas cuatro subunidades encajan entre sí constituye la estructura cuaternaria.
Al igual que el otro tipo de estructuras, la estructura cuaternaria contribuye a la función de una proteína. En el caso de la hemoglobina, una molécula de oxígeno unida a una subunidad provoca ligeros cambios en la estructura terciaria y cuaternaria que facilitan que otras moléculas de oxígeno se unan a las otras subunidades. En consecuencia, la hemoglobina en los pulmones puede cargarse con su complemento completo de cuatro moléculas de oxígeno con bastante facilidad, factor que aumenta su eficiencia en el transporte de oxígeno a los tejidos corporales. Lo contrario también es cierto: la pérdida de una molécula de oxígeno causa ligeros reordenamientos estructurales que permiten que las tres restantes salgan más fácilmente.


