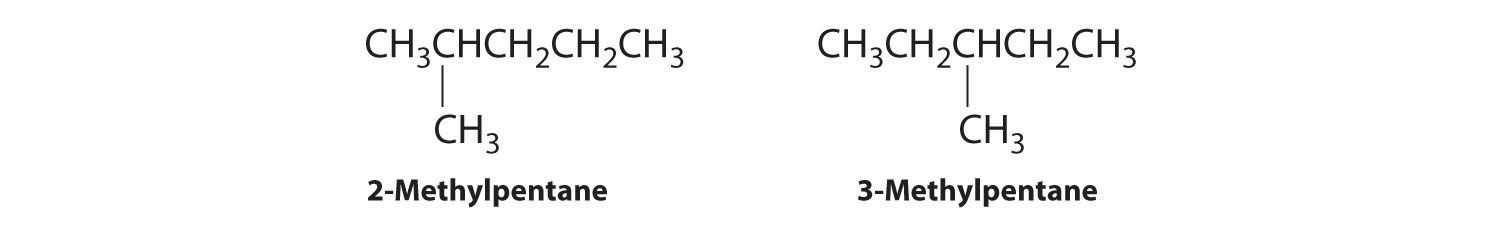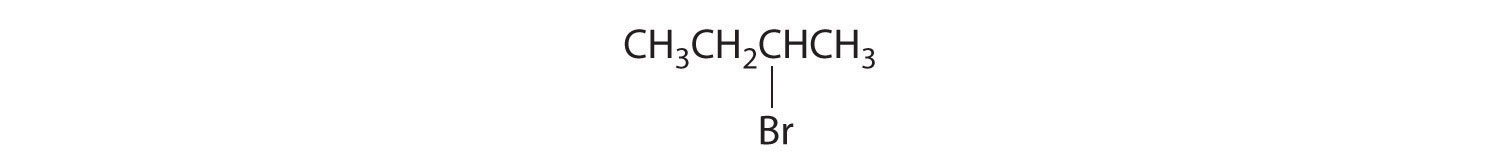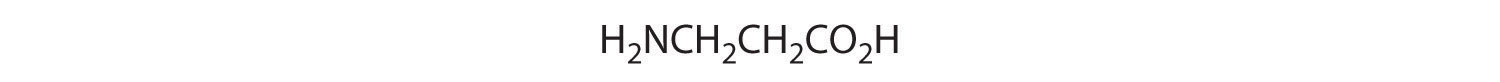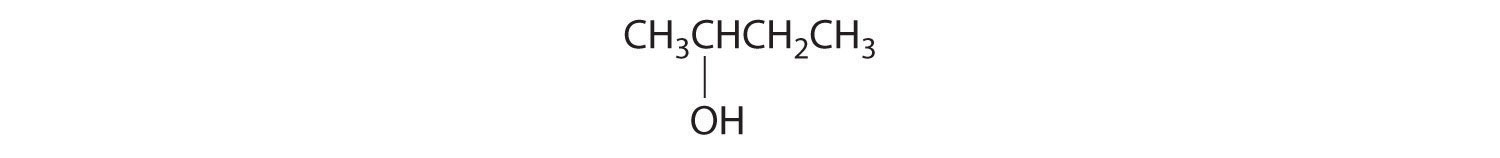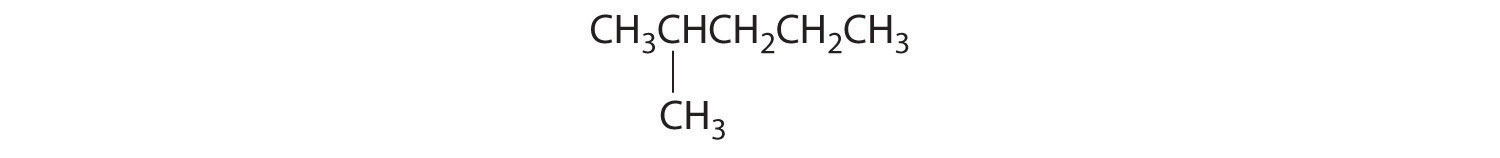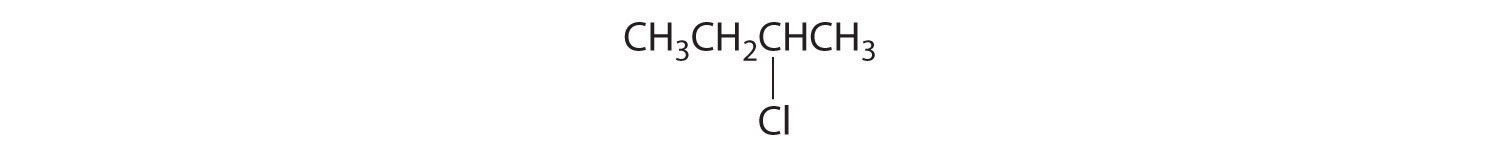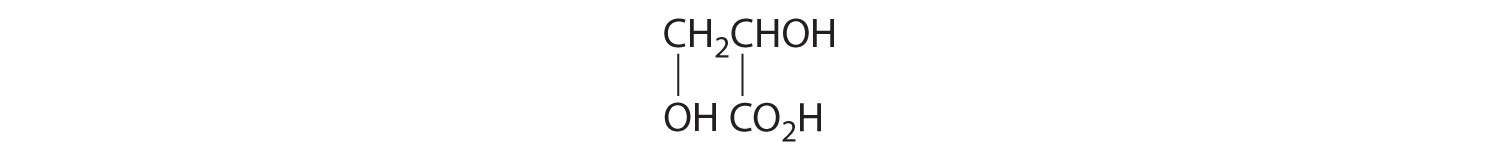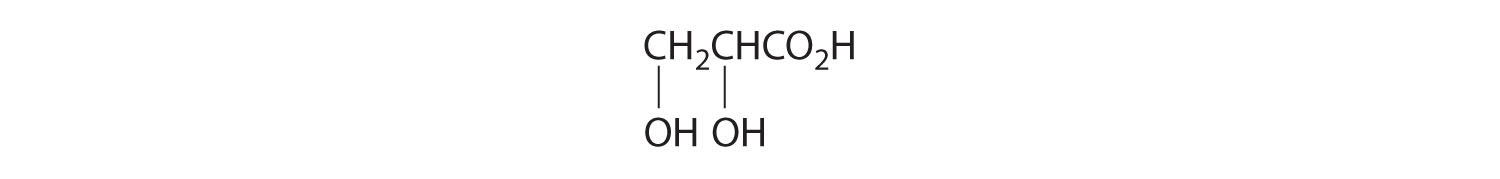23.3: Isómeros de Compuestos Orgánicos
- Page ID
- 78376
- Aprender cómo los compuestos orgánicos con la misma fórmula molecular pueden tener diferentes estructuras tridimensionales.
En discusiones anteriores sobre compuestos orgánicos, nos enfocamos en las diferencias en la forma en que los grupos funcionales estaban conectados con el marco de carbono. Las diferencias en la conectividad resultaron en diferentes compuestos químicos con diferentes nombres. Aprendiste, por ejemplo, que aunque el 1-propanol (n-propanol) y el 2-propanol (isopropanol) tienen la misma fórmula molecular (C 3 H 8 O), tienen diferentes propiedades físicas y químicas. Al igual que con los complejos metálicos, los compuestos que tienen la misma fórmula molecular pero diferentes disposiciones de átomos se denominan isómeros. (Para mayor información sobre los complejos metálicos, consulte la Sección 21.4.) En esta sección, se describen diversos tipos de isómeros, comenzando por aquellos cuyas estructuras tridimensionales difieren solo como resultado de la rotación alrededor de un enlace C-C.
Isómeros conformacionales
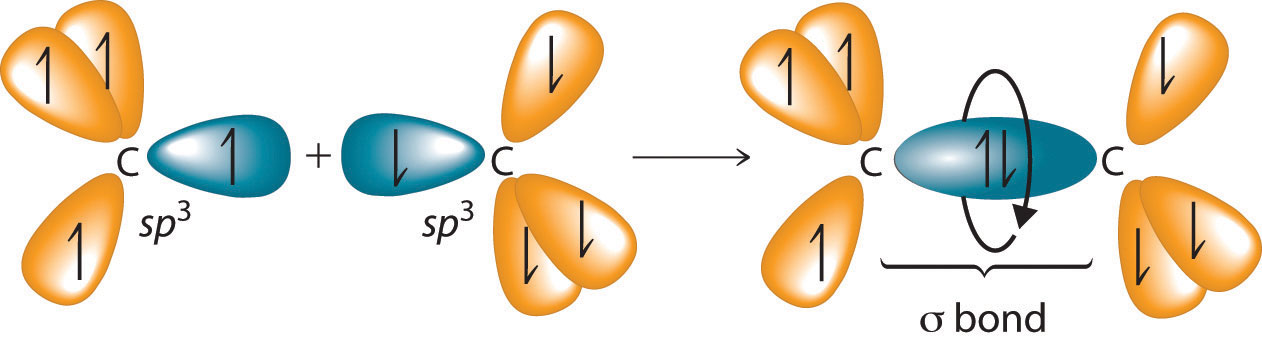
Los enlaces simples C—C en etano, propano y otros alcanos se forman por la superposición de un orbital híbrido sp 3 en un átomo de carbono con un orbital híbrido sp 3 en otro átomo de carbono, formando un enlace σ (Figura 23.2.1). Cada orbital híbrida sp 3 es simétrica en forma cilíndrica (todas las secciones transversales son círculos), lo que resulta en un enlace sencillo carbono-carbono que también es simétrico en forma cilíndrica alrededor del eje C-C. Debido a que la rotación sobre el enlace simple carbono-carbono puede ocurrir sin cambiar la superposición de los orbitales híbridos sp 3, no hay una barrera energética electrónica significativa para la rotación. En consecuencia, son posibles muchas disposiciones diferentes de los átomos, cada una correspondiente a diferentes grados de rotación. Las diferencias en la estructura tridimensional resultantes de la rotación alrededor de un enlace σ se denominan diferencias en la conformación, y cada disposición diferente se denomina isómero conformacional (o conformador) Isómeros cuyas estructuras tridimensionales difieren debido a la rotación alrededor de un enlace σ. .
Tenga en cuenta el patrón
Los isómeros conformacionales difieren en su estructura tridimensional debido a la rotación alrededor de un enlace σ.
Figura 23.2.1 Enlace carbono-carbono en alcanos Los orbitales híbridos sp 3 superpuestos en átomos de carbono adyacentes forman un enlace σ simétrico en forma cilíndrica. Debido a que la rotación alrededor del enlace no afecta la superposición de los orbitales de unión, no existe una barrera de energía electrónica para la rotación.
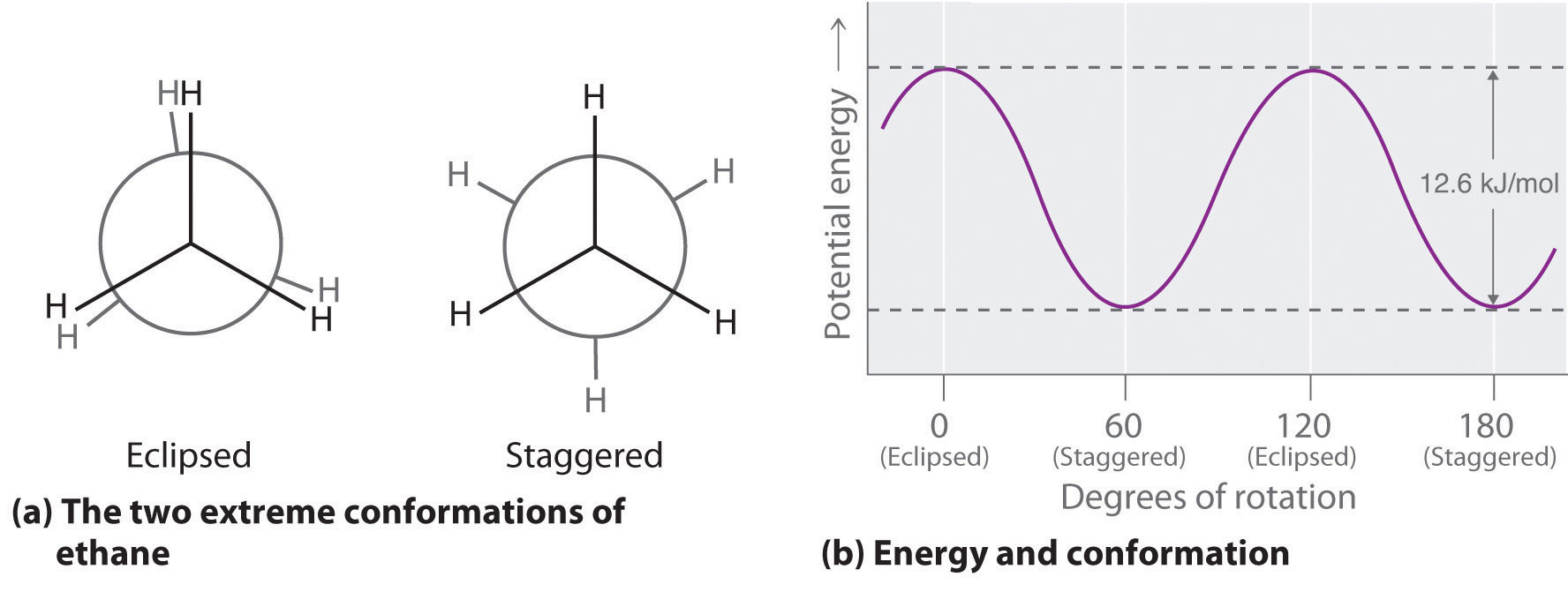
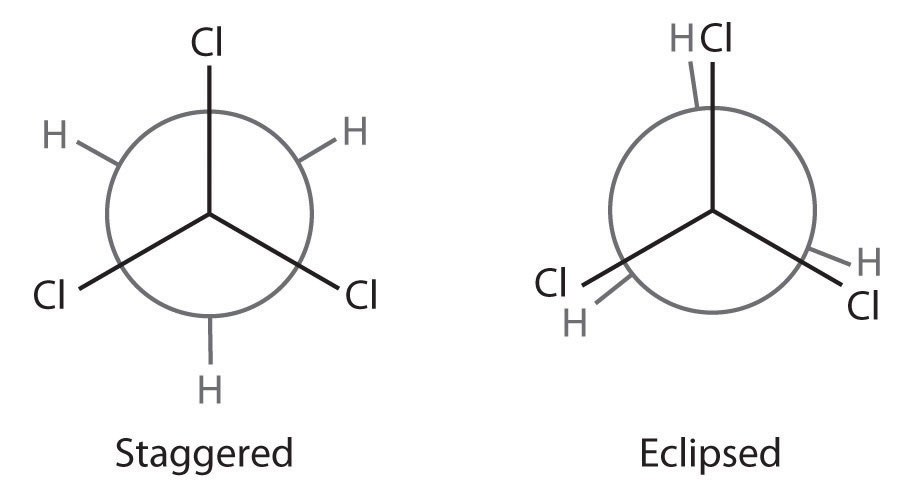
El alcano más simple para tener un isómero conformacional es el etano. Las diferencias entre las conformaciones del etano se representan de manera especialmente clara en los dibujos llamados proyecciones de Newman, como los que se muestran en la parte (a) de la Figura 23.2.2. En una proyección de Newman, la molécula de etano se ve a lo largo del eje C-C, con el carbono que se encuentra en frente mostrado como vértice y el carbono que se encuentra en la parte posterior se muestra como un círculo. Los tres átomos de hidrógeno más cercanos al espectador se muestran unidos al carbono frontal, y los tres átomos de hidrógeno más alejados del espectador se muestran unidos al círculo. En un extremo, llamado conformación eclipsada, los enlaces C-H en átomos de carbono adyacentes se encuentran en el mismo plano. En el otro extremo, llamado conformación escalonada, los átomos de hidrógeno se posicionan lo más lejos posible entre sí. La rotación alrededor del enlace C-C produce un número infinito de conformaciones entre estos dos extremos, pero la conformación escalonada es la más estable porque minimiza la repulsión electrostática entre los átomos de hidrógeno en los carbonos adyacentes.
Figura 23.2.2 Conformaciones eclipsadas y escalonadas de etano (a) En una proyección de Newman, la molécula se ve a lo largo de un eje C-C. El carbono en frente se representa como un vértice, mientras que el carbono que está unido a él se representa como un círculo. En etano, los enlaces C—H a cada carbono están posicionados a 120° entre sí. En la conformación completamente eclipsada, los enlaces C-H en los átomos de carbono adyacentes son paralelos y se encuentran en el mismo plano. En la conformación escalonada, los átomos de hidrógeno se posicionan lo más lejos posible. (b) La conformación eclipsada es 12.6 kJ/mol mayor en energía que la conformación escalonada debido a la repulsión electrostática entre los átomos de hidrógeno. Un número infinito de conformaciones de energía intermedia existen entre los dos extremos.
En una proyección de Newman, los ángulos entre enlaces C—H adyacentes en el mismo carbono se dibujan a 120°, aunque los ángulos H—C—H en alcanos son en realidad ángulos tetraédricos de 109.5°, lo que para cadenas de más de tres átomos de carbono resulta en una estructura doblada. (Para más información sobre ángulos de enlace y modelado molecular, ver Sección 6.3) A pesar de esta inexactitud tridimensional, las proyecciones de Newman son útiles para predecir la estabilidad relativa de los isómeros conformacionales. Como se muestra en la parte (b) en la Figura 23.2.2, la mayor energía de la conformación eclipsada representa una barrera de energía de 12.6 kJ/mol que debe superarse para que ocurra la rotación alrededor del enlace C-C. Esta barrera es tan baja, sin embargo, que la rotación alrededor del enlace C-C en etano es muy rápida a temperatura ambiente y ocurre varios millones de veces por segundo para cada molécula.
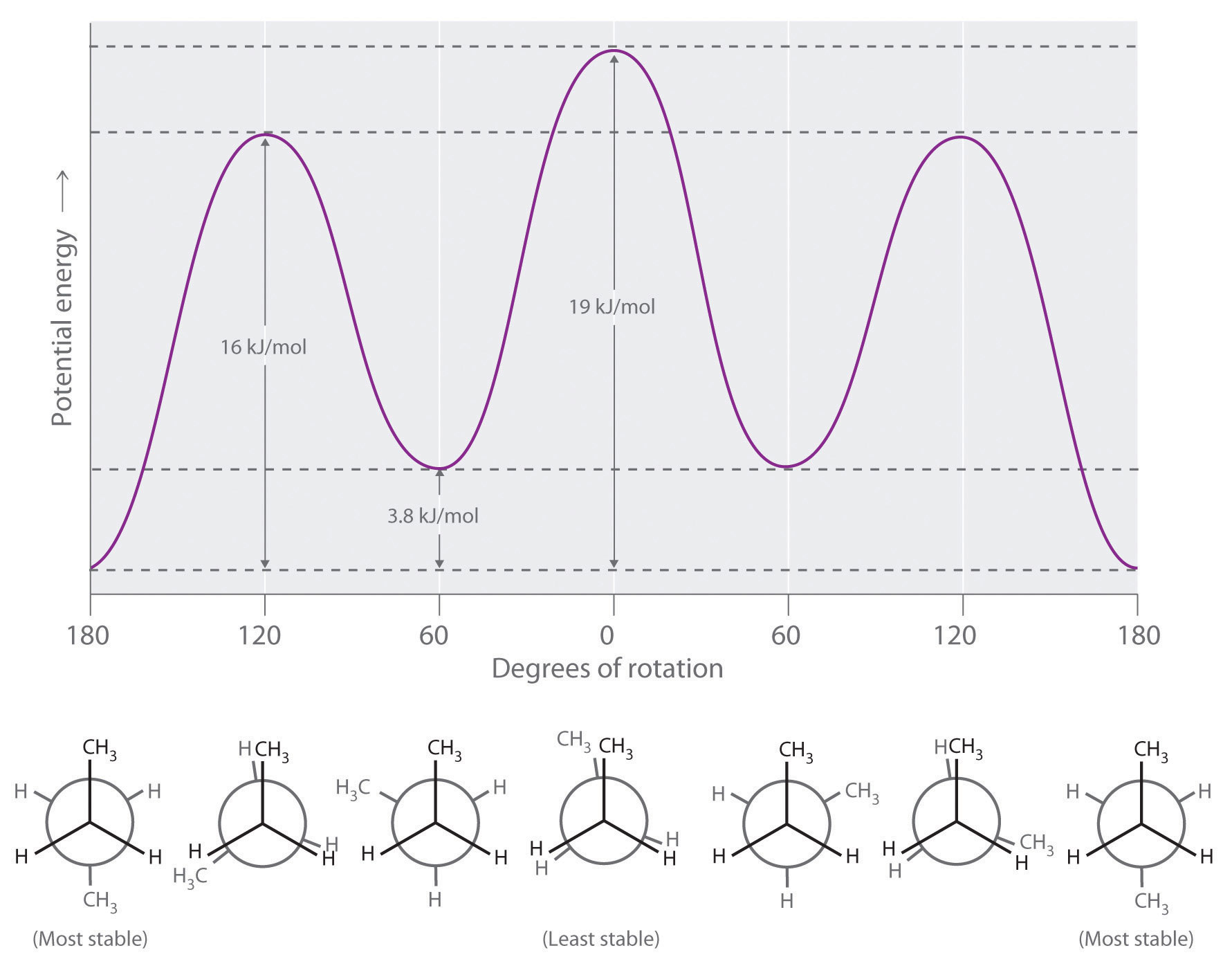
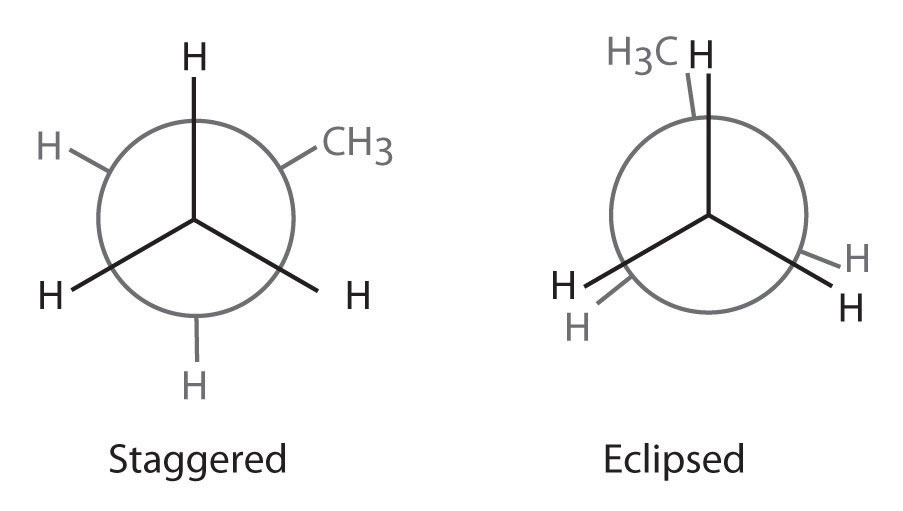
Los alcanos de cadena más larga también pueden ser representados por proyecciones de Newman. En alcanos y derivados de alcanos más complejos, la rotación puede ocurrir alrededor de cada enlace C-C en una molécula. Por lo tanto, las proyecciones de Newman son útiles para revelar barreras estéricas a la rotación en un enlace C-C particular debido a la presencia de sustituyentes voluminosos. La Figura 23.2.3 muestra una gráfica de la energía potencial frente al ángulo de rotación alrededor del enlace C-C central (entre los átomos de carbono 2 y 3) de n-butano (C 4 H 10). La estructura que minimiza la repulsión electrostática es aquella en la que los grupos metilo, correspondientes a los átomos de carbono 1 y 4, están lo más separados posible; es decir, la conformación escalonada. Observe que debido a que los sustituyentes en C2 y C3 en n-butano no son todos iguales, son posibles conformaciones eclipsadas y escalonadas energéticamente no equivalentes; la mayoría de las moléculas se interconvierten rápidamente entre estas conformaciones por una serie de rotaciones simples.
Figura 23.2.3 Gráfica de energía potencial y proyecciones de Newman de conformaciones eclipsadas y escalonadas de n-butano En estas proyecciones, la molécula se observa a lo largo del eje C2-C3. La estructura menos estable es la conformación eclipsada en la que los dos grupos metilo (C1 y C4) son adyacentes entre sí. La estructura más estable es la conformación escalonada en la que los grupos metilo están lo más separados posible. Debido a que los sustituyentes en cada átomo de carbono central no son todos iguales, una rotación de 120° alrededor del enlace C2-C3 genera conformaciones eclipsadas y escalonadas energéticamente no equivalentes.
Ejemplo 23.2.1
Dibuje proyecciones de Newman que muestren las conformaciones escalonadas y eclipsadas de 1,1,1-tricloroetano (CCl 3 CH 3).
Dado: molécula orgánica
Preguntado por: conformaciones escalonadas y eclipsadas
Estrategia:
A Identificar el bono C—C de interés. Después dibuja la proyección de Newman representando un carbono como vértice y el otro como círculo.
B Dibuje enlaces a cada carbono en ángulos de 120° entre sí, con una disposición que representa la conformación escalonada y la otra la conformación eclipsada.
C Completar las proyecciones de Newman uniendo los átomos o grupos sustituyentes apropiados a los átomos de C centrales en cada conformación.
Solución:
A Solo hay un enlace C-C: C1 está conectado a tres átomos de Cl y C2 a tres átomos de H. Dibujamos C1 como punto y C2 como círculo.
B Ahora dibujamos enlaces en cada carbono en ángulos de 120° entre sí para representar la conformación escalonada y la conformación eclipsada.
C Luego unimos los átomos de H y Cl a los átomos de carbono en cada conformación como se muestra.
Ejercicio
Dibuje proyecciones de Newman para ilustrar las conformaciones escalonadas y eclipsadas del propano (C 3 H 8) tal como se ve a lo largo del eje C1—C2.
Contestar
Isómeros estructurales
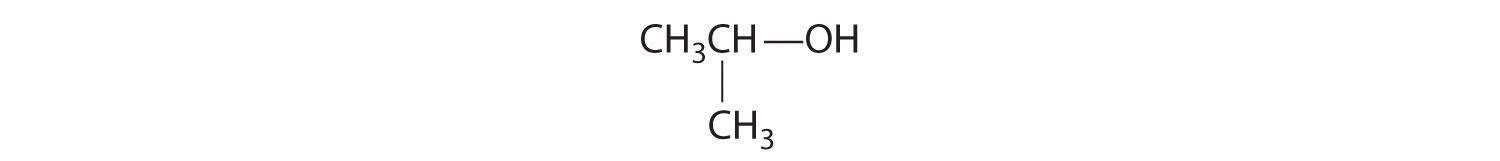
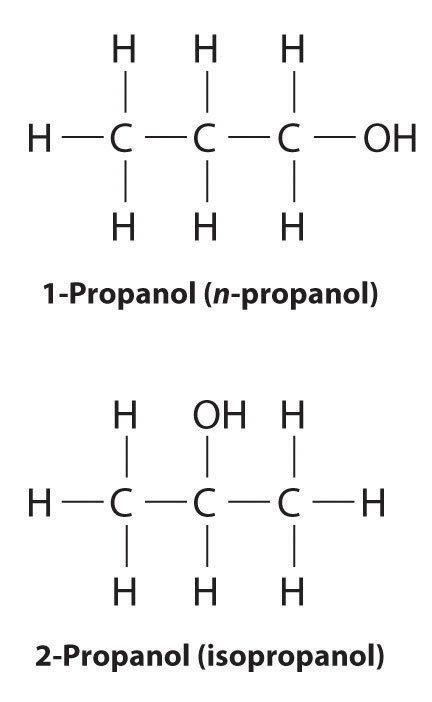
A diferencia de los isómeros conformacionales, que no difieren en conectividad, los isómeros estructurales Los isómeros que tienen la misma fórmula molecular pero difieren en qué átomos están unidos entre sí. difieren en conectividad, como se ilustra aquí para 1-propanol y 2-propanol. (Para mayor información sobre los isómeros estructurales, ver Sección 21.4.) Aunque estos dos alcoholes tienen la misma fórmula molecular (C 3 H 8 O), la posición del grupo —OH difiere, lo que conduce a diferencias en sus propiedades físicas y químicas.
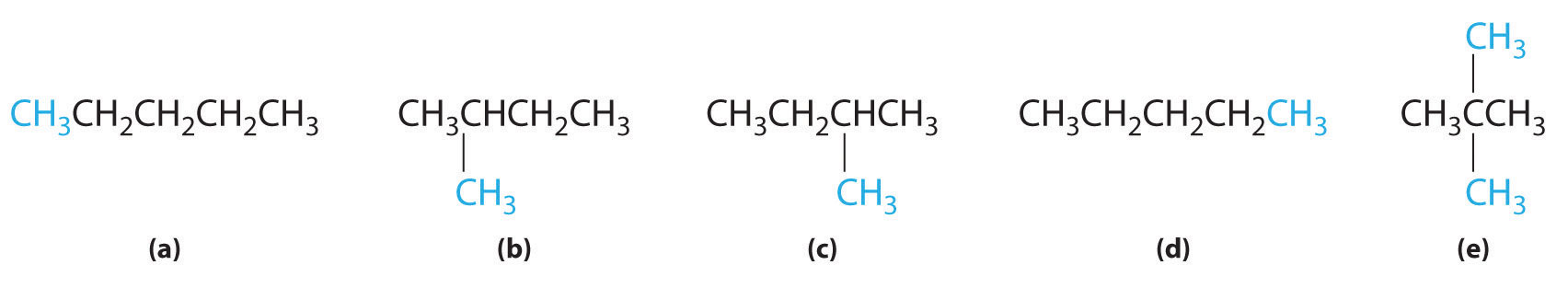
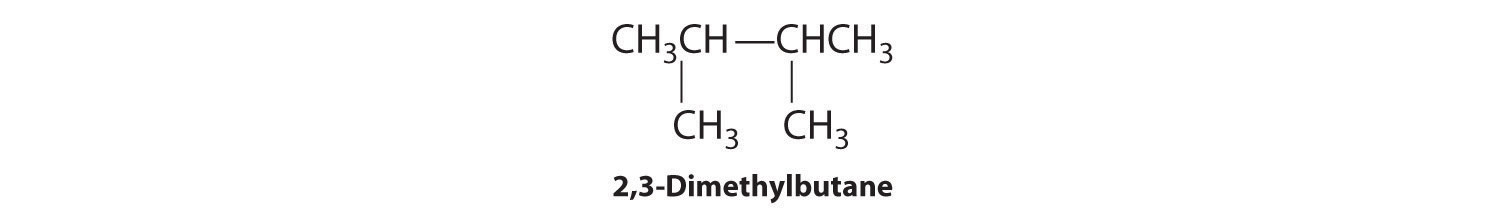
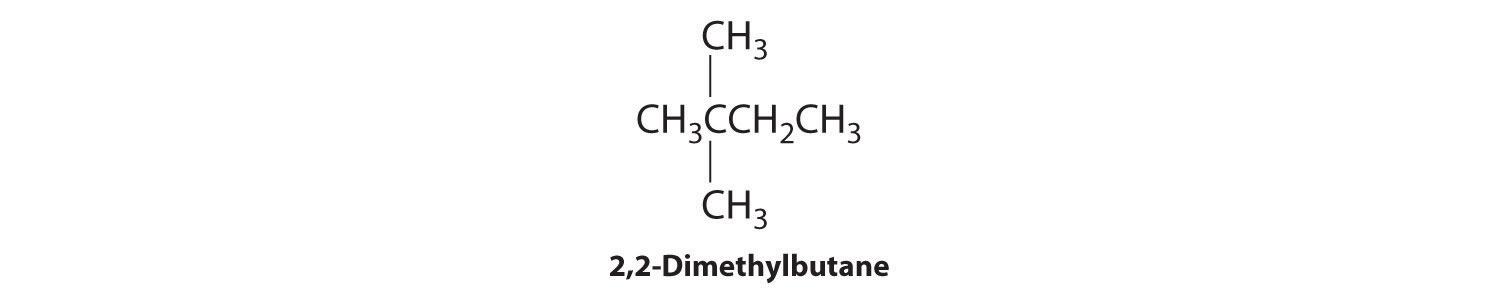
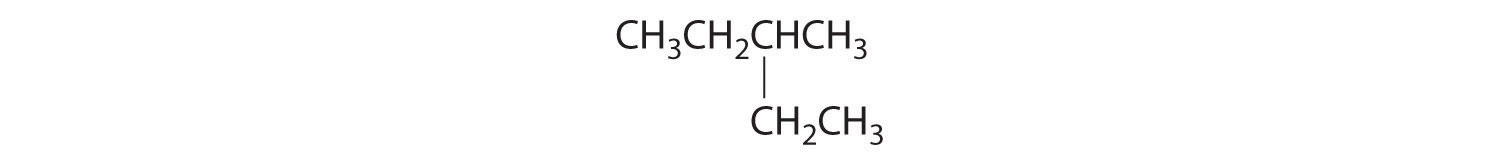
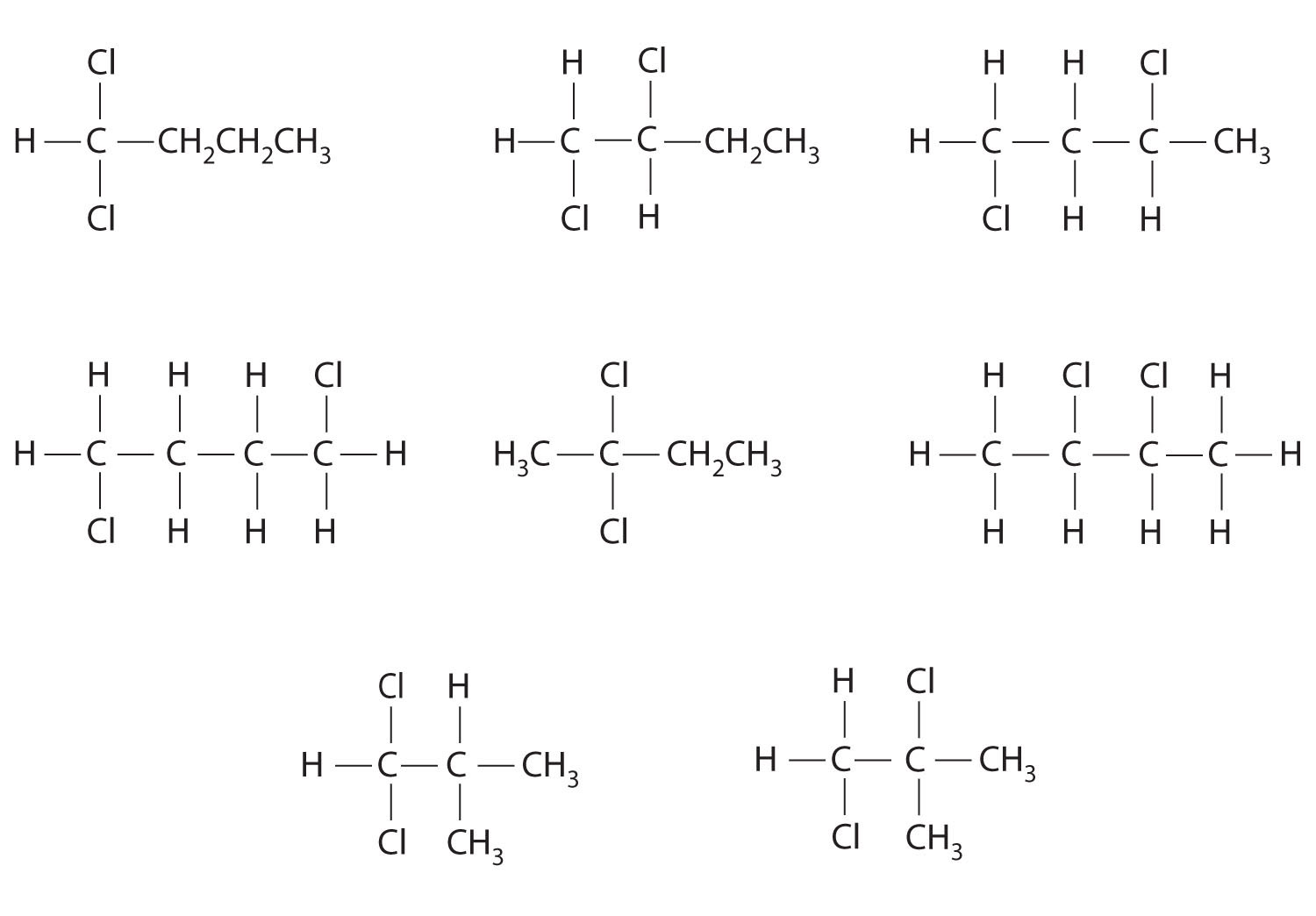
En la conversión de un isómero estructural a otro, al menos un enlace debe romperse y reformarse en una posición diferente en la molécula. Consideremos, por ejemplo, las siguientes cinco estructuras representadas por la fórmula C 5 H 12:
De estas estructuras, (a) y (d) representan el mismo compuesto, como lo hacen (b) y (c). No se han roto ni reformado ningún enlace; las moléculas simplemente se rotan alrededor de un eje vertical de 180°. Solo tres— n-pentano (a) y (d), 2-metilbutano (b) y (c) y 2,2-dimetilpropano (e) son isómeros estructurales. Debido a que no se rompen enlaces al ir de (a) a (d) o de (b) a (c), estas representaciones alternativas no son isómeros estructurales. Los tres isómeros estructurales, ya sea (a) o (d), ya sea (b) o (c) y (e), tienen distintas propiedades físicas y químicas.
Tenga en cuenta el patrón
Los isómeros estructurales difieren en su conectividad.
Ejemplo 23.2.2
Dibujar todos los isómeros estructurales de C 6 H 14.
Dado: molécula orgánica
Preguntado por: todos los isómeros estructurales
Estrategia:
A Dibuja el isómero estructural más simple, que a menudo es el alcano de cadena lineal.
B Obtener isómeros ramificados sustituyendo un hidrógeno a lo largo de la cadena con un grupo apropiado de la cadena.
C Si es posible, sustituya más de un hidrógeno por grupos apropiados para obtener isómeros que estén más altamente ramificados.
Solución:
A El isómero estructural más simple es el alcano de cadena lineal n-hexano (CH 3 CH 2 CH 2 CH 2 CH 2 CH 2 CH 3).
B Eliminar un grupo metilo de un extremo y volver a unirlo a carbonos adyacentes mientras se sustituye el hidrógeno en su lugar, se obtienen otras dos estructuras:
C Para obtener otro isómero estructural más, mueva dos grupos metilo para crear una molécula con dos ramas:
Creamos un isómero estructural más uniendo dos grupos metilo al mismo átomo de carbono:
Así, existen cuatro isómeros estructurales de C 6 H 14.
Ejercicio
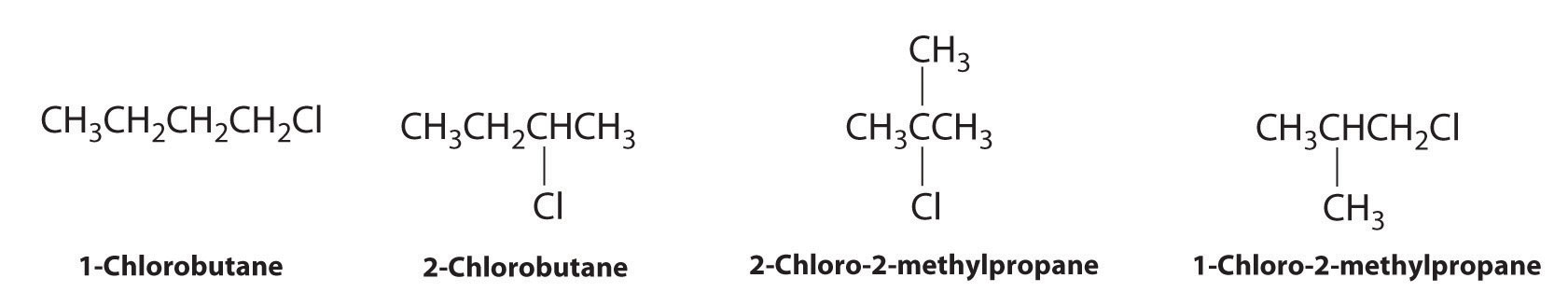
Dibujar todos los isómeros estructurales de C 4 H 9 Cl.
Contestar
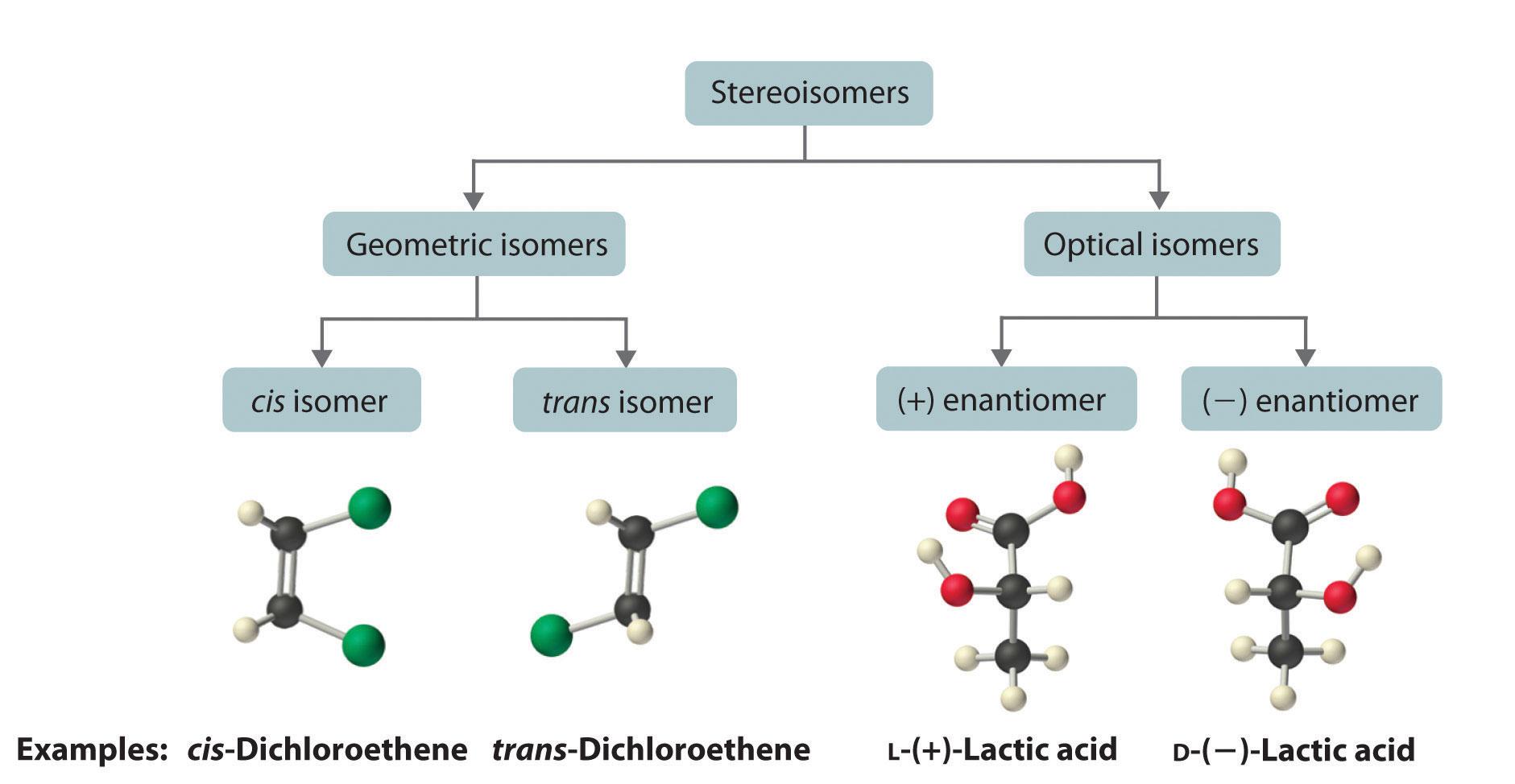
Estereoisómeros
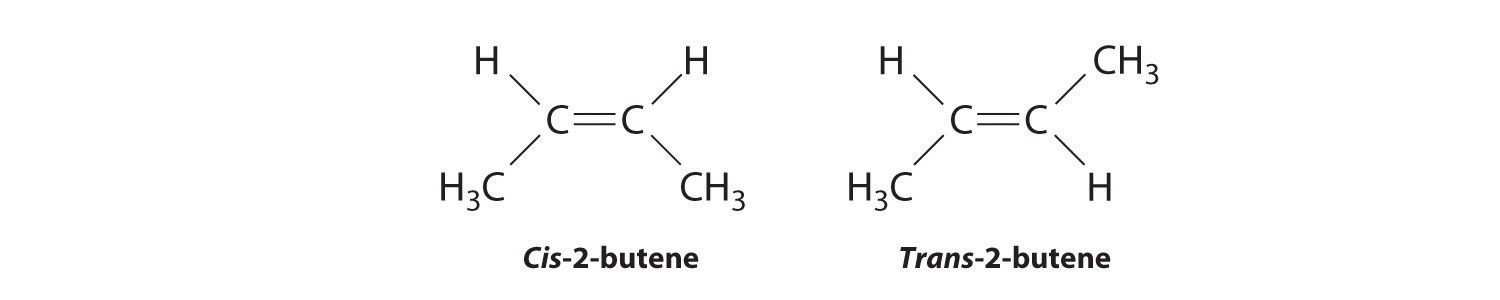
Las moléculas con la misma conectividad pero diferentes disposiciones de los átomos en el espacio se denominan estereoisómeros Moléculas que tienen la misma conectividad pero cuyos átomos componentes tienen diferentes orientaciones en el espacio. . Existen dos tipos de estereoisómeros: geométricos y ópticos. Los isómeros geométricos difieren en la posición o posiciones relativas de los sustituyentes en una molécula rígida. (Para mayor información sobre estereoisómeros, ver Sección 21.4) La rotación simple sobre un enlace C—C σ en un alqueno, por ejemplo, no puede ocurrir debido a la presencia del enlace π. Por lo tanto, los sustituyentes están rígidamente bloqueados en una disposición espacial particular (parte (a) en la Figura 6.4.4). Así, un enlace múltiple carbono-carbono, o en algunos casos un anillo, evita que un isómero geométrico se convierta fácilmente en el otro. Los miembros de un par isomérico se identifican como cis o trans, y la interconversión entre las dos formas requiere romper y reformar uno o más enlaces. Debido a que su diferencia estructural hace que tengan diferentes propiedades físicas y químicas, los isómeros cis y trans son en realidad dos compuestos químicos distintos.
Tenga en cuenta el patrón
Los estereoisómeros tienen la misma conectividad pero diferentes disposiciones de átomos en el espacio.
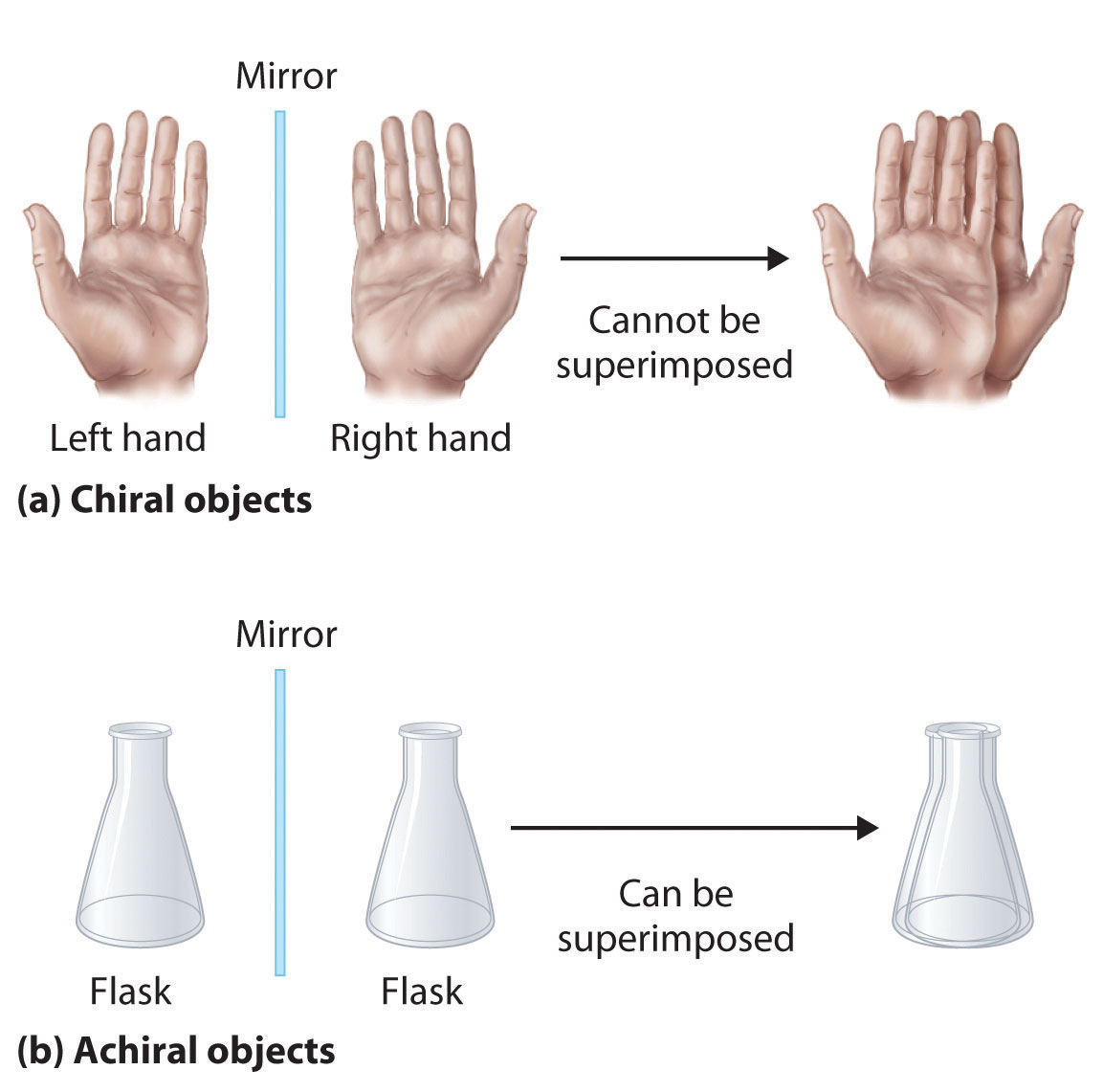
Los isómeros ópticos son moléculas cuyas estructuras son imágenes especulares pero que no pueden superponerse entre sí en ninguna orientación. Los isómeros ópticos tienen propiedades físicas idénticas, aunque sus propiedades químicas pueden diferir en ambientes asimétricos. Se dice que las moléculas que son imágenes especulares no superponibles entre sí son quirales (pronunciado “ky-ral”, del griego cheir, que significa “mano”). Ejemplos de algunos objetos quirales familiares son tus manos, pies y orejas. Como se muestra en la parte (a) de la Figura 23.2.4, sus manos izquierda y derecha son imágenes especulares no superponibles. (Intenta poner tu zapato derecho en tu pie izquierdo, simplemente no funciona). Un objeto aquiral es aquel que puede superponerse a su imagen especular, como lo muestran los matraces superpuestos en la parte (b) de la Figura 23.2.4
Figura 23.2.4 Objetos quirales y aquirales (a) Los objetos que son imágenes especulares no superponibles entre sí son quirales, como la mano izquierda y la derecha. b) El matraz sin marcar es aquiral porque puede superponerse a su imagen especular.
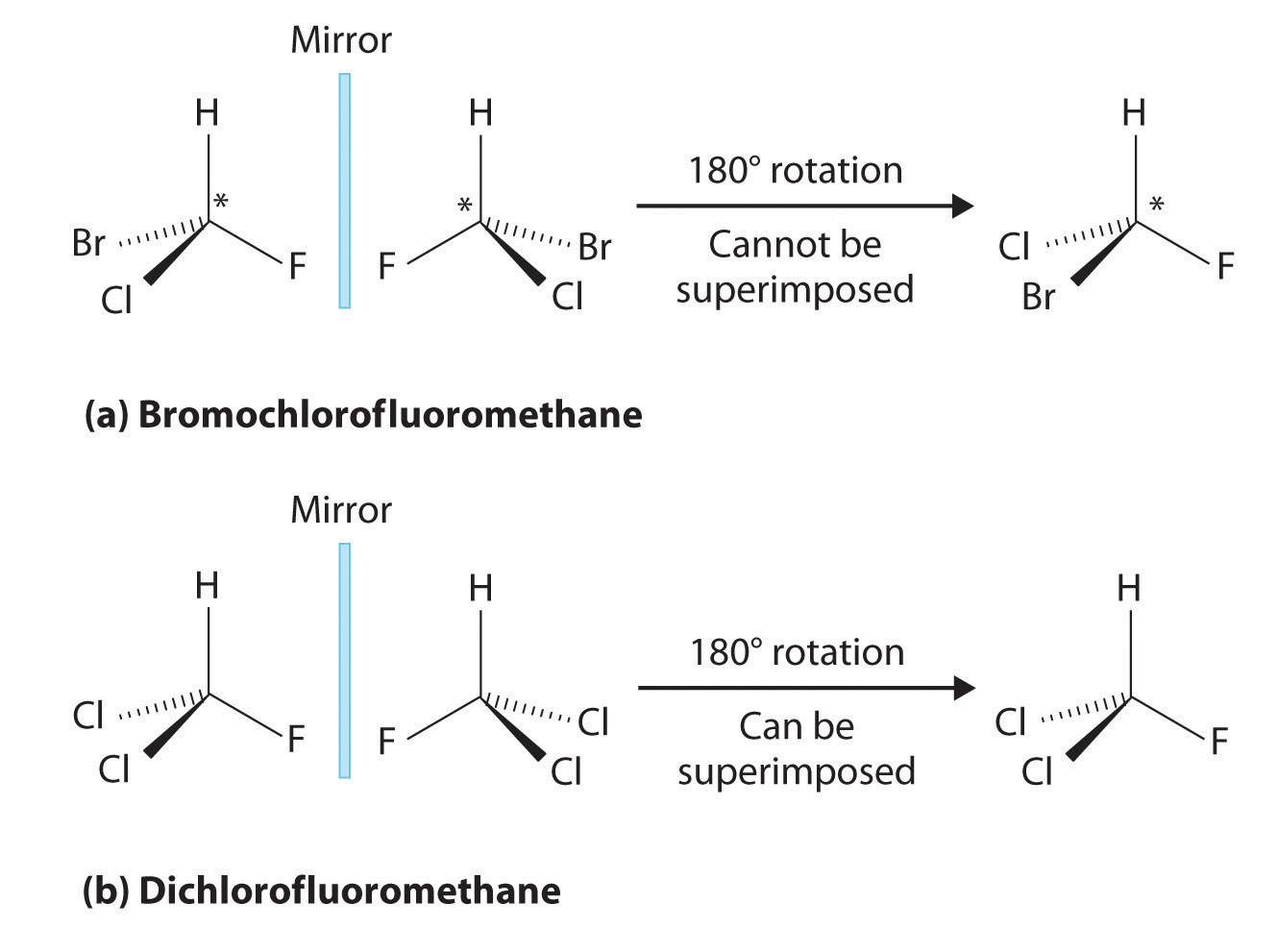
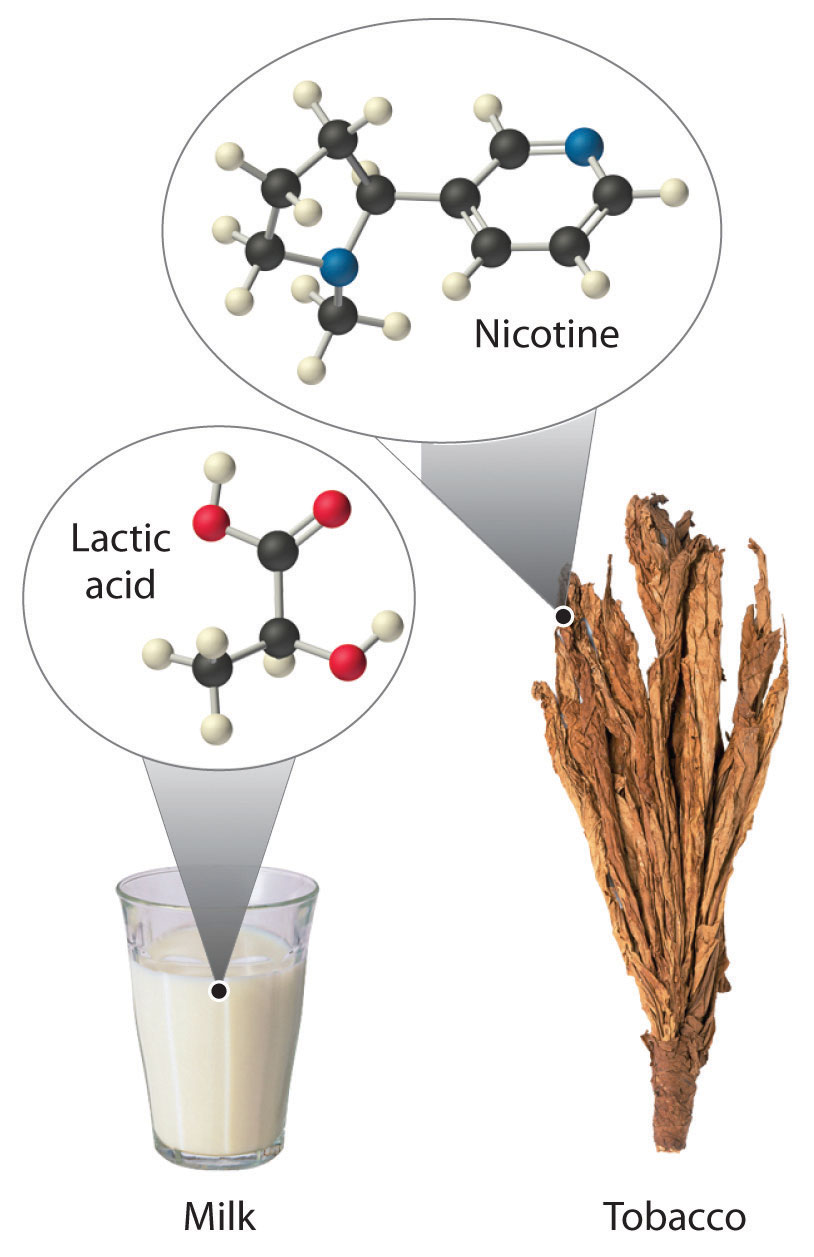
La mayoría de las moléculas orgánicas quirales tienen al menos un átomo de carbono que está unido a cuatro grupos diferentes, como ocurre en la molécula de bromoclorofluorometano mostrada en la parte (a) en la Figura 23.2.5 Este carbono, a menudo designado por un asterisco en los dibujos estructurales, se denomina centro quiral o átomo de carbono asimétrico. Si el átomo de bromo es reemplazado por otro cloro (parte (b) en la Figura 23.2.5), la molécula y su imagen especular ahora pueden superponerse por simple rotación. Así el carbono ya no es un centro quiral. Los átomos de carbono asimétricos se encuentran en muchas moléculas naturales, como el ácido láctico, que está presente en la leche y los músculos, y la nicotina, un componente del tabaco. Una molécula y su imagen especular no superponible se llaman enantiómeros (del griego enantiou, que significa “opuesto”).
Figura 23.2.5 Comparación de moléculas quirales y aquirales (a) El bromoclorofluorometano es una molécula quiral cuyo estereocentro se designa con un asterisco. La rotación de su imagen especular no genera la estructura original. Para superponer las imágenes especulares, los vínculos deben romperse y reformarse. (b) Por el contrario, el diclorofluorometano y su imagen especular se pueden rotar para que sean superponibles.
Ejemplo 23.2.3
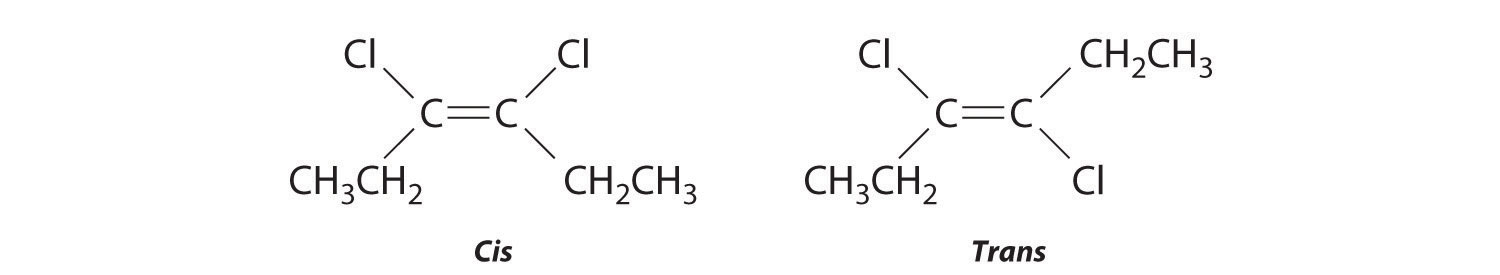
Dibuja los isómeros cis y trans de cada compuesto.
- 1,3-dimetilciclopentano
- 3,4-dicloro-3-hexeno
Dado: compuestos orgánicos
Preguntado por: isómeros cis y trans
Estrategia:
Dibujar el compuesto no substituido correspondiente al nombre sistemático dado. Luego colocar los sustituyentes en el mismo lado para obtener el isómero cis y en lados opuestos para obtener el isómero trans.
Solución:
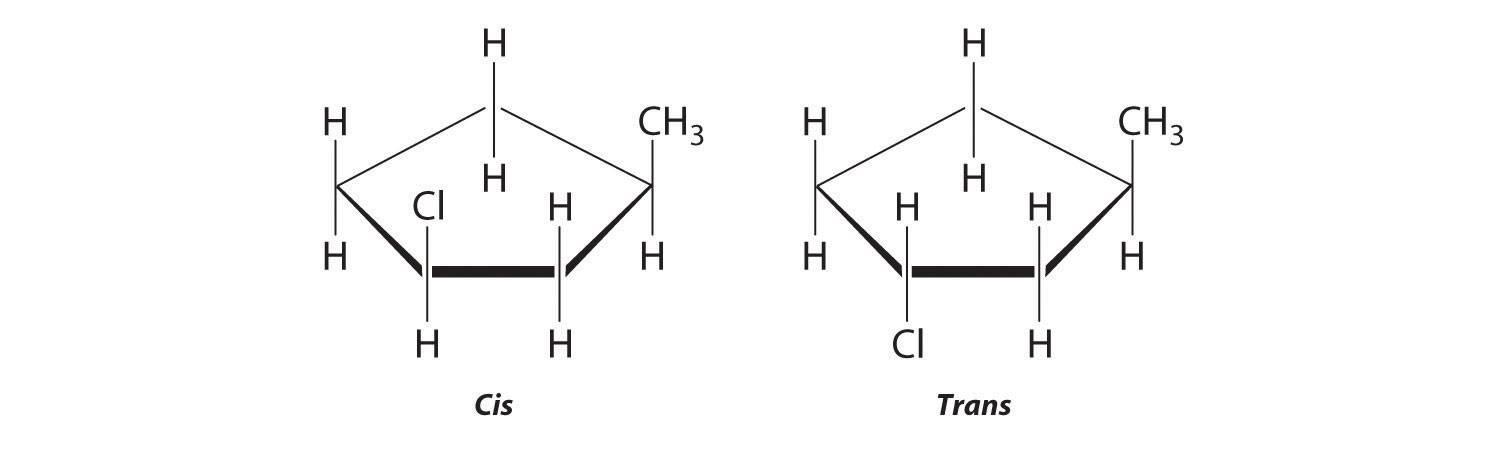
- El nombre nos dice que este compuesto contiene un anillo de cinco carbonos con dos grupos metilo unidos. La notación 1,3 significa que los grupos metilo no son adyacentes en el anillo de cinco miembros:
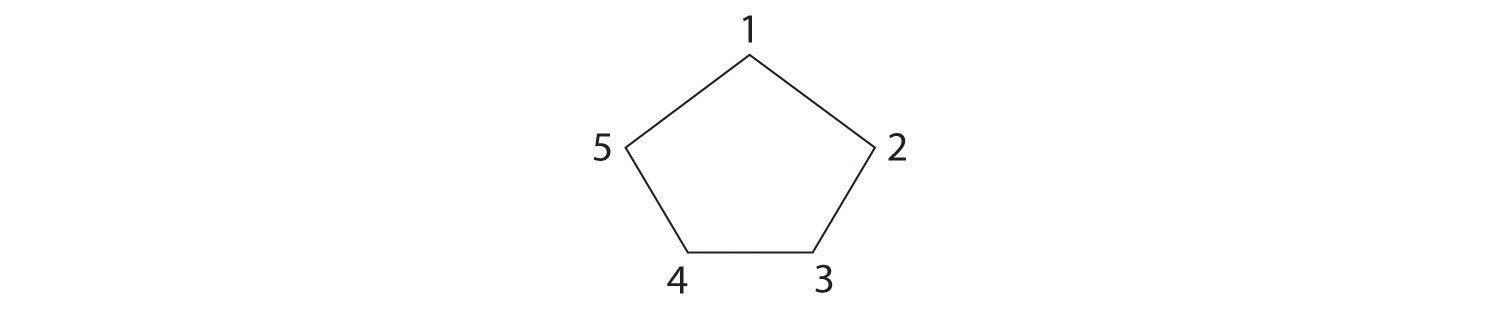
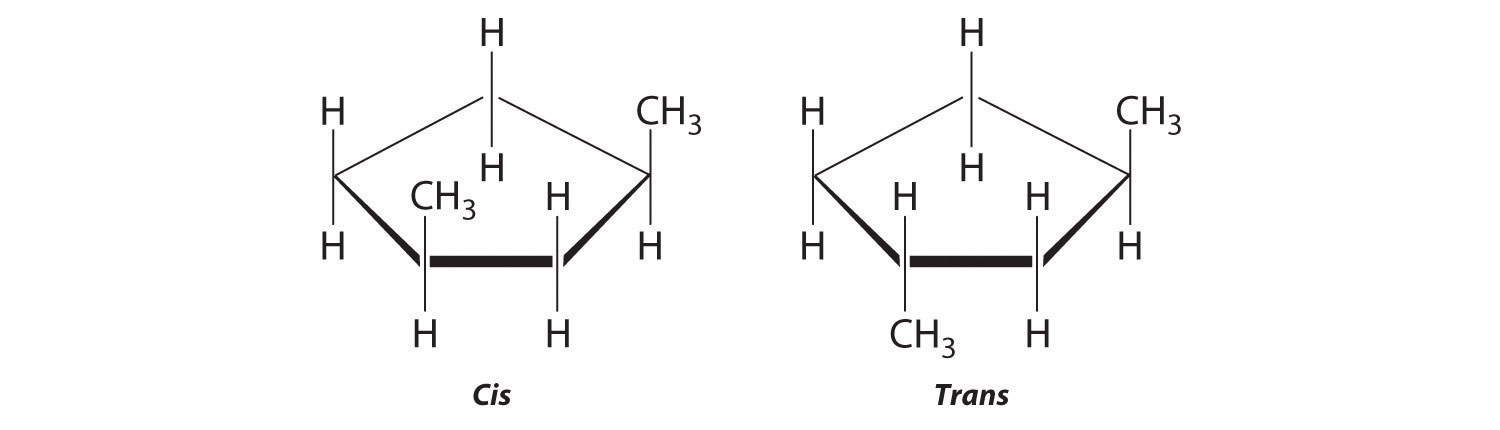
Colocar los sustituyentes metilo en el mismo lado del anillo da el isómero cis, mientras que al colocarlos en lados opuestos del anillo se obtiene el isómero trans:
- El compuesto 3-hexeno puede existir como isómero cis o trans:
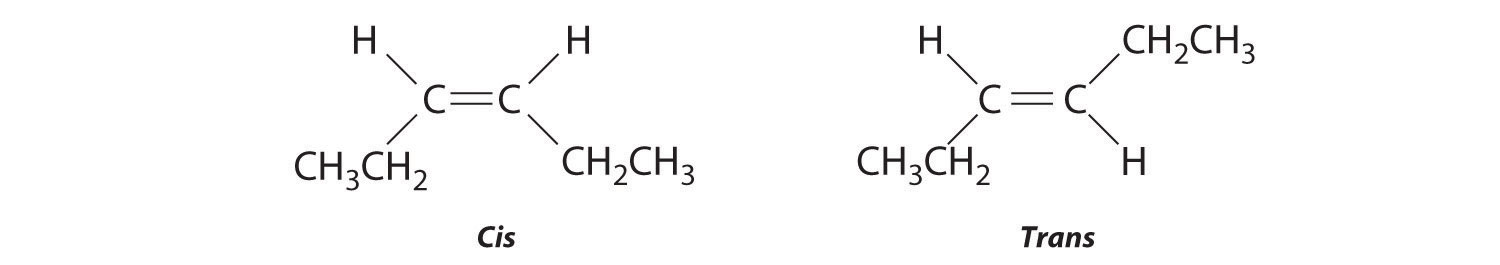
Reemplazar los átomos de hidrógeno en el tercer y cuarto carbonos por cloro no cambia las estructuras generales de los isómeros:
Ejercicio
Dibuja los isómeros cis y trans de cada compuesto.
- 2-buteno
- 1-metil-3-clorociclopentano
Contestar
Ejemplo 22.3.4
¿Cuál de estos compuestos existe como al menos un par de enantiómeros?
Dado: compuestos orgánicos
Preguntado por: existencia de enantiómeros
Estrategia:
Determinar si el compuesto es quiral. En la mayoría de los casos, esto significa que al menos un carbono está unido a cuatro grupos diferentes. Si el compuesto es quiral, existe como enantiómeros.
Solución:
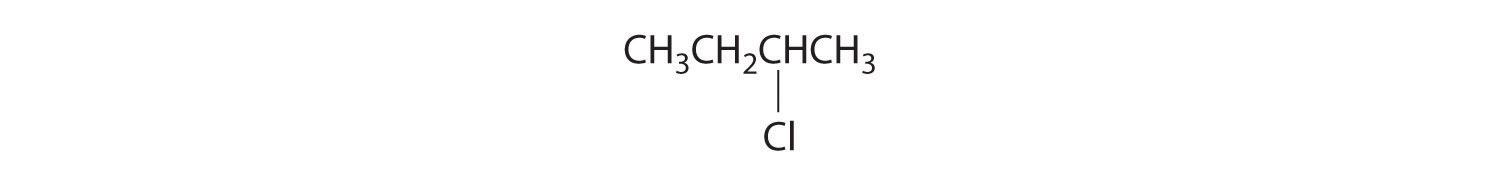
- Los carbonos en —CH 3 y —CH 2 — están unidos cada uno a más de un hidrógeno, por lo que son aquirales. El carbono central está unido a dos grupos etilo idénticos, por lo que también es aquiral. Debido a que no hay centros quirales en este compuesto, no tiene enantiómeros.
- Todos los carbonos están unidos a al menos dos átomos de H excepto el unido a Br, que está unido a cuatro grupos diferentes: —Br, —CH 3, —H y —CH 2 CH 3. Por lo tanto, el compuesto tiene un centro quiral y, como resultado, existe como enantiómeros: la estructura mostrada y su imagen especular no superponible.
- Los carbonos en cada —CH 3 están unidos a más de un hidrógeno, por lo que son aquirales. Un carbono está unido a dos grupos —CH 3, lo que lo convierte también en aquiral. Este compuesto no tiene enantiómeros.
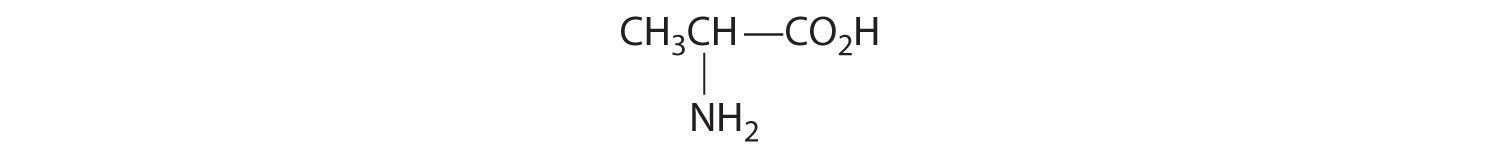
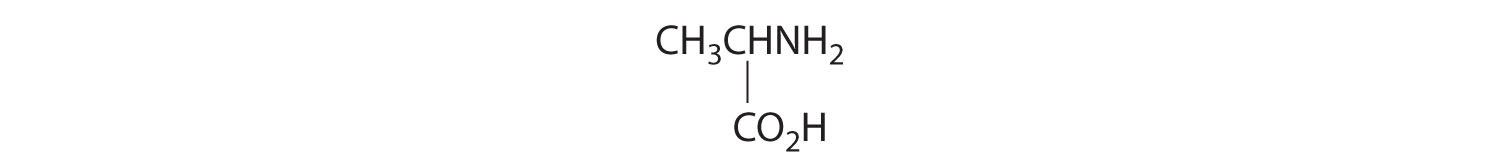
- Un carbono está unido a tres hidrógenos y uno a dos oxígenos, por lo que son aquirales. El carbono central está unido a cuatro grupos diferentes: —CH 3, —H, —NH 2 y —CO 2H, por lo que es quiral, y el compuesto tiene dos enantiómeros.
Ejercicio
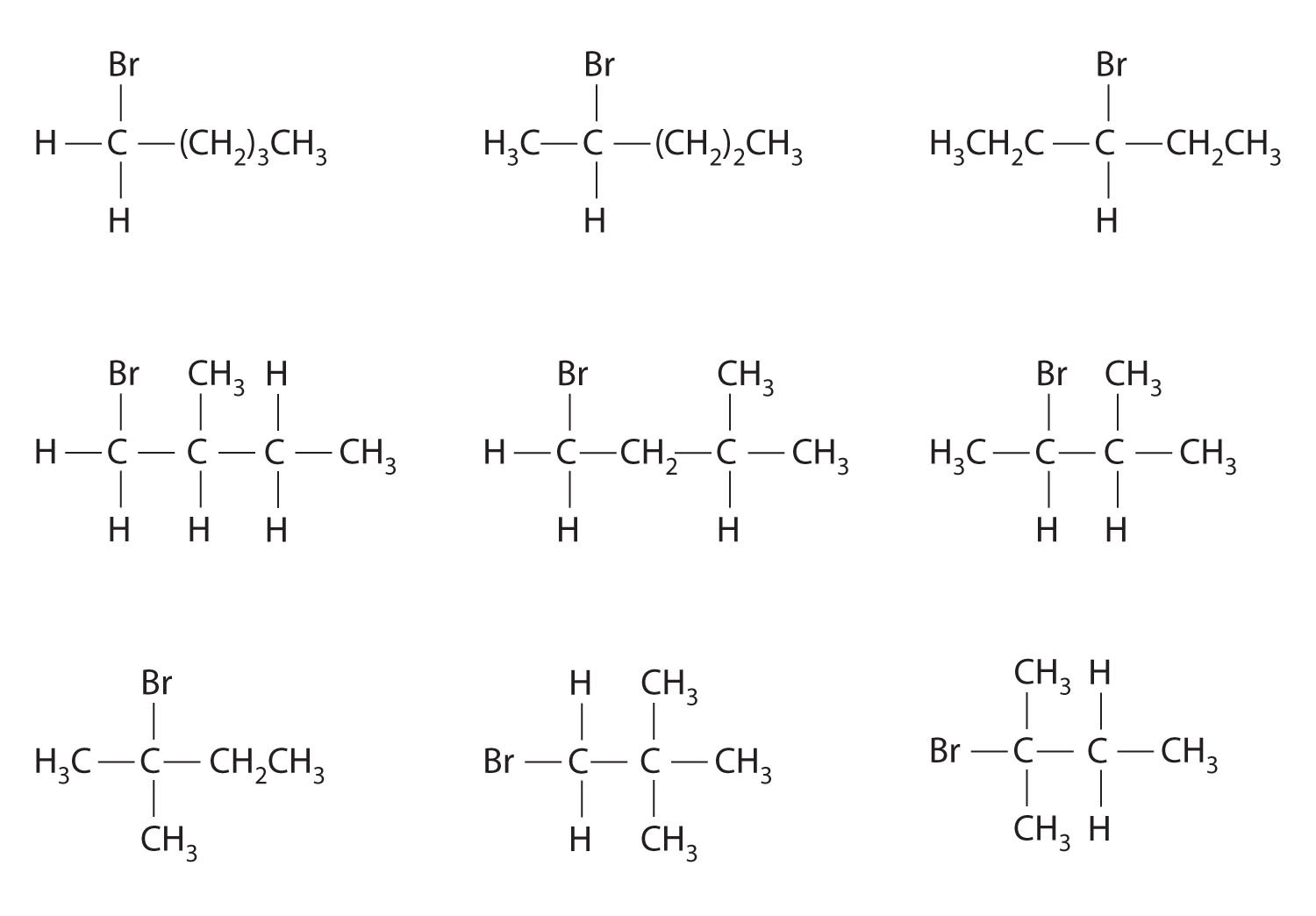
¿Cuáles de estos compuestos tienen al menos un par de enantiómeros?
Contestar
c)
Actividad óptica de los enantiómeros
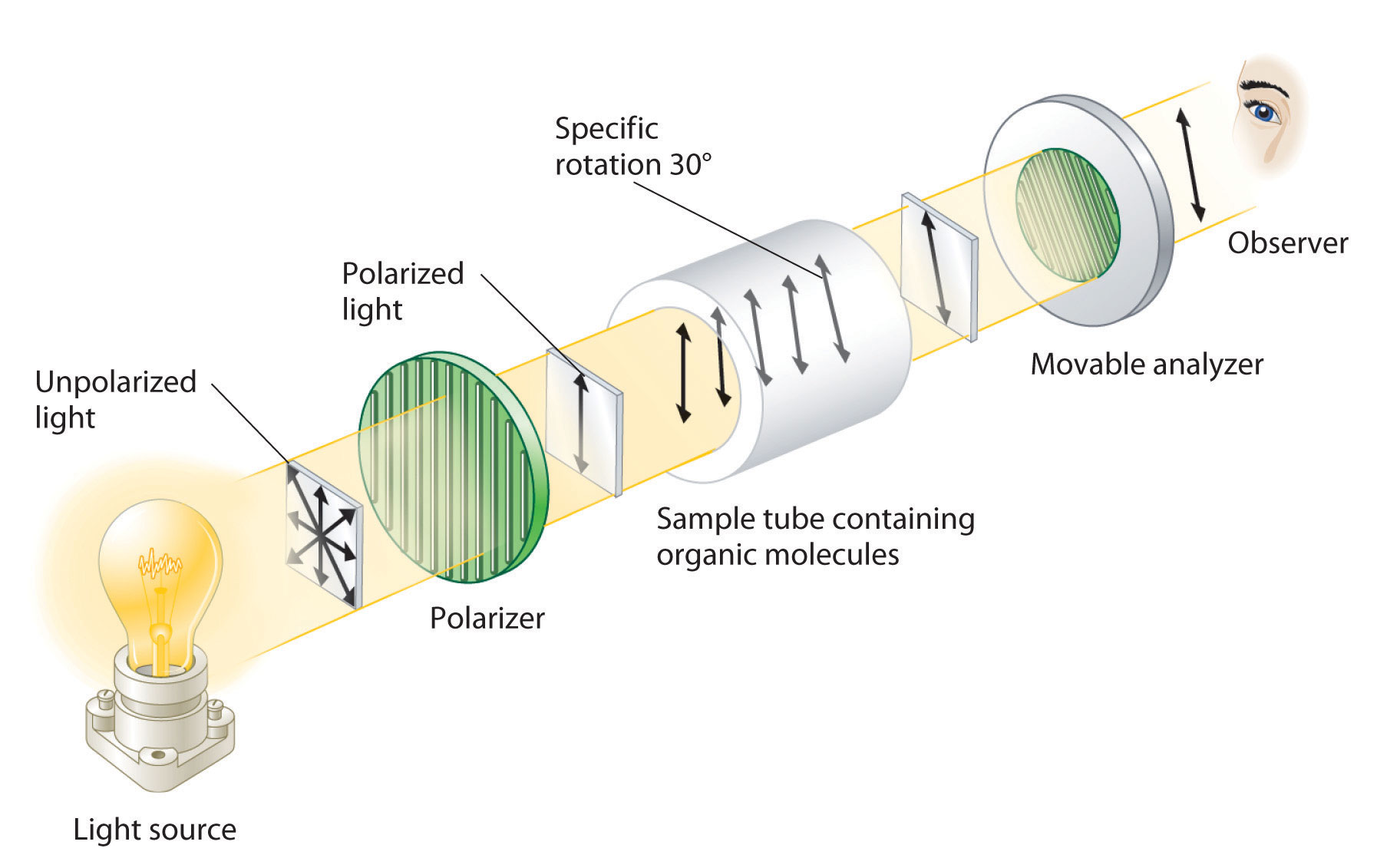
Aunque los enantiómeros tienen densidades, puntos de fusión y ebullición idénticos, colores y solubilidad en la mayoría de los disolventes, difieren en su interacción con la luz polarizada plana, que consiste en ondas electromagnéticas que oscilan en un solo plano. En contraste, la luz normal (no polarizada) consiste en ondas electromagnéticas que oscilan en todas las direcciones perpendiculares al eje de propagación. Cuando la luz normal pasa a través de una sustancia llamada polarizador, solo se transmite la luz que oscila en una dirección. Un polarizador filtra selectivamente la luz que oscila en cualquier plano que no sea el deseado (Figura 23.2.6).
Figura 23.2.6 Detección de la Actividad Óptica de Sustancias Quirales Cuando la luz polarizada pasa a través de una solución que contiene un compuesto aquiral, no hay rotación neta del plano de polarización de la luz. Por el contrario, cuando la luz polarizada pasa a través de una solución que contiene un enantiómero de un compuesto quiral, como se muestra aquí, la luz se gira ya sea en sentido horario [dextrorrotatorio, (+) enantiómero] o en sentido contrario a las agujas del reloj [levorrotatorio, (-) enantiómero] en un ángulo que depende del estructura molecular y concentración del compuesto, la longitud de la trayectoria y la longitud de onda de la luz.
Cuando la luz polarizada en el plano pasa a través de una solución, la radiación electromagnética interactúa con las moléculas de soluto y disolvente. Si la solución contiene un compuesto aquiral, la luz polarizada en el plano entra y deja la solución sin cambios porque las moléculas aquirales hacen que gire en direcciones aleatorias. Por lo tanto, se dice que el soluto es ópticamente inactivo. Sin embargo, si la solución contiene un solo enantiómero de un compuesto quiral, la luz polarizada en el plano se gira en una sola dirección, y se dice que el soluto es ópticamente activo. Una rotación en sentido horario se llama dextrorrotatorio (del latín dextro, que significa “a la derecha”) y se indica en el nombre del compuesto por (+), mientras que una rotación en sentido contrario a las agujas del reloj se llama levorrotatorio (del latín levo, que significa “a la izquierda”) y es designado (−). Como pronto descubrirás, esta designación es importante para entender cómo las moléculas quirales interactúan entre sí.
Tenga en cuenta el patrón
Las moléculas quirales son ópticamente activas; las moléculas aquirales no lo son.
La magnitud de la rotación de la luz polarizada en el plano es directamente proporcional al número de moléculas quirales en una solución; también depende de su estructura molecular, la temperatura y la longitud de onda de la luz. Debido a estas variables, cada compuesto quiral tiene una rotación específica La cantidad (en grados) por la que se gira el plano de luz polarizada cuando la luz pasa a través de una solución que contiene 1.0 g de un soluto por 1.0 mL de disolvente en un tubo de 10.0 cm de largo. , que se define como la cantidad (en grados) por la cual el plano de luz polarizada se hace rotar cuando la luz pasa a través de una solución que contiene 1.0 g de soluto por 1.0 mL de solvente en un tubo de 10.0 cm de largo. Una solución quiral que contiene concentraciones iguales de un par de enantiómeros se denomina mezcla racémica. En tal solución, las rotaciones ópticas se cancelan exactamente entre sí, por lo que no hay rotación neta, y la solución es ópticamente inactiva. Las categorías de estereoisómeros se resumen en la Figura 23.2.7.
Figura 23.2.7 Clasificación de estereoisómeros En ambos tipos de estereoisómeros, geométricos y ópticos, las moléculas isómeras tienen conectividad idéntica, pero la disposición de los átomos en el espacio difiere. Los isómeros cis y trans presentan diferentes propiedades físicas y químicas, mientras que los enantiómeros difieren solo en su interacción con la luz polarizada plana y las reacciones en ambientes asimétricos. Dependiendo de la dirección en la que roten la luz polarizada, los enantiómeros se identifican como (+) o (−). Las designaciones L- y D- representan un sistema de etiquetado alternativo.
Interacciones de Enantiómeros con Otras Moléculas Quirales
En los organismos vivos, prácticamente cada molécula que contiene un centro quiral se encuentra como un solo enantiómero, no como una mezcla racémica. A nivel molecular, nuestros cuerpos son quirales e interactúan de manera diferente con los enantiómeros individuales de un compuesto en particular. Por ejemplo, los dos enantiómeros de la carvona producen respuestas muy diferentes en humanos: (−) -la carvona es la sustancia responsable del olor del aceite de lanza, y (+) -carvona, el principal componente de sabor de las semillas de alcaravea, es responsable del aroma característico del pan de centeno.
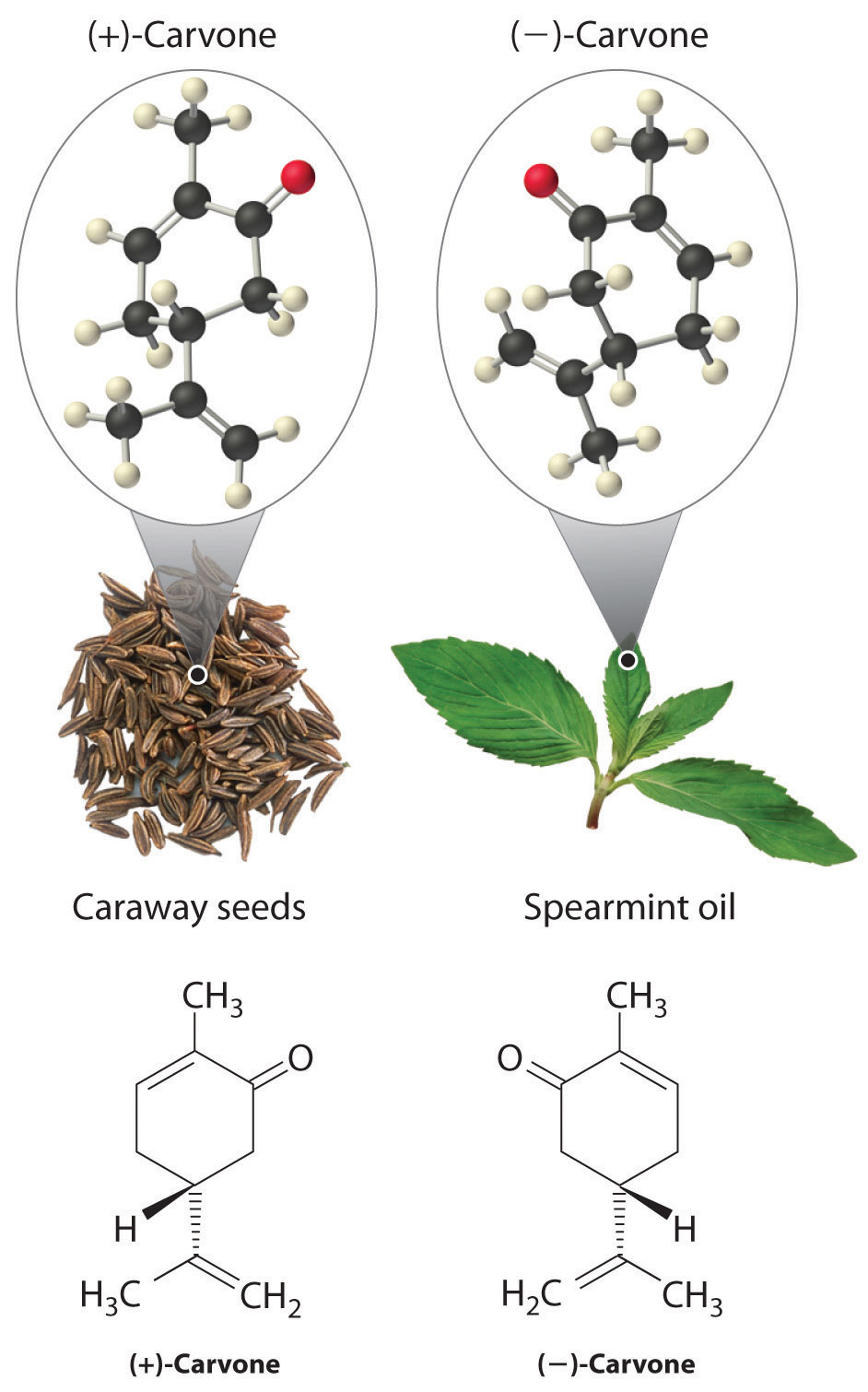
Un ejemplo farmacéutico de un compuesto quiral es el ibuprofeno, un agente analgésico y antiinflamatorio común que es el ingrediente activo en analgésicos como Motrin y Advil (Figura 23.5.2). El medicamento se vende como una mezcla racémica que tarda aproximadamente 38 minutos en lograr su efecto completo en el alivio del dolor y la hinchazón en un humano adulto. Debido a que solo el enantiómero (+) es activo en humanos, sin embargo, la misma masa de medicamento aliviaría los síntomas en solo aproximadamente 12 minutos si consistiera solo en el enantiómero (+). Desafortunadamente, aislar solo el enantiómero (+) aumentaría sustancialmente el costo del medicamento. La conversión del enantiómero (−) a (+) en el cuerpo humano explica el retraso en la sensación de todos los efectos de la droga. Una mezcla racémica de otra droga, la talidomida sedante, fue vendida en Europa desde 1956 hasta principios de la década de 1960. Se prescribió para tratar las náuseas durante el embarazo, pero desafortunadamente solo el enantiómero (+) fue seguro para ese propósito. Se descubrió que el enantiómero (−) era un teratógeno relativamente potente, una sustancia que causa defectos congénitos, lo que provocó que los hijos de muchas mujeres que habían tomado talidomida nacieran con extremidades faltantes o no desarrolladas. Como resultado, la talidomida fue rápidamente prohibida para este uso. Actualmente se utiliza para tratar la lepra, sin embargo, y también se ha mostrado prometedor como tratamiento para el SIDA (síndrome de inmunodeficiencia adquirida).
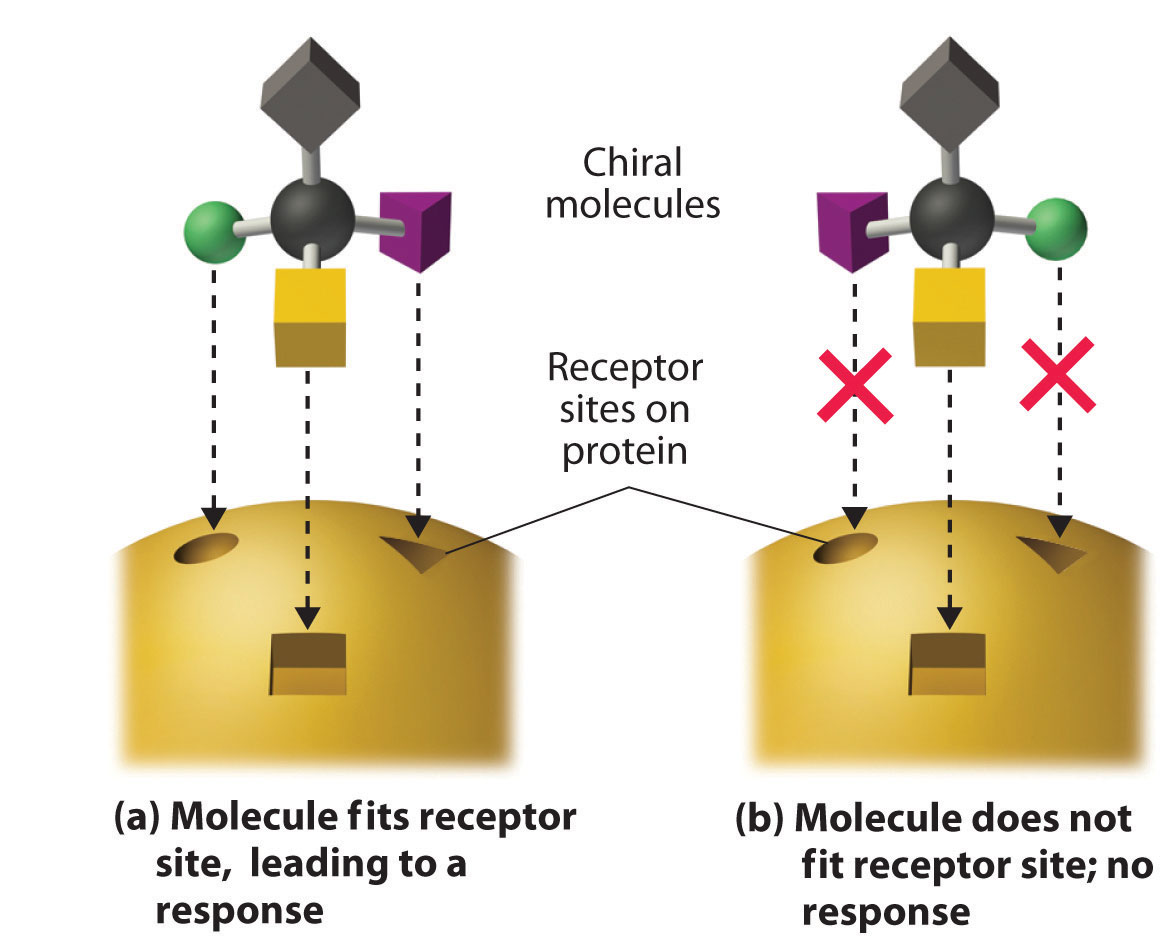
Estos ejemplos ilustran dramáticamente el punto de que las actividades biológicas de los enantiómeros pueden ser muy diferentes. Pero, ¿cómo pueden dos moléculas que difieren solo por ser imágenes especulares no superponibles causar respuestas tan diferentes? Los efectos biológicos de muchas sustancias, incluidas moléculas como la carvona que tienen aroma y medicamentos como el ibuprofeno y la talidomida, dependen de su interacción con sitios quirales en proteínas receptoras específicas. Como se ilustra esquemáticamente en la Figura 23.2.8, solo un enantiómero de una sustancia quiral interactúa con un receptor particular, iniciando así una respuesta. El otro enantiómero puede no unirse en absoluto, o puede unirse a otro receptor, produciendo una respuesta diferente.
Figura 23.2.8 La interacción de moléculas quirales con receptores biológicos Solo un enantiómero de una molécula quiral encaja en un sitio receptor quiral, que típicamente es una porción pequeña de una proteína grande. La unión de una molécula a su receptor provoca una respuesta característica. El otro enantiómero no puede encajar en el mismo sitio y, por lo tanto, no provoca respuesta. Sin embargo, puede producir una respuesta diferente al unirse a otro sitio.
Resumen
Los isómeros son diferentes compuestos que tienen la misma fórmula molecular. Para un compuesto orgánico, la rotación alrededor de un enlace σ puede producir diferentes estructuras tridimensionales llamadas isómeros conformacionales (o confórmeros). En una proyección de Newman, que representa la vista a lo largo de un eje C-C, la conformación eclipsada tiene los enlaces C—H en átomos de carbono adyacentes paralelos entre sí y en el mismo plano, representando un extremo conformacional. En la conformación escalonada, el extremo opuesto, los átomos de hidrógeno están lo más lejos posible entre sí. Las repulsiones electrostáticas se minimizan en la conformación escalonada. Los isómeros estructurales difieren en la conectividad de los átomos. Las estructuras que tienen la misma conectividad pero cuyos componentes difieren en sus orientaciones en el espacio se denominan estereoisómeros. Los estereoisómeros pueden ser isómeros geométricos, que difieren en la colocación de sustituyentes en una molécula rígida, o isómeros ópticos, imágenes especulares no superponibles. Las moléculas que son imágenes especulares no superponibles son moléculas quirales. Una molécula y su imagen especular no superponible se denominan enantiómeros. Estos difieren en su interacción con la luz polarizada en el plano, luz que oscila en una sola dirección. Un compuesto es ópticamente activo si su solución gira la luz polarizada plana en una sola dirección y ópticamente inactivo si sus rotaciones se cancelan para no producir rotación neta. Una rotación en el sentido de las agujas del reloj se llama dextrorrotatorio y se indica en el nombre del compuesto por (+), mientras que una rotación en sentido contrario a las agujas del reloj se llama levorrotatoria, designada por (−). La rotación específica es la cantidad (en grados) por la cual el plano de luz polarizada se gira cuando la luz pasa a través de una solución que contiene 1.0 g de soluto por 1.0 mL de solvente en un tubo de 10.0 cm de largo. Una solución que contiene concentraciones iguales de cada enantiómero en un par es una mezcla racémica; tales soluciones son ópticamente inactivas.
Claves para llevar
- Los isómeros pueden ser conformacionales o estructurales.
- Los estereoisómeros tienen la misma conectividad pero pueden ser isómeros ópticos o geométricos.
Problemas conceptuales
-
¿Qué orbitales híbridos se utilizan para formar enlaces C-C en hidrocarburos saturados? Describir el vínculo.
-
¿Cómo se relacionan los isómeros conformacionales? Dibuje dos isómeros conformacionales de propano, mirando a lo largo del eje C1—C2.
-
¿Por qué los alcanos con más de dos carbonos tienen una estructura torcida? Explica por qué una estructura torcida es tan estable.
-
¿Son n-pentano y 2-metilbutano isómeros conformacionales o isómeros estructurales? ¿Cómo separarías estos compuestos de una mezcla de los dos?
-
¿En qué se diferencian los isómeros estructurales de los estereoisómeros? ¿Los estereoisómeros tienen rotación libre sobre todos los enlaces carbono-carbono? Explique sus respuestas.
-
¿Cuál de estos objetos es quiral?
- un zapato
- un fútbol con cordones
- un automóvil
- un tenedor
-
¿Cuál de estos objetos es quiral?
- una hoja de rodillo
- un bate de béisbol sin marcar
- una bicicleta
- tus brazos
- una cuchara
-
¿Todos los estereoisómeros son también enantiómeros? ¿Todos los enantiómeros son estereoisómeros? Explique sus respuestas.
RESPUESTAS
-
sp 3; es un enlace σ que es cilindricamente simétrico (todas las secciones transversales perpendiculares al eje internuclear son círculos).
-
Los orbitales hibridados sp 3 forman enlaces en ángulos tetraédricos (109.5°), lo que obliga a los átomos de carbono a formar una cadena en zigzag.
-
(a), (c) y (d)
Estructura y Reactividad
-
Los enlaces simples entre los átomos de carbono son libres de rotar 360°.
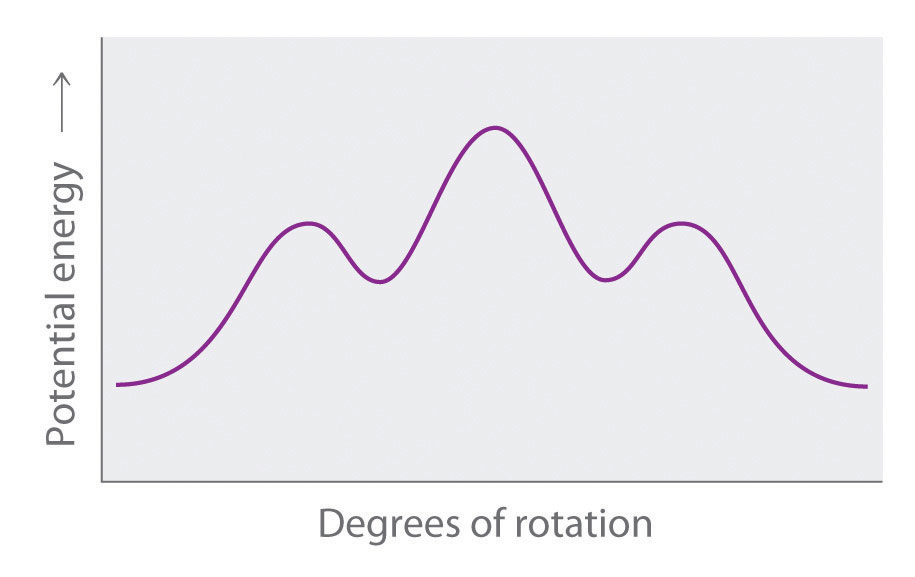
- Explique qué sucede con la energía potencial de una molécula de n-hexano a medida que la rotación ocurre alrededor del enlace C2-C3.
- Dibujar proyecciones de Newman de las conformaciones n-hexano correspondientes a los mínimos y máximos de energía en el diagrama, que muestra la energía potencial versus grados de rotación alrededor del eje C3—C4.
-
Esbozar todos los isómeros estructurales de cada compuesto.
- C 6 H 13 Br
- C 3 H 6 Cl 2
-
Dibujar todos los isómeros estructurales posibles de cada compuesto.
- C 5 H 11 Br
- C 4 H 8 Cl 2
-
Esbozar todos los isómeros de cada compuesto. Identificar los isómeros cis y trans.
- monoclorobuteno
- bromocloropropeno
-
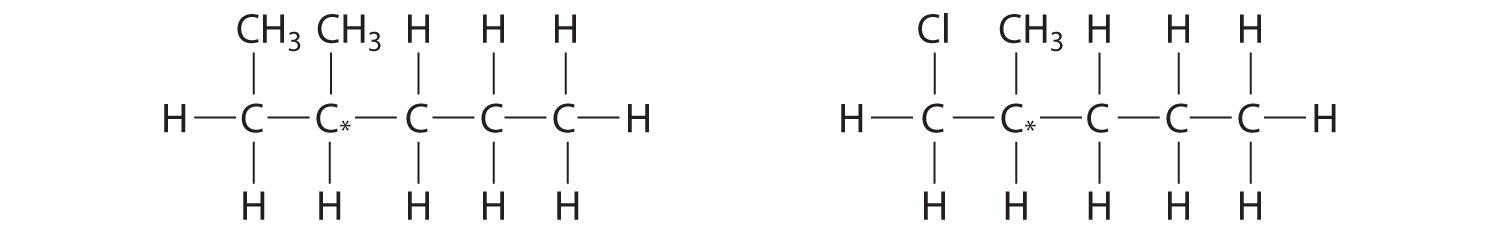
¿Qué moléculas son quirales? En las fórmulas estructurales de las moléculas quirales, identificar cualquier centro quiral con un asterisco.
- 2,2-dimetilpentano
- 1,2-dimetilpentano
- 2,4-dimetilpentano
- 1-cloro-2-metilpentano
-
¿Qué moléculas son quirales? En las fórmulas estructurales de las moléculas quirales, identificar cualquier centro quiral con un asterisco.
- 1,1-dicloropropano
- 1,2-dicloropropano
- 1,3-dicloropropano
- 1,1,2-tricloropropano
-
Dibujar las estructuras de los enantiómeros de cada compuesto.
- CH 2 CHCHCLBR
- 4-cloro-2-hexeno
- metiletilpropilamina
-
Dibujar las estructuras de los enantiómeros de cada compuesto.
- 4-metil-2-hexeno
- metiletilhexilamina
- CH 3 CH 2 CH (CH 3) Cl
-
Dibujar las estructuras de los enantiómeros de cada compuesto.
-
-
Dibujar las estructuras de los enantiómeros de cada compuesto.
-
RESPUESTAS
-
-
-
b) y d);
Colaboradores
- Anonymous
Modificado por Joshua B. Halpern