2.3: Explorando la Organización Atómica mediante Espectroscopia
- Page ID
- 76490
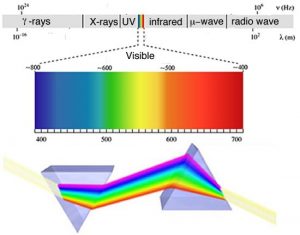
Como veremos a menudo, hay momentos en los que de repente encaja una vieja observación y ayuda a aclarar una nueva forma de pensar sobre un problema o proceso. Para comprender el comportamiento de los electrones dentro de los átomos, los científicos reunieron una serie de tales observaciones. La primera observación tiene sus raíces en la comprensión de la causa del arco iris. La explicación científica del arco iris se basa en el hecho de que la luz de diferentes longitudes de onda se dobla a través de diferentes ángulos (refractada) cuando pasa a través de una interfaz aire/agua. Cuando la luz solar pasa a través de gotitas de agua aproximadamente esféricas, se refracta en la interfaz aire/agua, se refleja parcialmente (tenga en cuenta la diferencia) desde la parte posterior de la gotita de agua y luego se refracta nuevamente a medida que sale de la gotita. El hecho subyacente que hace posible el arco iris es que la luz solar está compuesta por fotones con una distribución esencialmente continua de longitudes de onda visibles. Isaac Newton ilustró esto muy bien usando un par de prismas para mostrar que la luz blanca podría separarse en luz de muchos colores diferentes pasándola a través de un prisma y luego recombinada nuevamente en luz blanca pasándola a través de un segundo prisma. Por otro lado, la luz de un solo color siguió siendo ese color, incluso después de que pasó por un segundo prisma.
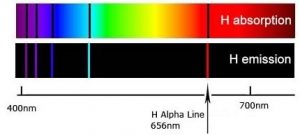
Cuando un cuerpo denso, como el Sol o el filamento de una bombilla incandescente, se calienta, emite luz de muchas longitudes de onda (colores) —esencialmente todas las longitudes de onda en el rango visible. Sin embargo, cuando se calienta una muestra de un elemento o mezcla de elementos, por ejemplo en una llama proporcionada por un quemador Bunsen, emite luz de solo longitudes de onda muy particulares. Las diferentes longitudes de onda presentes en la luz emitida pueden separarse entre sí usando un prisma para producir lo que se conoce como un espectro de emisión. Cuando se proyectan en una pantalla estas aparecen como líneas distintas, de colores brillantes, líneas de emisión conocidas. De manera complementaria, si la luz blanca, que consiste en una distribución continua de longitudes de onda de luz, pasa a través de un elemento gaseoso frío se absorberán las mismas longitudes de onda que previamente emitieron el elemento calentado, mientras que todas las demás longitudes de onda pasarán inalteradas. Al pasar la luz a través de un prisma podemos ver qué longitudes de onda de luz han sido absorbidas por el gas. Llamamos a estas áreas oscuras líneas de “absorción” dentro del espectro por lo demás continuo. Las longitudes de onda de emisión y absorción para cada elemento son iguales y únicas para cada elemento. El fenómeno de emisión y absorción proporcionan un método (espectroscopia) mediante el cual se puede utilizar la absorbancia o emisión de longitudes de onda específicas de luz para estudiar la composición y propiedades de la materia. Los científicos utilizaron métodos espectroscópicos para identificar helio, del “sol” griego, en el Sol antes de que fuera aislado en la Tierra.
En el siglo XIX, se hizo cada vez más claro que cada elemento, incluso el más simple, el hidrógeno, tiene un espectro de emisión/absorción distintivo y a menudo bastante complejo. En 1855 Johann Balmer (1825-1898) calculó la posición de las líneas en la región visible. En 1888 Johannes Rydberg (1854-1919) extendió esos cálculos a todo el espectro. Estos cálculos, sin embargo, se basaban en una fórmula empírica y no estaba claro por qué funcionaba esta fórmula o en qué características del átomo se basaba, lo que hacía que los cálculos fueran bastante insatisfactorios. Aunque útiles, no proporcionaron ninguna idea del funcionamiento de los átomos.
Dar sentido a los espectros:
¿Cómo le damos sentido a estas observaciones? Quizás la pista más importante es nuevamente el efecto fotoeléctrico; es decir, la observación de que iluminar materiales con luz puede en algunas circunstancias conducir a la expulsión de electrones. Esto sugiere que son las interacciones entre la luz y los electrones en los átomos las que son importantes. Utilizando esta idea y la evidencia de los espectros de hidrógeno Niels Bohr (1885-1962) propuso un nuevo modelo para el átomo Su primera hipótesis fue que los electrones dentro de un átomo sólo pueden viajar a lo largo de ciertas órbitas a una distancia fija del núcleo, correspondiendo cada órbita a una energía específica. La segunda idea era que los electrones pueden saltar de una órbita a otra, pero este salto requiere ya sea la captura (absorción) o la liberación (emisión) de energía, en forma de fotón. Un electrón puede moverse entre órbitas solo si un fotón de exactamente la cantidad correcta de energía es absorbido (menor a mayor) o emitido (mayor a menor). Las órbitas más bajas (más estables) a menudo se visualizan como más cercanas al núcleo, mientras que las órbitas más altas, menos estables y más energéticas están más alejadas. Sólo cuando se agrega suficiente energía en un solo paquete se elimina el electrón completamente del átomo, dejando un ion cargado positivamente (un ion es un átomo o molécula que tiene un número diferente de protones y electrones) y un electrón libre. Debido a que la diferencia de energía entre órbitas es diferente en diferentes tipos de átomos, mover electrones entre diferentes órbitas requiere fotones que transporten diferentes cantidades de energía (diferentes longitudes de onda).
El modelo de Bohr funcionó bien para los átomos de hidrógeno; de hecho, pudo explicar y calcular con precisión las longitudes de onda de todas las líneas de emisión/absorción observadas por el hidrógeno. Estos cálculos involucraron un número cuántico entero que correspondía a los diferentes niveles de energía de las órbitas. [11] Desafortunadamente, este modelo no fue capaz de predecir el espectro de emisión/absorción para ningún otro elemento, incluido el helio y ciertamente no para ninguna molécula. Al parecer, Bohr estaba en el camino correcto —porque cada elemento sí tiene un espectro único y por lo tanto los electrones deben estar transitando de un nivel de energía a otro— pero a su modelo le faltaba algo importante. No estaba del todo claro qué restringía los electrones a niveles específicos de energía. ¿Qué sucede en los átomos con más de un electrón? ¿Dónde están situados esos electrones y qué gobierna su comportamiento e interacciones? Cabe recordar que aunque el modelo Bohr de electrones que orbita el núcleo a menudo se utiliza como representación visual de un átomo, no es correcto. Los electrones no rodean el núcleo en órbitas definidas. El modelo de Bohr solo sirve como modelo visual aproximado para la aparición de un átomo, ¡no es como se comportan realmente los electrones!
Preguntas para responder
- Si la intensidad de un haz de luz está relacionada con el número de fotones que pasan por segundo, ¿cómo explicarías la intensidad usando el modelo de luz como onda? ¿Qué cambiaría y qué quedaría igual?
- ¿Por qué no nos preocupamos por ser constantemente bombardeados por ondas de radio (lo estamos), pero aún así guardamos nuestra exposición a los rayos x?
- Haz una imagen de lo que imaginas que está sucediendo durante el efecto fotoeléctrico.
- ¿La energía requerida para expulsar un electrón es la misma para cada metal?
Preguntas para reflexionar
- ¿Se te ocurren otras ideas científicas que te parecen sin sentido? Se honesto.
- ¿Cómo encaja la idea de un electrón como onda con tu imagen mental de un átomo?
- ¿Dónde está el electrón si es una onda?
Preguntas para más tarde
- ¿Qué tendencias podrías esperar en las energías requeridas para expulsar un electrón?
- ¿Por qué crees que este fenómeno (el efecto fotoeléctrico) se ve con mayor frecuencia con los metales? ¿Qué propiedad de los metales se está explotando aquí?
- ¿Qué otros tipos de materiales podrían producir un efecto similar?


