2.5: Elementos Organizadores: Introducción a la Tabla Periódica
- Page ID
- 76461
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Hasta este punto hemos hecho una serie de suposiciones injustificadas. Hemos hablado de elementos pero no hemos especificado explícitamente en qué se diferencian, así que hagámoslo ahora mismo. Si empezamos con hidrógeno lo caracterizamos por la presencia de un protón en el núcleo y un electrón que lo rodea. Los átomos son siempre neutros, lo que significa que el número de partículas cargadas positivamente es igual al número de partículas cargadas negativamente, y las cargas vienen en unidades discretas, iguales y opuestas. La presencia de un protón y un electrón define un átomo de hidrógeno pero el mundo es un poco más complejo que eso. Un átomo de hidrógeno también puede contener uno o dos neutrones en su núcleo. Un neutrón puede considerarse, con el perdón de los físicos, un protón, un electrón, y un neutrino sin carga, y por lo tanto es eléctricamente neutro. Los neutrones están involucrados en la fuerte fuerza nuclear y adquieren cada vez más importancia a medida que el elemento aumenta en número atómico. En el hidrógeno, los neutrones (si están presentes) tienen bastante poco que ver, pero en los elementos más pesados la fuerza nuclear fuerte es crítica para mantener unido el núcleo, ya que a distancias cortas esta fuerza es\(\sim 100\) veces más fuerte que la repulsión electrostática entre protones cargados positivamente, que es por qué los núcleos no se desintegran simplemente. Al mismo tiempo, la fuerza fuerte actúa en un rango muy limitado, por lo que cuando las partículas están separadas por más de aproximadamente\(2 \times 10^{-15} \mathrm{~m}\) (\(2\)femtómetros o fm), podemos ignorarla.
A medida que agregamos un protón tras otro a un átomo, lo que podemos hacer en nuestra mente, y que ocurre dentro de estrellas y supernova, de una manera bastante más compleja, generamos los diversos elementos. El número de protones determina la identidad elemental de un átomo, mientras que el número de neutrones puede variar. Los átomos del mismo elemento con diferentes números de neutrones se conocen como isótopos de ese elemento. Cada elemento se caracteriza por un número entero distinto (1, 2, 3,...) de protones y el mismo número entero de electrones. Aquí surge una pregunta interesante: ¿es infinito el número de posibles elementos? Y si no, ¿por qué no? Teóricamente, podría parecer posible seguir agregando protones (y neutrones y electrones) para producir una gran cantidad de diferentes tipos de átomos. Sin embargo, como estableció Rutherford, el núcleo es bastante pequeño en comparación con el átomo en su conjunto, típicamente entre uno y diez femtómetros de diámetro. A medida que agregamos más y más protones (y neutrones) el tamaño del núcleo excede el rango efectivo de la fuerza nuclear fuerte (\(< 2 \mathrm{~fm}\)), y el núcleo se vuelve inestable. Como cabría esperar, los núcleos inestables se rompen (fisión nuclear), produciendo diferentes elementos con menor número de protones, un proceso que también libera enormes cantidades de energía. Algunos isótopos son más estables que otros, razón por la cual la tasa de su descomposición, junto con un conocimiento de los elementos en los que se descomponen se pueden utilizar para calcular la edad de las rocas y otros tipos de artefactos. [14]
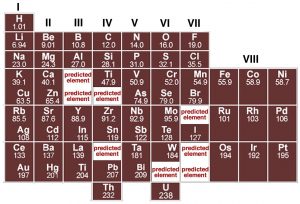
Cada elemento se define por el número de protones en el núcleo, y como tal es diferente de cualquier otro elemento. De hecho, un análisis cuidadoso de diferentes elementos revela que hay periodicidades (patrones repetitivos) en las propiedades de los elementos. Si bien John Dalton produjo una tabla de elementos con sus pesos atómicos en 1805, fue sólo cuando Dimitri Mendeleev (1834—1907) intentó organizar los elementos en términos de sus propiedades químicas y físicas que comenzó a surgir alguna apariencia de orden. Mendeleev, profesor ruso de química, estaba frustrado por la falta de organización de la información química, por lo que decidió escribir su propio libro de texto (no muy diferente de sus autores actuales). En ese momento, los científicos habían identificado alrededor de 60 elementos y habían establecido sus masas en relación con el hidrógeno. Los científicos ya habían notado que los elementos muestran patrones repetitivos de comportamiento: y que algunos elementos tienen propiedades muy similares. Fue la perspicacia de Mendeleev que estos patrones podrían ser utilizados como guía para organizar los elementos de manera sistemática. En su tabla periódica, publicada en 1869, colocó elementos en orden de aumentar el peso atómico en filas repetidas de izquierda a derecha; elementos con propiedades químicas similares se colocaron en columnas verticales (conocidas como grupos).
Si bien varios otros científicos estaban trabajando en esquemas para mostrar patrones en el comportamiento elemental, fue el arreglo de Mendeleev el que surgió como base para la tabla periódica moderna, no sólo por la forma en que arregló los elementos sino también por lo que dejó fuera y por lo que cambió. Por ejemplo estaba tan seguro de la lógica subyacente de su mesa que donde ciertos elementos parecían fuera de lugar, basados, por ejemplo, en sus pesos atómicos reportados, como el teluro y el yodo, los revirtió y resultó ser correcto. Donde Mendeleev predijo que deberían estar los elementos, dejó huecos en su mesa para acomodarlos. Posteriormente, los científicos descubrieron estos elementos faltantes (por ejemplo, germanio, galio y escandio). De hecho, ahora sabemos que no es el peso atómico (es decir el número de protones y neutrones) sino más bien el número atómico\(Z\),, (el número de protones y electrones) el que aumenta periódicamente. Esto explica por qué el telurio (\(\text{atomic mass } 127.6, Z = 52\)) debe venir antes que el yodo (\(\text{atomic mass } 126.9, Z = 53\)). El punto importante a tener en cuenta es que aunque la tabla periódica moderna está dispuesta en orden de creciente número de protones y electrones, la repetición y los patrones que emergen son propiedad de los electrones, sus arreglos y energías. Este es nuestro siguiente tema.
Pregunta para responder
- A autores de ciencia ficción les gustan los elementos extraños. Proporcione una respuesta breve de por qué no son posibles nuevos elementos con números atómicos por debajo de 92.
- Los isótopos del mismo elemento son químicamente muy similares. ¿Qué implica eso sobre lo que determina el comportamiento químico?
Preguntas para reflexionar
- ¿Por qué cree que no había gases nobles en la tabla periódica de Mendeleev?
- ¿Por qué los pesos atómicos en la tabla periódica de Mendeleev no son números enteros?
- ¿Por qué esperarías que diferentes isótopos del mismo elemento difieran en estabilidad?
- Descubres un nuevo elemento. ¿Cómo sabrías a dónde debería ir en la tabla periódica?


