4.1: Representaciones 3D y 2D
- Page ID
- 76659
Para extender nuestra discusión al mundo más amplio de lo que podríamos llamar moléculas heterogéneas, es decir, moléculas compuestas por átomos de más de un elemento, comenzaremos con el carbono. ¿Por qué carbono? Bueno, aquí hay algunas razones. El carbono es el cuarto elemento más abundante del universo (\(\sim 3,032\)átomos por millón), después del hidrógeno (\(\sim 705,700\)átomos por millón), helio (\(\sim 275,200\)átomos por millón) y oxígeno (\(\sim 5,920\)átomos por millón). El carbono se distingue de la mayoría de los otros elementos en su capacidad para formar una amplia gama de compuestos diversos al unirse consigo mismo y otros elementos con enlaces que no son demasiado fuertes ni demasiado débiles. Bajo las condiciones que persisten en la superficie de la Tierra, los compuestos de carbono son lo suficientemente estables como para colgarse pero no lo suficientemente estables como para persistir para siempre, por lo que no son callejones sin salida. El carbono es un componente clave de las principales moléculas de la vida: proteínas, ácidos nucleicos, lípidos e hidratos de carbono. ¡Somos formas de vida basadas en carbono! Los compuestos de carbono también se utilizan en una amplia gama de materiales sintéticos, como productos farmacéuticos, polímeros y materiales de alta tecnología; también consumimos muchos compuestos de carbono quemándolos como combustible.
Carbono: Siempre tetravalente y a menudo tetraédrico
Los átomos se combinan de muchas maneras diferentes. Ya hemos visto un ejemplo de cómo se puede formar un enlace covalente entre dos átomos de hidrógeno produciendo molecular (\(\mathrm{H}_{2}\)) a diferencia de la forma atómica del hidrógeno. De manera similar, los átomos de carbono se pueden unir entre sí de varias maneras para formar diamante, grafito y grafeno (ver Capítulo\(3\)). Ahora pasamos a moléculas que involucran átomos de carbono y otros elementos. De acuerdo con nuestro intento continuo de mantener las cosas simples (o mejor dicho, lo más simple posible), empecemos por examinar los tipos de moléculas que se pueden formar combinando carbono con hidrógeno. Hay muchas moléculas de este tipo, y colectivamente se las conoce como hidrocarburos. El compuesto más simple de este tipo es el metano\(\mathrm{CH}_{4}\), un componente principal del gas natural. Como en todos sus compuestos y sus formas elementales, el carbono es tetravalente, lo que significa que siempre forma cuatro enlaces. Ahora vamos a considerar con mayor detalle por qué esto es así, qué formas pueden tomar los vínculos y cuáles son las consecuencias de este hecho. En esta discusión, estaremos construyendo sobre las ideas introducidas cuando hablamos de diamante, grafito y grafeno.
Para responder a estas preguntas necesitamos volver a las ideas (introducidas en el Capítulo\(2\)) sobre la cuantificación de los niveles de energía electrónica. El carbono tiene un total de seis electrones, dos de los cuales están en una capa cuántica llena (\(1\mathrm{s}\)), y cuatro electrones de valencia; son estos electrones de valencia los que pueden tomar parte en la unión. Recuerda que la formación de un enlace siempre baja la energía de un sistema. Por lo tanto, tiene sentido que un átomo de carbono forme tantos enlaces como sea posible, dando como resultado las especies moleculares más estables posibles.
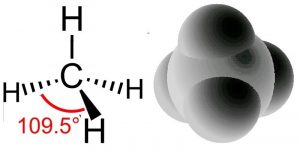
¿Qué pasa si combinamos hidrógeno con carbono? ¿Obtenemos un compuesto con propiedades intermedias entre los dos? Absolutamente no, como cabría esperar al considerar las diferencias entre diamantes y grafito. Como anteriormente utilizamos el modelo de hibridación para explicar los comportamientos que observamos. Comenzamos con lo que sabemos: en el metano los átomos de carbono forman cuatro enlaces, uno a cada uno de cuatro átomos de hidrógeno. También sabemos, por experimento, que la forma de la molécula de metano es tetraédrica; hay un carbono en el centro y los cuatro\(\mathrm{C-H}\) enlaces apuntando hacia las esquinas de una figura de cuatro lados. Dado que cada\(\mathrm{C-H}\) enlace se forma a partir de orbitales de unión podemos utilizar el modelo de unión donde estos cuatro orbitales de unión surgen de la “hibridación” de los orbitales preexistentes\(2\mathrm{s}\) y tres\(2\mathrm{p}\) atómicos. Los electrones en el\(1\mathrm{s}\) orbital no se utilizan porque la cantidad de energía necesaria para usar esos electrones es mayor que la energía que se liberaría tras la formación del enlace (se sujetan firmemente al núcleo por la fuerza electromagnética). Resulta ser una regla general que los electrones en el núcleo del átomo, en conchas rellenas, tienden a no tomar parte en la unión. Esto significa que solo necesitamos considerar los electrones de valencia al pensar en la unión.
La hibridación de los\(2\mathrm{p}\) orbitales\(2\mathrm{s}\) y los tres resultados en cuatro orbitales\(\mathrm{sp}^{3}\) moleculares, cada uno de los cuales puede interactuar con el\(1\mathrm{s}\) orbital del\(\mathrm{H}\) átomo para formar un enlace. Cuando se forma un orbital de unión contiene dos electrones. Debido a que el carbono tiene cuatro electrones de valencia y cada uno de los cuatro hidrógenos tiene un electrón, el resultado es un total de ocho electrones distribuidos en cuatro orbitales de enlace.
Recordemos que decimos que la hibridación del carbono es\(\mathrm{sp}^{3}\) y la disposición de los enlaces es tetraédrica, lo que significa que el ángulo entre orbitales (y los enlaces C—H) es de 109.5º. Otra forma de decir esto es que el ángulo de\(\mathrm{H-C-H}\) unión es\(109.5^{\circ}\). Podemos predecir que este será el caso con base en cálculos teóricos; estos han sido confirmados por observaciones experimentales. Pero, ¿por qué debería ser esto cierto? ¿Cuántos arreglos diferentes hay para cuatro hidrógenos unidos a un solo carbono? ¿Por qué no están todos los hidrógenos dispuestos en un solo plano (alrededor de una central\(\mathrm{C}\) con ángulos de\(90^{\circ}\) enlace) en lugar de en la disposición tetraédrica? La disposición plana, que se conoce como geometría plana cuadrada, es realmente posible y a veces se observa bajo algunas condiciones especiales, generalmente en moléculas que involucran metales de transición como veremos más adelante). La disposición plana cuadrada no es tan estable como la disposición tetraédrica para el carbono porque cada\(\mathrm{C-H}\) enlace puede considerarse como una región de alta densidad de electrones (carga negativa). Dado que como repele como, cada vínculo repele a los demás y se aleja lo más posible de los otros lazos. El ángulo de unión óptimo resulta estar\(109.5^{\circ}\) alejado de cada uno de sus vecinos. En ese punto, si se alejaban de una órbita se acercarían a otra. ¡Quizás quieras convencerte de este hecho geométrico usando un malvavisco, palillos de dientes y gomitas! Este principio se conoce con el nombre difícil de manejar de repulsión de pares de electrones de capa de valencia (VSEPR) y puede usarse para predecir (una vez que lo dominas) la estructura tridimensional (3D) de moléculas simples, asumiendo que sabes cómo están conectados los átomos dentro de una molécula. Por ejemplo, usando la lógica VSEPR, debería poder presentar un argumento convincente de por qué los\(\mathrm{C-H}\) enlaces en metano no adoptan una orientación plana cuadrada, así como la forma general de muchos otros tipos de moléculas. Incluso se puede ir más allá, en el metano los cuatro átomos unidos al carbono central son iguales pero ¿y si son diferentes? Deberías poder hacer predicciones plausibles sobre cómo cambiarían los ángulos de enlace si uno de los grupos adjuntos es más grande que los demás, ¿cómo influiría eso en los ángulos de enlace?
Un problema para muchas personas es que la visualización 3D de estructuras moleculares no es fácil. Es particularmente complicado cuando se llama a traducir las representaciones bidimensionales (2D) más o menos abstractas (2D) (Lewis y estuturas de puntos\(\downarrow\)) que encuentras impresas en la página de un libro, en un modelo 3D que puedes manipular con tus manos o en tu mente. Además, los químicos (y los biólogos moleculares) tienen una tendencia molesta de representar estructuras 3D complejas utilizando diversas representaciones 2D, lo que puede resultar confuso si no sabes lo que estás viendo (o para). Probablemente ya hayas visto algunas de estas diferentes estructuras, y consideraremos algunas de ellas a continuación. Cada uno proporciona tipos específicos de información sobre la molécula. Tenga en cuenta que los modelos físicos 3D reales y las actividades web pueden ser muy útiles para solidificar sus ideas sobre la estructura.
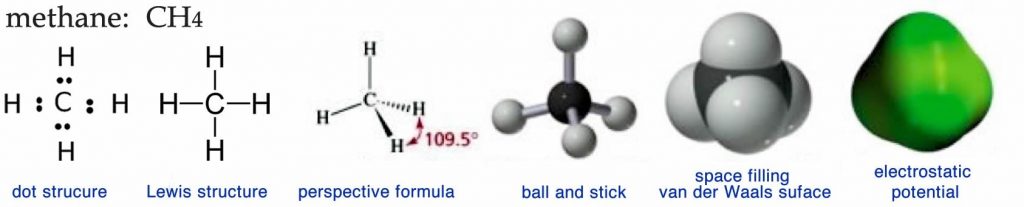
Si pudiéramos ver una molécula de metano, lo que observamos probablemente estaría más cerca del mapa de potencial electrostático. Esta visualización proporciona una imagen de la superficie de la molécula, generalmente codificada por colores para representar las fluctuaciones en la densidad de electrones. Observe que no hay fluctuaciones de color en este modelo de metano, lo que indica que no hay distorsiones de nubes de electrones (permanentes) en la molécula, la superficie de la molécula es uniformemente neutra eléctricamente. Lo que no es tan fácil de discernir a partir de esta representación es el hecho de que el metano es tetraédrico o que el átomo de carbono central está unido a cuatro átomos de hidrógeno, hecho que es mucho más fácil de apreciar en las otras representaciones. La representación del potencial electrostático es muy útil para moléculas biológicas grandes por varias razones: es mucho más simple que los otros tipos de modelos porque no están representados los átomos individuales; muestra la forma de la molécula; y muestra dónde se encuentran las cargas y cargas parciales.
El modelo de relleno espacial o van der Waals da más información estructural en que los átomos individuales que componen la molécula se distinguen por el color (negro para carbono, blanco para hidrógeno, rojo para oxígeno y azul para nitrógeno). La superficie del modelo representa el radio de van der Waals de la molécula, que es la distancia donde la atracción se convierte en repulsión cuando dos moléculas se acercan entre sí. Como su nombre lo indica, tales modelos representan el espacio ocupado por cada átomo.
El modelo de metano de bola y varilla muestra el carbono central (bola negra) unido a cuatro hidrógenos (bolas blancas) por barras que representan los enlaces entre los átomos. Aunque este modelo es probablemente el más fácil de visualizar, es engañoso porque podría dar la impresión de que los enlaces son como palos que mantienen unidos los átomos. Tampoco representa ni el volumen real ocupado por la molécula ni sus características superficiales electrostáticas. Otro problema con los tres tipos de modelos anteriores es que se necesita una computadora y un software especializado (o alguna habilidad artística) para dibujarlos, lo que puede que no siempre sea conveniente o posible.
Una estrategia para abordar este problema es a través de lo que se conoce como fórmula de perspectiva. En una fórmula en perspectiva los átomos están representados por sus símbolos atómicos (por ejemplo,\(\mathrm{C}\) o\(\mathrm{H}\)) y los enlaces están representados por varios tipos de líneas. Una línea normal está destinada a indicar un vínculo que está en el plano del papel, una línea acuñada![]() representa un vínculo que está saliendo del plano hacia usted (el lector), y una línea rayada
representa un vínculo que está saliendo del plano hacia usted (el lector), y una línea rayada![]() representa un vínculo que está saliendo del plano, pero lejos de usted. Esta convención hace que sea más fácil dibujar estructuras de perspectiva 3D a mano sin software especializado (o talento gráfico). Podemos, de hecho, ir un paso más allá y extraer metano sin indicar su estructura 3D en absoluto. Las estructuras que muestran todos los enlaces, átomos y cualquier electrón de valencia que no están en enlaces, pero que no intentan representar con precisión la forma 3D de una molécula se llaman estructuras de Lewis. La estructura de Lewis para el metano (ver arriba) y la fórmula molecular\(\mathrm{CH}_{4}\) representan una taquigrafía química que puede proporcionar una gran cantidad de información; veremos ejemplos aún más extremos a medida que avanzamos. No obstante, para poder entender estas representaciones, ya se debe saber que la molécula de metano es tetraédrica y las reglas que se aplican a la geometría de los enlaces de carbono, porque ninguno se muestra explícitamente. Si no sabías estas cosas, incluso podrías estar tentado a asumir que el metano está organizado con una geometría plana cuadrada o que los hidrógenos están todos ubicados a un lado del átomo de carbono, ¡ninguno de los cuales es cierto!
representa un vínculo que está saliendo del plano, pero lejos de usted. Esta convención hace que sea más fácil dibujar estructuras de perspectiva 3D a mano sin software especializado (o talento gráfico). Podemos, de hecho, ir un paso más allá y extraer metano sin indicar su estructura 3D en absoluto. Las estructuras que muestran todos los enlaces, átomos y cualquier electrón de valencia que no están en enlaces, pero que no intentan representar con precisión la forma 3D de una molécula se llaman estructuras de Lewis. La estructura de Lewis para el metano (ver arriba) y la fórmula molecular\(\mathrm{CH}_{4}\) representan una taquigrafía química que puede proporcionar una gran cantidad de información; veremos ejemplos aún más extremos a medida que avanzamos. No obstante, para poder entender estas representaciones, ya se debe saber que la molécula de metano es tetraédrica y las reglas que se aplican a la geometría de los enlaces de carbono, porque ninguno se muestra explícitamente. Si no sabías estas cosas, incluso podrías estar tentado a asumir que el metano está organizado con una geometría plana cuadrada o que los hidrógenos están todos ubicados a un lado del átomo de carbono, ¡ninguno de los cuales es cierto!
¿Por qué, podría preguntarse, uno querría dibujar estructuras con tanta información faltante? Quizás, como los alquimistas medievales, los químicos modernos quieren guardar sus secretos de la persona promedio. Quizás simplemente les gustan los códigos secretos y los símbolos místicos. O tal vez sea porque estas representaciones taquigráficas de moléculas son simplemente mucho más compactas y fáciles de dibujar, particularmente cuando llegamos a moléculas grandes con muchos átomos. [1] Dibujar estructuras de Lewis es una habilidad química importante y útil y en breve volveremos a ella con más detalle. Una vez que la hayas dominado podrás observar una fórmula molecular como\(\mathrm{CH}_{4}\) (o\(\mathrm{C}_{5}\mathrm{H}_{12}\)) y (junto con otra información) poder visualizar la estructura 3D de la molécula representada y predecir muchas de las propiedades físicas y químicas de la sustancia.
Por ejemplo, los modelos de la molécula de metano predicen que es simétrica. Nuevamente, esto podría no ser del todo obvio con solo mirar la estructura, pero si haces un modelo, o miras un modelo 3D interactivo giratorio en la web verás que no importa de qué manera miras la estructura: todos los\(\mathrm{C-H}\) enlaces son iguales y todos los ángulos de unión son iguales. Un poco más de información (que discutiremos más adelante) le permitirá deducir que no hay distorsiones permanentes de densidad de electrones en la molécula, tal como lo muestra el mapa de potencial electrostático. Juntos, estos permiten deducir que las moléculas de metano son atraídas entre sí únicamente a través de las fuerzas de dispersión de Londres (como los átomos de helio o las moléculas de hidrógeno). Dado lo débiles que son estas interacciones entre moléculas, podríamos ser lo suficientemente valientes como para predecir que los puntos de fusión y ebullición del metano son bajos (el derretimiento y la ebullición ocurren a temperaturas relativamente bajas) y ¡tendríamos razón! El metano se funde\(91 \mathrm{~K}\) y hierve en\(112 \mathrm{~K}\). [2]
Pregunta para responder
- ¿Por qué (cuando están presentes) los cuatro enlaces formados por el carbono suelen estar dispuestos de manera que apunten hacia las esquinas de un tetraedro?
Preguntas para reflexionar
- Si la formación de enlaces se estabiliza, ¿por qué el carbono no forma seis enlaces, dado que tiene seis electrones?
- ¿Por qué el helio no se une con el carbono?
- ¿Cuáles serían las consecuencias si los enlaces de carbono con otros átomos fueran muy débiles?
- ¿Cuáles serían las consecuencias si los enlaces de carbono con otros átomos fueran muy fuertes?
Construyendo moléculas cada vez más complejas
Pronto te darás cuenta de que es posible construir una cantidad bastante asombrosa de compuestos usando solo hidrógeno y carbono. Por ejemplo imaginemos que eliminamos un hidrógeno de una molécula de metano; esto nos deja con lo que se conoce como grupo metilo (\(\mathrm{-CH}_{3}\)). Podemos combinar dos grupos metilo formando un\(\mathrm{C-C}\) enlace entre ellos (es posible que desee convencerse de que cada átomo de carbono todavía está haciendo cuatro enlaces con átomos vecinos). La molécula resultante se conoce como etano (\(\rightarrow\)). La estructura del etano se puede escribir de varias maneras, por ejemplo\(\mathrm{H}_{3}\mathrm{C-CH}_{3}\),\(\mathrm{CH}_{3}\mathrm{-CH}_{3}\) o\(\mathrm{C}_{2}\mathrm{H}_{6}\). A medida que aumenta el número de átomos, también lo hace el número de diferentes formas en que se puede representar una molécula. Es por esta razón que los químicos han desarrollado una serie de reglas que se adhieren bastante estrictamente; estas reglas permiten comunicar sin ambigüedades la estructura de una molécula a otros. [3] No vamos a dedicar mucho tiempo a todas estas diversas reglas pero hay actividades web que puedes hacer si quieres obtener una introducción y practicarlas. Estas convenciones de nomenclatura son controladas por la Unión Internacional de Química Pura y Aplicada, conocida como IUPAC y estas reglas se pueden encontrar en el Compendio de Terminología Química. [4]
El proceso de eliminación de hidrógenos y adición de grupos metilo puede continuar, esencialmente sin límite, para generar una familia de hidrocarburos [5] conocida como los alcanos; las reglas que rigen estas moléculas son simples: cada hidrógeno hace uno y solo un enlace; cada carbono debe hacer cuatro enlaces discretos; y estos cuatro enlaces son de orientación tetraédrica. El número de carbonos es en teoría ilimitado y la forma en que están unidos determina el número de hidrógenos. (¿Ves cómo dos hidrocarburos con el mismo número de átomos de carbono podrían tener diferentes números de hidrógenos?)
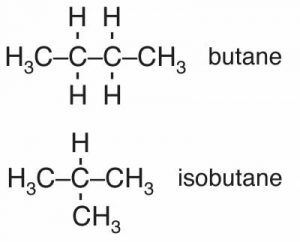
Dependiendo de cómo se conecten los carbonos es posible generar una amplia variedad de moléculas con formas dramáticamente diferentes. Por ejemplo, hay alcanos enjaulados, esféricos y largos, en forma de cuerda. Considera los alcanos de cuatro carbonos. Hay butano e isobutano que tienen la fórmula así\(\mathrm{C}_{4}\mathrm{H}_{10}\) como otros con cuatro carbonos pero diferentes números de hidrógenos, por ejemplo: ciclobutano, metilciclopropano y tetraedrano. El butano tiene un punto de ebullición de\(-0.5^{\circ}\mathrm{C}\), y el isobutano tiene un punto de ebullición de\(-11.7^{\circ}\mathrm{C}\). ¿Por qué son diferentes los puntos de ebullición del butano y del isobutano, que tienen la misma composición atómica (\(\mathrm{C}_{4}\mathrm{H}_{10}\))? La respuesta radica en el hecho de que tienen diferentes formas. La cadena de carbono más o menos lineal del butano tiene una superficie mayor que el isobutano, lo que le da más área superficial a través de la cual interactuar con otras moléculas a través de las fuerzas de dispersión de Londres. Esta idea, que la forma de una molécula y su composición, determinan las propiedades macroscópicas del compuesto es una a la que volveremos repetidamente.
Pregunta para responder
- ¿Por qué los puntos de fusión y ebullición del metano son más altos que los puntos de fusión y ebullición de\(\mathrm{H}_{2}\)?
- ¿Cuántos compuestos diferentes puedes dibujar para la fórmula\(\mathrm{C}_{5}\mathrm{H}_{12}\)?
- ¿Qué estructuras podrías imaginar para los hidrocarburos que contienen cinco átomos de carbono?
- ¿Existe una fórmula genérica para un alcano que contenga n átomos de carbono? ¿Cómo la formación de un anillo de carbonos cambia tu fórmula?
- ¿Cuál tiene el punto de ebullición más alto, un alcano esférico o lineal?
- ¿Cómo cambian los puntos de ebullición y puntos de fusión a medida que aumenta el peso molecular?
Pregunta para reflexionar
- Hacer una predicción en cuanto a los puntos de fusión y ebullición del etano, en comparación con el metano. ¿Qué suposiciones estás haciendo? ¿Cómo probarías si esos supuestos son válidos?
- ¿Por qué la forma de una molécula influye en su comportamiento y sus propiedades macroscópicas?


