4.2: Enlaces simples y forma molecular
- Page ID
- 76676
\(\mathrm{C–C}\)y\(\mathrm{C–H}\) los enlaces son descritos por orbitales moleculares; los cálculos indican que la mayor parte de la densidad electrónica asociada a estos orbitales se encuentra entre los dos núcleos. Los\(\mathrm{C–H}\) enlaces tienen una longitud de\(109 \times 10^{-12} \mathrm{~m}\) (\(109 \mathrm{~pm}\)) mientras que el\(\mathrm{C–C}\) enlace es aproximadamente 50% más largo,\(154 \times 10^{-12} \mathrm{~m}\) (\(154 \mathrm{~pm}\)). Esto se debe a que el orbital de\(\mathrm{C–C}\) enlace está hecho de orbitales\(\mathrm{sp}^{3}\) híbridos, que son más grandes que los\(1\mathrm{s}\) orbitales que utiliza el hidrógeno para formar enlaces. Estos llamados enlaces σ (sigma) tienen una propiedad interesante; los átomos que enlazan pueden girar entre sí sin romper el enlace entre ellos. Para un\(\mathrm{C–H}\) enlace, si los\(\mathrm{H}\) giros sería imposible decir, ya que el\(\mathrm{H}\) átomo es radialmente simétrico alrededor del eje del\(\mathrm{C–H}\) enlace. Pero si los carbonos en el\(\mathrm{C–C}\) enlace del etano giran uno con relación al otro, entonces es posible observar diferentes arreglos mirando hacia abajo el eje de\(\mathrm{C–C}\) enlace. Por ejemplo:
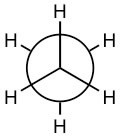 y
y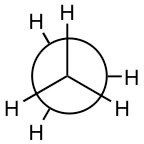
son ambas representaciones de etano (el\(\mathrm{C–C}\) enlace no se ve en esta representación porque estás mirando directamente hacia abajo del\(\mathrm{C–C}\) enlace). Parecen diferentes porque la disposición de los átomos es diferente en el espacio, pero de hecho a temperatura ambiente estas dos disposiciones pueden interconvertirse fácilmente girando alrededor del\(\mathrm{C–C}\) enlace.
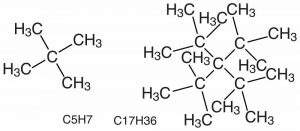
Esto plantea otro punto a considerar, a saber, que iniciar (y detener) las rotaciones de enlace requiere energía. De igual manera, puede haber vibraciones a lo largo de la longitud de un enlace, lo que nuevamente implica la absorción o liberación de energía. Consideraremos esto más adelante. [6] En el caso del enlace giratorio resulta que a medida que el grueso de los grupos unidos a los carbonos aumenta la energía requerida para la rotación alrededor del\(\mathrm{C–C}\) enlace también aumenta. Grupos grandes y voluminosos pueden chocar entre sí, ocupando el espacio del otro causando repulsiones electrón-electrón y elevando la energía de cualquier forma donde los grupos estén demasiado cerca. Esto tiende a bloquear la molécula en orientaciones específicas que pueden influir en las propiedades físicas del compuesto. Un ejemplo de cómo la estructura interfiere con la formación de una molécula es una molécula que contiene 17 átomos de carbono y 36 átomos de hidrógeno (\(\rightarrow\)); aunque es posible dibujar esta molécula nunca se ha sintetizado porque los átomos se agolpan entre sí, y se entrometen en el espacio del otro. Sin embargo, es posible sintetizar moléculas con el mismo número de átomos de carbono pero menos átomos de hidrógeno. [7] ¿Se puede producir una explicación plausible de por qué?
Colapso de estructuras reales hasta representaciones bidimensionales
Ahora bien, un problema obvio con las moléculas tridimensionales complejas, incluso las compuestas únicamente por hidrógeno y carbono, es cómo transmitir su estructura cuando deben representarse en dos dimensiones, como cuando escribes en papel. Las investigaciones indican que los estudiantes (es decir, la mayoría de la gente) tienen dificultades con esta tarea, por lo que aquí describiremos diversos enfoques.
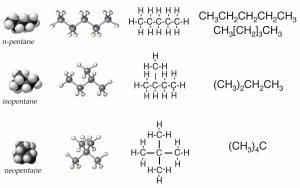
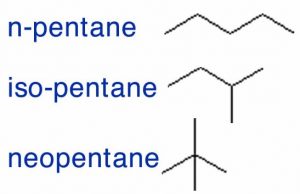
Antes de comenzar, necesitamos tener algunas reglas. Usemos el conjunto de posibles moléculas que contienen 5 átomos de carbono y 12 átomos de hidrógeno; estas se conocen genéricamente como pentanos. Puedes comenzar con un trozo de papel y un lápiz; ¿cuántas moléculas diferentes puedes dibujar con la composición de\(\mathrm{C}_{5}\mathrm{H}_{12}\)? Claramente\(\mathrm{C}_{5}\mathrm{H}_{12}\) no define de manera única la estructura de la molécula; es mejor usar sus nombres distintos: pentano, isopentano y neopentano (\(\rightarrow\)). Cada una de las diferentes moléculas que has dibujado tiene la misma fórmula molecular pero una forma diferente y, resulta, propiedades diferentes. Por ejemplo, el pentano tiene un punto de ebullición de\(308 \mathrm{~K}\), mientras que los puntos de ebullición de isopentano y neopentano son\(301 \mathrm{~K}\) y\(283 \mathrm{~K}\), respectivamente. Su forma, más que su composición elemental, influye en la fuerza de los atractivos entre las moléculas individuales, lo que a su vez influye en sus puntos de ebullición. Llamamos a este tipo de compuestos relacionados isómeros estructurales, lo que significa que tienen la misma composición (por ejemplo\(\mathrm{C}_{5}\mathrm{H}_{12}\)) pero sus átomos constituyentes están conectados de manera diferente para dar diferentes estructuras y formas.
Es común utilizar una serie de diferentes tipos de representaciones para imaginar moléculas. Una manera es a través de lo que se conoce como fórmulas de texto (o fórmulas lineales). En este esquema, se escribe pentano\(\mathrm{CH}_{3}\mathrm{–CH}_{2}\(\mathrm{–CH}_{2}\mathrm{–CH}_{2}\(\mathrm{–CH}_{3}\), que también se puede escribir como\(\mathrm{CH}_{3}-\left[\mathrm{CH}_{2}\right]_{3}-\mathrm{CH}_{3}\). Esto captura algunas de las sutilezas estructurales del pentano, pero no todas. Por ejemplo, no ilustra el hecho de que la molécula no sea estrictamente lineal. Sin embargo, ya podemos anticipar complicaciones. ¿Cómo escribiríamos isopentano? La forma más obvia sería\(\left(\mathrm{CH}_{3}\right)_{2} \mathrm{CHCH}_{2} \mathrm{CH}_{3}\). El neopentano se escribe como\(\left(\mathrm{CH}_{3}\right)_{4} \mathrm{C}\). ¿Eso tiene sentido? Intenta descifrarlos. Volveremos a este punto más adelante en este capítulo.
Si seguimos la lógica de este enfoque podríamos dibujar una representación más completa del pentano, isopentano y neopentano como estructuras de Lewis, pero nuevamente, nos falta la tridimensionalidad. Incluso podrías ser llevado a pensar que las moléculas son realmente planas cuando son mucho más como bolas. Si bien es posible hacer la representación un poco más realista tratando de indicar la tridimensionalidad usando los símbolos de cuña y guión, estas estructuras se vuelven muy complicadas muy rápido. No es realmente práctico dibujar estructuras 3D completas para moléculas más grandes y complejas. Una habilidad importante que necesitará dominar son las formas en que las estructuras de mano corta (como las estructuras de Lewis) pueden proporcionar información sobre la estructura 3D de una molécula que nos permite predecir propiedades químicas y físicas.
Hay una representación más que a menudo verás usada que deja fuera aún más información. ¡En la estructura lineal las únicas cosas que se muestran son los enlaces entre los carbonos! Entonces, por ejemplo, para los pentanos (\(\mathrm{C}_{5}\mathrm{H}_{12}\)) podemos dibujar estructuras como las que se muestran en la figura que omiten todos los símbolos para los átomos y todos los\(\mathrm{C–H}\) enlaces. Estas estructuras deben usarse con precaución porque es muy fácil olvidar átomos o enlaces cuando no están en la representación. Pero lo que estas estructuras de líneas sí muestran claramente es cómo están conectados los átomos de carbono, lo que a veces puede ser muy útil.
Preguntas para responder
- ¿Para cuántos compuestos diferentes puedes dibujar\(\mathrm{C}_{6}\mathrm{H}_{14}\)? Dibuja la estructura completa de Lewis, la fórmula condensada y la fórmula de línea.
- ¿Cuáles son las ventajas y desventajas de cada tipo de estructura?
Preguntas para más tarde:
- Cuando piensas en rotar alrededor de un\(\mathrm{C–C}\) enlace (digamos en etano), hay orientaciones cada vez menos estables. ¿Qué orientación crees que es la más estable y por qué?
- Ahora imagina una molécula de butano (\(\mathrm{C}_{4}\mathrm{H}_{10}\)) mirando a lo largo del\(\mathrm{C}_{2-3}\) enlace. Se vería un grupo metilo y dos átomos de hidrógeno unidos a los dos átomos de carbono. ¿Cómo influiría eso en la rotación alrededor del\(\mathrm{C–C}\) vínculo que hemos estado considerando?


