7.2: Reacciones ácido-base: una guía para principiantes
- Page ID
- 76713
Comencemos con la reacción de cloruro de hidrógeno y agua del último capítulo, una reacción clásica ácido-base. Para entender cómo se relacionan este tipo de reacciones, necesitamos aprender a identificar sus componentes esenciales y comunes. Nuestro primer obstáculo es el hecho de que los términos ácido y acidez, y en menor medida, bases y basicidad, han entrado en el lenguaje de la vida cotidiana. La mayoría de las personas tienen alguna noción de ácidos y acidez. Ejemplos de uso común incluyen: lluvia ácida, ácido estomacal, reflujo ácido, lengua ácida, etc. Es posible que escuches a alguien hablar de vino que sabe ácido, por lo que probablemente significan agrio, y la mayoría de la gente asiente con la cabeza en comprensión. El vino viejo sabe a vinagre porque contiene ácido acético. Probablemente también hayas oído hablar o incluso hayas aprendido sobre medidas de acidez que implican\(\mathrm{pH}\), pero ¿qué es\(\mathrm{pH}\) exactamente? ¿Qué es un ácido y por qué querrías neutralizarlo? ¿Las cosas ácidas son malas? ¿Necesitamos evitarlos a toda costa y bajo cualquier circunstancia? Aunque el término base es menos común, es posible que ya estés familiarizado con materiales que son básicos en el sentido químico. Las bases a menudo se llaman álcalis, como en las baterías alcalinas y los metales alcalinos. Son resbaladizos al tacto, de sabor amargo.
No es sorprendente que a lo largo de los años se hayan desarrollado muchas definiciones de reacciones ácido-base. Cada nueva definición ha sido consistente, es decir, produce conclusiones similares cuando se aplica a un sistema particular, a los que han venido antes, pero cada nueva definición también ha promovido la evolución de la idea de ácidos y bases. Las definiciones posteriores abarcan ideas originales sobre ácidos y bases, pero también las amplían y las hacen más aplicables, cubriendo una gran variedad de reacciones con características similares. Comenzaremos con el modelo más simple de ácidos y bases: el modelo Arrhenius. [3] Esta es la introducción más común a la química ácido-base; quizás ya te hayan enseñado este modelo. Aunque el modelo Arrhenius es de utilidad limitada, examinaremos su estructura simple como base para modelos más sofisticados y útiles. Nuestra consideración modelo por modelo debería ayudarlo a apreciar cómo la química ácido-base se ha vuelto cada vez más general y poderosa con el tiempo. A medida que avanzamos, tenga en cuenta esta regla simple: Todas las reacciones ácido-base comienzan y terminan con moléculas polarizadas. A medida que avanzamos por los diversos modelos de reacciones ácido-base, vea si puede identificar los grupos polares y cómo interactúan entre sí.
Ácidos y Bases de Arrhenius
En el modelo Arrhenius, un ácido se define como un compuesto que se disocia cuando se disuelve en agua para producir un protón (\(\mathrm{H}^{+}\)) y un ion cargado negativamente (un anión). De hecho, los protones desnudos (\(\mathrm{H}^{+}\)) no deambulan en solución. Siempre se asocian con al menos una, y más probablemente múltiples, moléculas de agua. [4] Generalmente, los químicos utilizan una taquigrafía para esta situación, ya sea refiriéndose al\(\mathrm{H}^{+}\) en solución acuosa como un ion hidronio (denotado como\(\mathrm{H}_{3}\mathrm{O}^{+}\)) o incluso más simplemente como\(\mathrm{H}^{+}\), pero no se olvide, esta es una mano corta. Un ejemplo de una reacción ácida de Arrhenius es:\[\mathrm{HCl}(g)+\mathrm{H}_{2} \mathrm{O} \rightleftarrows \mathrm{H}_{3} \mathrm{O}^{+}(aq)+\mathrm{Cl}^{-}(aq)\]
o, más simplemente (y más fiel a la teoría original):\[\mathrm{HCl}(g) \rightleftarrows \mathrm{H}^{+}(aq)+\mathrm{Cl}^{-}(aq) \text { or } \mathrm{HCl}(aq)\]
Pero esta es realmente una forma bastante extraña de presentar la situación real, porque la\(\mathrm{HCl}\) molécula no interactúa con una sola molécula de agua, sino que interactúa con el agua como solvente. Cuando el gas cloruro de hidrógeno (\(\mathrm{HCl}\)) se disuelve en agua, se disocia en\(\mathrm{H}^{+}(aq)\) y\(\mathrm{Cl}^{-}(aq)\) casi por completo. Para todos los efectos, no hay\(\mathrm{HCl}\) moléculas en la solución. Una solución acuosa de\(\mathrm{HCl}\) se conoce como ácido clorhídrico, que la distingue del gas, cloruro de hidrógeno. Esta disociación completa es una característica de los ácidos fuertes, ¡pero no todos los ácidos son fuertes!
Una base de Arrhenius se define como un compuesto que genera iones hidróxido (\(–\mathrm{OH}\)) cuando se disuelve en agua. Los ejemplos más comunes de bases de Arrhenius son los hidróxidos del Grupo I (metal alcalino), como el hidróxido de sodio:\[\mathrm{NaOH}(s)+\mathrm{H}_{2} \mathrm{O} \rightleftarrows \mathrm{Na}^{+}(aq)+{ }^{-} \mathrm{OH}(aq) \text { or } \mathrm{NaOH}(aq)\]
Nuevamente, este es un sistema de reacción que involucra tanto\(\mathrm{NaOH}\) al agua líquida como al agua. El proceso de formación de una solución de hidróxido de sodio es igual que el involucrado en la interacción entre el cloruro de sodio (\(\mathrm{NaCl}\)) y el agua: los iones (\(\mathrm{Na}^{+}\)y\({}^{-}\mathrm{OH}\)) se separan y son solvatados (rodeados) por las moléculas de agua.
Como veremos en breve, algunos ácidos (y bases) no se ionizan completamente; algunas de las moléculas de ácido permanecen intactas cuando se disuelven en agua. Cuando esto ocurre utilizamos flechas de doble punta\(\rightleftarrows\) para indicar que la reacción es reversible, y tanto los reactivos como los productos están presentes en la misma mezcla de reacción. Tendremos mucho más que decir sobre la duración y dirección de una reacción en el próximo capítulo. Por ahora, basta con entender que las reacciones ácido-base (de hecho, todas las reacciones) son reversibles a nivel molecular. En el caso de los ácidos y bases simples de Arrhenius, sin embargo, podemos suponer que la reacción procede casi exclusivamente a la derecha.
Una reacción ácido-base de Arrhenius ocurre cuando se mezclan un ácido disuelto (acuoso) y una base disuelta (acuosa). El producto de tal reacción suele decirse que es una sal más agua y la reacción a menudo se denomina reacción de neutralización: el ácido neutraliza la base, y viceversa. La ecuación se puede escribir así:\[\mathrm{HCl}(aq)+\mathrm{NaOH}(aq) \rightleftarrows \mathrm{H}_{2} \mathrm{O}(l)+\mathrm{NaCl}(aq)\]
Cuando la reacción está escrita en esta forma molecular es bastante difícil ver lo que realmente está sucediendo. Si reescribimos la ecuación para mostrar todas las especies involucradas, y asumimos que el número de\(\mathrm{NaOH}\) moléculas\(\mathrm{HCl}\) y son iguales, obtenemos:\[\mathrm{H}^{+}(aq)+\mathrm{Cl}^{-}(aq)+\mathrm{Na}^{+}(aq)+-\mathrm{OH}(aq) \rightleftarrows \mathrm{H}_{2} \mathrm{O}(l)+\mathrm{Na}^{+}(aq)+\mathrm{Cl}^{-}(aq)\]
\(\mathrm{Na}^{+}(aq)\)y\(\mathrm{Cl}^{-}(aq)\) aparecen en ambos lados de la ecuación; no cambian y no reaccionan (a menudo se les llama iones espectadores porque no participan en la reacción). La única reacción real que ocurre es la formación de agua:\[\mathrm{H}^{+}(aq)+{ }^{-} \mathrm{OH}(aq) \rightleftarrows \mathrm{H}_{2} \mathrm{O}(l)\]
La formación de agua (no la formación de una sal) es la firma de una reacción ácido-base de Arrhenius. Una serie de ácidos fuertes comunes, incluyendo ácido clorhídrico (\(\mathrm{HCl}\)), ácido sulfúrico (\(\mathrm{H}_{2}\mathrm{SO}_{2}\)) y ácido nítrico (\(\mathrm{HNO}_{2}\)), reaccionan con una base fuerte como\(\mathrm{NaOH}\) o\(\mathrm{KOH}\) (que, como los ácidos fuertes, se disocian completamente en agua) para producir agua.
Tales reacciones ácido-base son siempre exotérmicas y podemos medir el cambio de temperatura y calcular el cambio de entalpía correspondiente (\(\Delta \mathrm{H}\)) para la reacción. Independientemente del ácido fuerte o base fuerte que elijas, el cambio de entalpía es siempre el mismo (aproximadamente\(58 \mathrm{~kJ/mol}\) de\(\mathrm{H}_{2}\mathrm{O}\) producido). Esto se debe a que la única reacción neta consistente que tiene lugar en una solución de un ácido fuerte y una base fuerte es:\[\mathrm{H}^{+}(aq)+-\mathrm{OH}(aq) \rightleftarrows \mathrm{H}_{2} \mathrm{O}(l)\]
Otro factor a tener en cuenta es que la reacción global implica que se forma un nuevo enlace entre el protón (\(\mathrm{H}^{+}\)) y el oxígeno del hidróxido (\({}^{-}\mathrm{OH}\).) Tiene sentido que algo con una carga positiva se sienta atraído por (y se une con) una especie cargada negativamente (aunque debe recordar por qué el\(\mathrm{Na}^{+}\) y\(\mathrm{Cl}^{-}\) no se combinan para formar cloruro de sodio sólido en solución acuosa). El hecho de que los enlaces se formen o no depende de la naturaleza exacta del sistema, y de los cambios de entalpía y entropía asociados con el cambio. Volveremos a esta idea más adelante en el capítulo\(8\).
Preguntas para responder
- ¿Cuál sería la reacción si se\(\mathrm{KOH}\) mezclaran cantidades iguales de equimolar\(\mathrm{HNO}_{3}\) y?
- ¿Qué tal cantidades iguales de equimolar\(\mathrm{H}_{2}\mathrm{SO}_{4}\) y\(\mathrm{KOH}\)? ¿Cuáles serían los productos?
- ¿Qué tal cantidades iguales de equimolar\(\mathrm{H}_{3}\mathrm{PO}_{4}\) y\(\mathrm{KOH}\)?
- ¿Cuántos moles de\(\mathrm{NaOH}\) serían necesarios para reaccionar completamente con un mol de\(\mathrm{H}_{3}\mathrm{PO}_{4}\)?
- Dibujar una imagen a nivel molecular de la reacción ácido-base de Arrhenius.
Brønsted—Lowry [5] Ácidos y bases
El modelo ácido-base de Arrhenius es bastante fácil de entender, pero su aplicación se limita a ciertos tipos de reacciones. En lugar de continuar por este camino, los químicos encontraron que necesitaban expandir su modelo de ácidos y bases y cómo reaccionan. La primera de estas expansiones fue el modelo Brønsted—Lowry. En el modelo Brønsted—Lowry, un ácido se caracteriza como donante de protones (\(\mathrm{H}^{+}\)) y una base como aceptor de protones. Si revisamos las reacciones que vimos anteriormente en el contexto del modelo ácido-base de Brønsted-Lowry, vemos que\(\mathrm{HCl}\) es el donante de protones; regala\(\mathrm{H}^{+}\) y el agua es el aceptor de protones. En este esquema,\(\mathrm{HCl}\) es el ácido y el agua es la base:\[\mathrm{HCl}(g)+ \mathrm{H}_{2} \mathrm{O}(l) \rightleftarrows \mathrm{H}_{3} \mathrm{O}^{+}(aq)+\mathrm{Cl}^{-}(aq)\]
\(\mathrm{HCl} = \)\(\mathrm{H}_{2} \mathrm{O} = \)base\(\mathrm{H}_{3} \mathrm{O}^{+} = \) conjugada ácida base\(\mathrm{Cl}^{-} = \) conjugada ácida
Las especies resultantes se denominan ácido conjugado (así\(\mathrm{H}_{3} \mathrm{O}^{+}\) es el ácido conjugado de\(\mathrm{H}_{2} \mathrm{O}\) y la base conjugada (\(\mathrm{Cl}^{-}\)es la base conjugada de\(\mathrm{HCl}\)). Esto se debe a que\(\mathrm{H}_{3} \mathrm{O}^{+}\) puede y generalmente lo hace donar su\(\mathrm{H}^{+}\) a otra molécula (la mayoría de las veces otra molécula de agua) y\(\mathrm{Cl}^{-}\) puede aceptar una\(\mathrm{H}^{+}\).
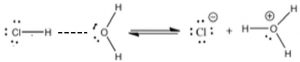
Una diferencia importante (e importante) entre los modelos de base ácida de Brønsted-Lowry y Arrhenius es que un ácido de Brønsted-Lowry siempre debe tener una base acompañante para reaccionar; los dos son inseparables. Un donante de protones debe tener algo para donar los protones a (una base) —en este caso, agua. Recuerde que la ruptura de enlaces requiere energía, mientras que la formación de enlaces libera energía. Siempre se requiere algún aporte de energía para una reacción en la que lo único que sucede es la ruptura de un enlace (por ejemplo, el\(\mathrm{Cl–H}\) enlace en\(\mathrm{HCl}\)). Las reacciones ácido-base son típicamente exotérmicas; liberan energía al entorno y la energía liberada se asocia con la interacción entre la base\(\mathrm{H}^{+}\) y la base. Es decir, el protón no cae del ácido y luego se une con la base. En cambio, el\(\mathrm{–H}\) enlace ácido comienza a romperse a medida que comienza a formarse el enlace base—H. Una forma en que podemos visualizar este proceso es extraer las estructuras de Lewis de las moléculas involucradas y ver cómo se transfiere el protón.
Como se muestra en la figura, utilizamos una línea punteada para mostrar la creciente atracción entre la carga positiva parcial en la\(\mathrm{H}\) de la\(\mathrm{H—Cl}\) molécula y la carga negativa parcial sobre el oxígeno. Esta interacción da como resultado la desestabilización del\(\mathrm{H—Cl}\) vínculo. Debido a que el\(\mathrm{Cl}\) es más electronegativo que el\(\mathrm{H}\), los electrones del\(\mathrm{H—Cl}\) enlace original permanecen con el\(\mathrm{Cl}\) (que se convierte\(\mathrm{Cl}^{-}\)) y el\(\mathrm{H}^{+}\) forma un nuevo enlace con una molécula de agua. Esencialmente, una reacción de base ácida de Brønsted—Lowry implica la transferencia de un protón de un ácido a una base, dejando atrás los electrones de unión originales.
Otro ejemplo de una reacción ácido-base es la reacción del amoníaco con agua:\[\mathrm{NH}_{3}(aq)+\mathrm{H}_{2} \mathrm{O}(l) \rightleftarrows \mathrm{NH}_{4}^{+}(aq)+{}^{-} \mathrm{OH}(aq)\]
\(\mathrm{NH}_{3} = \)conjugado de\(\mathrm{H}_{2} \mathrm{O} = \) ácido base\(\mathrm{NH}_{4} = \) conjugado de ácido\({}^{-} \mathrm{OH} = \) base

En este caso, el oxígeno es más electronegativo que el nitrógeno. El protón se transfiere del oxígeno al nitrógeno. Nuevamente, la línea punteada en la figura representa el enlace en desarrollo entre el hidrógeno y el nitrógeno. A medida que el\(\mathrm{H—O}\) enlace se rompe, se forma un nuevo\(\mathrm{H—N}\) enlace, haciendo que la\(\mathrm{NH}_{4} {}^{+}\) molécula resultante se cargue positivamente. Los electrones asociados con el\(\mathrm{H—O}\) enlace original son retenidos por el\(\mathrm{O}\), haciéndolo cargado negativamente. Entonces, ¡el agua es el ácido y el amoníaco es la base! Una diferencia importante entre esta y la\(\mathrm{HCl–H}_{2}\mathrm{O}\) reacción anterior es que\(\mathrm{H}_{2}\mathrm{O}\) es un ácido mucho más débil de lo que es\(\mathrm{HCl}\). En solución acuosa, no todos los\(\mathrm{NH}_{3}\) reaccionan con\(\mathrm{H}_{2}\mathrm{O}\) para formar\(\mathrm{NH}_{4} {}^{+}\). Además, la reacción entre\(\mathrm{NH}_{3}\) y agua es reversible, como lo indica el\(\rightleftarrows\) símbolo. En el siguiente capítulo se considerará hasta qué punto una reacción procede hasta su conclusión. Quizás te estés preguntando por qué el agua no actúa como base en la reacción con\(\mathrm{NH}_{3}\), como lo hace con\(\mathrm{HCl}\). Si extraes los productos resultantes de una transferencia de protones de nitrógeno a oxígeno, verás que este proceso da como resultado una mezcla de productos donde el átomo más electronegativo (\(\mathrm{O}\)) tiene ahora una carga positiva, y el átomo menos electronegativo (\(\mathrm{N}\)) tiene una carga negativa. No tiene sentido que el átomo más electronegativo acabe con una carga positiva, y de hecho este proceso no ocurre (en ningún grado medible).
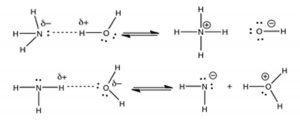
Pronto volveremos a una discusión de lo que hace que un compuesto sea ácido y/o básico. Por el momento, tenemos dos reacciones ácido-base: una en la que el agua es el ácido y la otra en la que el agua es la base. ¿Cómo puede ser esto? ¿Cómo puede una molécula de agua ser tanto un ácido como una base, aparentemente al mismo tiempo? Es posible debido a la estructura única de la molécula de agua. De hecho, el agua reacciona consigo misma, con una molécula actuando como ácido y otra como base:\[\mathrm{H}_{2} \mathrm{O}(l)+\mathrm{H}_{2} \mathrm{O}(l) \rightleftarrows \mathrm{H}_{3} \mathrm{O}^{+}(aq)+{ }^{-} \mathrm{OH}(aq)\]
\(\mathrm{H}_{2} \mathrm{O} = \)\(\mathrm{H}_{2} \mathrm{O} = \)base\(\mathrm{H}_{3} \mathrm{O}^{+} = \) conjugada ácida base\({}^{-} \mathrm{OH} = \) conjugada ácida
Como se muestra en la figura, podemos visualizar nuevamente este proceso dibujando las estructuras de Lewis de las moléculas de agua para ver cómo el protón es capaz de moverse de una molécula de agua a otra, para que nunca esté “solo” y siempre interactuando con los pares solitarios sobre los oxígenos.
Preguntas para reflexionar
- Entre el modelo Arrhenius y el modelo Brønsted—Lowry de ácidos y base, ¿cuál es más útil? ¿Por qué?
Preguntas para responder
- ¿Cuál crees que es más probable que suceda? ¿La reacción\(\mathrm{H}_{2} \mathrm{O} + \mathrm{H}_{2} \mathrm{O} \rightarrow \mathrm{H}_{3} \mathrm{O}^{+} + { }^{-} \mathrm{OH}\)? ¿O el proceso inverso\(\mathrm{H}_{3} \mathrm{O}^{+} + { }^{-} \mathrm{OH} \rightarrow \mathrm{H}_{2} \mathrm{O} + \mathrm{H}_{2} \mathrm{O}\)? ¿Podrían ocurrir ambos a la vez?
- ¿Cuáles crees que las cantidades relativas de\(\mathrm{H}_{2} \mathrm{O}\),\(\mathrm{H}_{3} \mathrm{O}^{+} + { }^{-} \mathrm{OH}\) podrían estar en una muestra pura de agua líquida? ¿Cómo medirías los montos relativos?
- Ahora que sabes que\(\mathrm{HCl}\) es un ácido y el amoníaco es una base, ¿puedes predecir la reacción que ocurre entre ellos?
- ¿Es el agua un componente necesario de una reacción ácido-base de Brønsted—Lowry? ¿Qué tal para una reacción ácido-base de Arrhenius?
Cómo detectar un ácido
Pasando del agua, ¿podemos predecir si un compuesto será un ácido, una base o ninguno? Hemos aprendido que podemos predecir muchas propiedades de los materiales considerando su estructura molecular. Cuando los ácidos se escriben en su forma simplificada (por ejemplo\(\mathrm{HNO}_{3}\) o\(\mathrm{H}_{2}\mathrm{SO}_{4}\)) puede ser muy difícil ver alguna similitud, pero si sacamos las estructuras de Lewis surgen algunos puntos en común. Echemos un vistazo a las estructuras de Lewis para varios ácidos fuertes, como el ácido clorhídrico\(\mathrm{HCl}(aq)\), el ácido\(\mathrm{HNO}_{3}(aq)\) nítrico y el ácido sulfúrico\(\mathrm{H}_{2}\mathrm{SO}_{4}(aq)\). [6] ¿Qué característica estructural tienen en común estas sustancias? Bueno, por sus fórmulas es claro que todas contienen hidrógeno, pero hay muchos compuestos que contienen hidrógeno que no son ácidos. Por ejemplo, el metano (\(\mathrm{CH}_{4}\)) y otros hidrocarburos no son ácidos; no donan protones a otras moléculas.
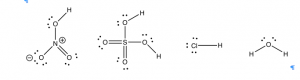
Una característica común de los ácidos es que el protón que se dona (o se recoge) está unido a un átomo altamente electronegativo. Este átomo suele ser un oxígeno o un halógeno como cloro (\(\mathrm{Cl}\)), bromo (\(\mathrm{Br}\)) o yodo (\(\mathrm{I}\)). Una vez que sabes qué buscar, es bastante fácil detectar los sitios potencialmente ácidos en una molécula. Por ejemplo, en la figura anterior, podrías rodear los hidrógenos “vulnerables”. La capacidad de detectar hidrógenos donables es una habilidad útil que le permite predecir propiedades de moléculas más complejas. Pero, ¿por qué un hidrógeno que está unido covalentemente a un elemento electronegativo es potencialmente ácido y donable?
Primero, consideremos el\(\mathrm{O—H}\) vínculo. Con base en nuestra discusión sobre las moléculas de agua, podemos predecir que está polarizada, con una carga positiva parcial en la H y una negativa parcial en la\(\mathrm{O}\). En el agua, el\(\mathrm{H}\) es (en promedio) también parte de una interacción de enlaces de hidrógeno con el oxígeno de otra molécula de agua. Resulta que no se necesita mucha energía para romper el\(\mathrm{O—H}\) vínculo original. Recuerda que\(\mathrm{H}^{+}\) no solo “deja caer” el ácido, sino que al mismo tiempo forma un enlace con la molécula base. De hecho, las reacciones ácido-base fuertes son típicamente exotérmicas, lo que significa que el nuevo enlace formado entre el protón (\(\mathrm{H}^{+}\)) y la base es más fuerte que el enlace que se rompió para liberar el\(\mathrm{H}^{+}\). La energía liberada eleva la temperatura de los alrededores. En una solución acuosa de un ácido fuerte, los iones de hidrógeno se mueven rápida y aleatoriamente de un oxígeno a otro. La energía para toda esta ruptura de uniones proviene del movimiento térmico de las moléculas de agua.
También debemos considerar qué pasa con el oxígeno que queda atrás. Cuando se transfiere el hidrógeno ácido, deja atrás los electrones que estaban en el enlace, dando a ese átomo más electrones de los que comenzó con. Las especies dejadas atrás deben ser estables incluso con esos electrones adicionales (la carga negativa). En el siguiente ejemplo, el ion cloruro\(\mathrm{Cl}^{-}(aq)\) se deja atrás cuando el protón se transfiere lejos. Sabemos que el cloruro es estable y común. No es de extrañar que sea uno de los productos de la reacción. \[\mathrm{HCl}(g)+\mathrm{H}_{2} \mathrm{O}(l) \rightleftarrows \mathrm{H}_{3} \mathrm{O}^{+}(aq) +\mathrm{Cl}^{-}(aq)\]
\(\mathrm{HCl} = \)\(\mathrm{H}_{2} \mathrm{O} = \)base\(\mathrm{H}_{3} \mathrm{O}^{+} = \) conjugada ácida base\(\mathrm{Cl}^{-} = \) conjugada ácida
Si recuerdas, la electronegatividad es una medida de la capacidad de atraer (y retener) electrones. [7] Por lo tanto, tiene sentido que un átomo electronegativo cargado negativamente (como el cloro u oxígeno) sea más estable que un átomo cargado negativamente, menos electronegativo (como el carbono).
Preguntas para responder
- ¿Qué otros átomos además del cloro u oxígeno son suficientemente electronegativos para estabilizar esos electrones adicionales?
- Dibujar las reacciones de cada uno de los ácidos fuertes con agua: (\(\mathrm{HCl} (aq)\)), ácido nítrico (\(\mathrm{HNO}_{3} (aq)\)), ácido sulfúrico (\(\mathrm{H}_{2}\mathrm{SO}_{4} (aq)\)), bromuro de hidrógeno (\(\mathrm{HBr} (aq)\)) y yoduro de hidrógeno (\(\mathrm{HI} (aq)\)). ¿Cuáles son los puntos en común? ¿Cuáles son las diferencias?
- Dibujar las estructuras de metanol (\(\mathrm{CH}_{3}\mathrm{OH}\)), ácido acético (\(\mathrm{CH}_{3}\mathrm{COOH}\)) y metano (\(\mathrm{CH}_{4}\)) y escribir una reacción potencial con agua. Marque los pares de ácido-base conjugados.
- ¿Qué reacciones cree que es probable que se produzcan? ¿Por qué?
Preguntas para más tarde
- ¿Qué otros métodos (además de tener un átomo fuertemente electronegativo) podrían estar disponibles para estabilizar los electrones (recordemos que un modelo de enlace permite orbitales moleculares que se extienden sobre más de dos átomos)? Volveremos a esta idea más adelante.
Ácidos y bases fuertes, débiles, concentrados y diluidos
Puede resultar muy confuso cuando las palabras tienen un significado diferente en el contexto científico que en la vida cotidiana. Las palabras que usamos para describir soluciones de ácidos y bases caen dentro de esta categoría de definiciones fácilmente mezcladas. Usamos el término fuerte para referirnos a ácidos que se ionizan completamente en agua, y débiles para aquellos ácidos que solo están parcialmente ionizados (ver Capítulo\(8\) para más información sobre por qué). Fuertes y débiles se utilizan para describir una propiedad intrínseca del ácido o base. Los términos diluidos y concentrados se utilizan para describir la concentración del ácido en el agua. Podríamos tener una solución diluida (digamos\(0.1 \mathrm{~M}\)) del ácido fuerte ácido clorhídrico, o una solución concentrada (digamos\(10 \mathrm{~M}\)) del ácido acético débil. Por el contrario, cuando nos referimos a líquidos fuertes versus débiles en el sentido cotidiano, nos estamos refiriendo a la concentración de la solución. Por ejemplo, si dices, “Este té es muy débil” o “me gusta mi café fuerte” lo que realmente estás diciendo que te gusta mucho té o café disuelto en la solución que estás bebiendo. Es importante recordar esta diferencia y entender que el contexto científico puede cambiar el significado de palabras familiares.
Preguntas para responder
- Dibuje imágenes a nivel molecular de una solución diluida de un ácido fuerte y un ácido débil.
- Dibuje imágenes a nivel molecular de una solución concentrada de un ácido fuerte y un ácido débil.
- ¿Cuáles son las similitudes y diferencias entre todas las representaciones que has dibujado?
- Considera lo que has aprendido sobre los cambios energéticos asociados a la reacción de un ácido fuerte con el agua. Desde el punto de vista de la seguridad, ¿cuál de las siguientes acciones tiene más sentido a la hora de diluir una solución concentrada de un ácido fuerte con agua? ¿Por qué?
- A. Añadir agua lentamente (gota a gota) al ácido fuerte concentrado o
- B. Añadir el ácido fuerte concentrado gota a gota al agua
Factores que afectan la fuerza ácida
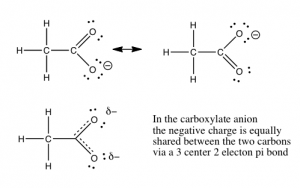
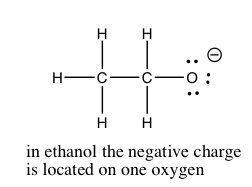
En Capítulo\(8\), discutiremos la cuantificación de la fuerza ácida y base. Primero echemos un vistazo a los factores que podrían afectar la fuerza de un ácido. Como ya hemos visto, la capacidad de la base conjugada para aferrarse a (estabilizar) el par de electrones es crucial. Hay varias formas de lograr esto. Lo más simple es que el ácido\(\mathrm{H}\) está unido a un átomo electronegativo como\(\mathrm{O}\),\(\mathrm{N}\), o un halógeno. Existe una amplia gama de acidedades para oxiácidos. Las diferencias en la acidez están determinadas por el número de lugares disponibles para que la densidad extra de electrones sea estabilizada. La figura ilustra un ejemplo bastante simple de esto en la diferencia entre etanol (\(\mathrm{CH}_{3}\mathrm{CH}_{2}\mathrm{OH}\)) y ácido acético (\(\mathrm{CH}_{3}\mathrm{COOH}\)). El ácido acético es aproximadamente 10 mil millones de veces más ácido que el etanol, debido a que la base conjugada (acetato) es capaz de estabilizar la carga negativa en dos oxígenos en lugar de solo uno. Esta “dispersión” de la carga disminuye las repulsiones electrón-electrón, y estabiliza la estructura más que si la carga negativa estuviera localizada en un solo oxígeno. Si extraes las estructuras de Lewis de los oxiácidos inorgánicos fuertes comunes (e.g.\(\mathrm{HNO}_{3}\) o\(\mathrm{H}_{2}\mathrm{SO}_{4}\)), verás que es posible deslocalizar la carga negativa del anión correspondiente en más de un oxígeno.
Cómo detectar una base

Existe un método igualmente sencillo para averiguar qué compuestos son bases potenciales. Echemos un vistazo a algunas bases comunes. Las primeras bases con las que se encuentra la mayoría de la gente son los hidróxidos metálicos como\(\mathrm{NaOH}\),\(\mathrm{KOH}\), y\(\mathrm{Mg}(\mathrm{OH})_{2}\). Los iones metálicos se generan cuando estos compuestos se disuelven en agua, pero normalmente no desempeñan ningún papel en las reacciones ácido-base. [8] La base en estos compuestos es el hidróxido (\({}^{-}\mathrm{OH}\)). Otra clase común de bases son las moléculas que contienen nitrógeno, como\(\mathrm{NH}_{3}\). Existen muchos tipos de bases nitrogenadas, algunas de las cuales juegan un papel crítico en los sistemas biológicos. Por ejemplo, las bases en los ácidos nucleicos (\(\mathrm{DNA}\)y\(\mathrm{RNA}\)) son básicas porque contienen nitrógeno. No olvidemos que el agua también es básica y puede aceptar un protón.

Entonces, ¿cuál es la característica estructural común en las bases? Bueno, si un ácido es la especie con un protón para donar, entonces la base debe poder aceptar un protón. Esto significa que la base debe tener algún lugar para que el protón se una, debe contener un par de electrones no unidos (solitarios) para que el protón interactúe y se una. Si miramos nuestros ejemplos hasta el momento, encontramos que todas las bases tienen el par de electrones no enlazados necesario. Las bases más comunes tienen un oxígeno o un nitrógeno (con pares solitarios de electrones) que actúan como centro básico. Una vez que aprendas a detectar el centro básico, puedes predecir el resultado de una amplia gama de reacciones en lugar de simplemente memorizarlas. A menudo ocurre que si se pueden identificar los sitios ácidos y básicos en los materiales de partida, se puede predecir el producto e ignorar el resto de la molécula.
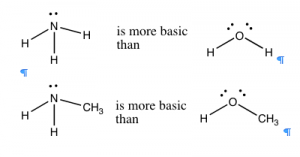
En general, el nitrógeno es un mejor aceptor de protones que el oxígeno, porque es más básico. El amoníaco (\(\mathrm{NH}_{3}\)) es más básico que el agua (\(\mathrm{H}_{2}\mathrm{O}\)), y los compuestos orgánicos con nitrógeno en ellos suelen ser más básicos que los compuestos correspondientes que contienen oxígenos estructuralmente análogos (\(\rightarrow\)). Si comparamos la tendencia en basicidad para una gama de compuestos simples a través de la tabla periódica, vemos que la basicidad disminuye de\(\mathrm{NH}_{3} > \mathrm{~H}_{2}\mathrm{O} > \mathrm{~HF}\). Este efecto es paralelo al aumento de la electronegatividad a lo largo de la fila. La capacidad de un par de electrones para unirse y aceptar un protón depende de cuán fuertemente ese par de electrones esté retenido por el átomo donante. En el flúor, el átomo más electronegativo, los electrones se mantienen tan apretados y tan cerca del núcleo del átomo que no están disponibles para unirse con un protón. El oxígeno se aferra a sus pares de electrones con un poco menos de fuerza, por lo que es más probable que el flúor done un par solitario a un protón. El nitrógeno, sin embargo, es aún menos electronegativo y por lo tanto tiene un par solitario más disponible, haciendo que la mayoría de los compuestos de nitrógeno sean básicos. [9]
Preguntas para responder
- ¿Por qué no incluimos\(\mathrm{CH}_{4}\) ni neón en este análisis?
- ¿Crees que los compuestos con amonio (\(\mathrm{NH}_{4} {}^{+}\)) son básicos? ¿Por qué o por qué no?
- ¿Se puede dibujar la estructura de un compuesto básico que aún no ha sido mencionado en el texto?
- Extraer las reacciones de\(\mathrm{CH}_{3}\mathrm{NH}_{2}\) y\(\mathrm{CH}_{3}\mathrm{OH}\) con el agua. Marcar los pares de ácido y base conjugados. ¿Qué reacción es más probable que ocurra? ¿Por qué?
- ¿Cómo diseñarías un experimento para averiguar si un compuesto es un ácido o una base (o ambos)? ¿Qué pruebas experimentales aceptarías para determinar si tenías un ácido o una base o ambos?


