7.3: Reacciones ácido-Base de Lewis
- Page ID
- 76724
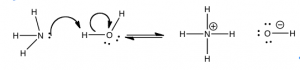
Aunque los químicos utilizan el modelo Brønsted—Lowry para cualquier reacción en la que un protón se transfiere de un átomo a otro, existe un modelo aún más amplio. El modelo de Lewis incorpora reacciones donde no hay transferencia de protones. En lugar de ver la reacción como una transferencia de protones, podemos mirarla desde el punto de vista del par de electrones que eventualmente se convierte en parte del nuevo enlace. Es decir: podemos considerar una reacción ácido-base como la donación de un par de electrones (a partir de una base) para formar un enlace entre el átomo donante y el protón (o el ácido). Entonces, en lugar de decir que el agua transfiere un protón a amoníaco, el modelo de Lewis vería el proceso como amoníaco donando un par de electrones solitario para formar un nuevo enlace con un protón de una molécula de agua. Este proceso da como resultado la transferencia de un hidrógeno del agua a la molécula de amoníaco (un evento de formación de enlaces, como se muestra en la figura). Los electrones que originalmente estaban unidos al hidrógeno no desaparecen. Más bien, se dejan atrás en el oxígeno, lo que lleva a la generación de un ion hidróxido (\(–\mathrm{OH}\)). El modelo ácido-base de Lewis nos permite considerar reacciones en las que no hay hidrógeno transferido, sino donde hay un par solitario de electrones que pueden formar un nuevo enlace.
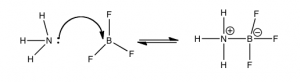
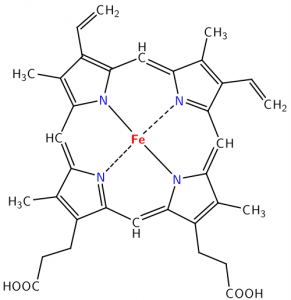
Esta figura muestra un ejemplo del modelo ácido-base de Lewis en la reacción entre trifluoruro de boro (\(\mathrm{BF}_{3}\)) y amoníaco (\(\mathrm{NH}_{3}\)). En este caso, la base es el donador de pares de electrones y el ácido es el aceptor de pares de electrones. El par de electrones solitarios de\(\mathrm{NH}_{3}\) se dona al boro, que tiene un orbital de unión vacío que acepta el par de electrones, formando un enlace entre el\(\mathrm{N}\) y el\(\mathrm{B}\). A pesar de que usamos el término “donar”, el par de electrones no sale de la\(\mathrm{NH}_{3}\) molécula; cambia de un par no enlazante a un par de electrones de unión. \(\mathrm{BF}_{3}\)es un ácido de Lewis, pero tenga en cuenta que no tiene que\(\mathrm{H}\) donar. Representa una nueva clase de ácidos: los ácidos de Lewis. Entre ellos se encuentran sustancias como\(\mathrm{BF}_{3}\) o\(\mathrm{AlCl}_{3}\), compuestos de la tabla periódica de átomos del Grupo III, que tienen sólo seis electrones en sus orbitales de enlace. Esta deficiencia de electrones deja vacíos, orbitales energéticamente accesibles abiertos para aceptar un par de electrones de la base de Lewis, el donante del par de electrones. Otros ejemplos de ácidos de Lewis son iones metálicos\(\mathrm{Fe}^{2+}\), como\(\mathrm{Fe}^{3+}\),\(\mathrm{Mg}^{2+}\), y\(\mathrm{Zn}^{2+}\). Todos estos elementos juegan un papel crítico en los sistemas biológicos a través de su comportamiento como ácidos de Lewis. Un ejemplo importante es el grupo hemo de la hemoglobina. En el centro de este grupo se encuentra un átomo de hierro (\(\mathrm{Fe}\)) cargado positivamente. Dichos iones cargados positivamente (cationes) tienen orbitales vacíos que pueden interactuar con los electrones de pares solitarios de las bases de Lewis y formar complejos ácido-base de Lewis. En el caso de la hemoglobina, las bases de Lewis (\(\mathrm{O}_{2}\)\(\mathrm{CO}_{2}\),, y\(\mathrm{CO}\)) interactúan con Fe para mover oxígeno al cuerpo desde los pulmones y pasar\(\mathrm{CO}_{2}\) del cuerpo a los pulmones. Se necesita un poco de práctica para ganar confianza en el reconocimiento de reacciones ácido-base de Lewis, pero esta habilidad puede ayudarnos a comprender muchos sistemas biológicos y químicos.
Si miramos hacia atrás las teorías ácido-base sobre los ácidos, vemos que las teorías se vuelven cada vez más complejas a medida que cada teoría posterior subsume la anterior y amplía el rango de reacciones que se pueden explicar. Ni las teorías de Arrhenius ni Brønsted—Lowry explican por qué el hierro en los complejos hemo y el oxígeno forman el sistema de transporte de oxígeno en nuestros cuerpos. El modelo ácido-base de Lewis, por otro lado, puede ayudar a explicar esto así como la simple reacción entre\(\mathrm{HCl}\) y\(\mathrm{NaOH}\) (dónde\({}^{-}\mathrm{OH}\) está la base de Lewis y\(\mathrm{H}^{+}\) es el ácido de Lewis).
Preguntas para responder
- Para la reacción:\(\mathrm{HCl}(g)+\mathrm{H}_{2} \mathrm{O}(l) \rightarrow \mathrm{H}_{3} \mathrm{O}^{+}(aq)+\mathrm{Cl}^{-}(aq)\), escribir (en palabras e imágenes a nivel molecular) lo que está sucediendo durante la reacción en términos de:
- Teoría ácido-base de Arrhenius
- Teoría del ácido-base de Bronsted—Lowry
- Teoría ácido-base de Lewis
- Ahora haz la misma actividad para la reacción de\(\mathrm{NH}_{3}\) y\(\mathrm{HCl}\).
- Ahora haz la misma actividad para la reacción de\(\mathrm{R}_{2}\mathrm{NH}\) y\(\mathrm{AlCl}_{3}\).
- ¿Por qué crees que utilizamos diferentes modelos de reacciones ácido-base?
- ¿Se puede describir lo que dictaría el uso de un modelo en particular?


