7.4: Nucleófilos y Electrófilos
- Page ID
- 76701
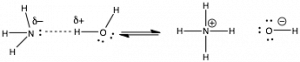
El modelo ácido-base de Lewis es más inclusivo que el modelo Brønsted—Lowry, pero a menudo usamos el modelo Brønsted—Lowry porque es más fácil seguir la transferencia de protones de una molécula (el ácido) a otra (la base). En soluciones acuosas, la teoría de Brønsted-Lowry también nos permite utilizar el concepto de\(\mathrm{pH}\) para cuantificar la acidez (como veremos en breve). Tanto los modelos Lewis como Brønsted—Lowry capturan el principio general de que la mayoría de las reacciones químicas se inician por una interacción electrostática entre una porción cargada positivamente de una molécula y una porción cargada negativamente de la misma u otra molécula. [10] Como veremos en el siguiente capítulo, las moléculas deben chocar entre sí para que se produzcan reacciones entre ellas, no reaccionan a distancia. Cuando las partículas reaccionantes chocan, tiene que haber alguna vía continua a través de la cual los enlaces se reordenan y producen productos. El primer paso en esta vía a menudo implica interacciones coulómbicas (electrostáticas) entre regiones específicas de las moléculas involucradas. Por supuesto, que tales interacciones coulómbicas sean estables o no depende de las energías cinéticas de las moléculas colisionantes y exactamente de cómo chocan entre sí. Los catalizadores a menudo aceleran las reacciones controlando cómo las moléculas chocan o interactúan entre sí. Esta figura (\(\rightarrow\)) muestra la reacción de\(\mathrm{H}_{2}\mathrm{O}\) y\(\mathrm{NH}_{3}\), en la que el extremo positivo de una molécula interactúa con el extremo negativo de la otra. Si consideramos esto como una reacción ácido-base de Lewis, el mismo principio es cierto. Resulta que podemos considerar de manera rentable una amplia gama de reacciones utilizando el principio de atracción coulómbica. Por ejemplo, el amoníaco (y otros compuestos nitrogenados) pueden reaccionar con moléculas que contienen carbono si se cumplen las condiciones apropiadas.
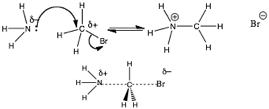
En la figura (\(\rightarrow\)) el nitrógeno se está comportando como una base de Lewis, donando su par solitario de electrones al carbono. Sin embargo, es un poco más difícil ver la analogía con un ácido de Lewis en el sitio de carbono. Lo que podemos ver es que hay un grupo electronegativo, polarizador (en este caso un átomo de bromo) unido al carbono. La presencia de un átomo de bromo polariza el\(\mathrm{C—Br}\) enlace, dando al carbono una ligera carga positiva. Esto hace que el carbono sea susceptible al ataque del par solitario del nitrógeno. Dado que el carbono no tiene un orbital vacío en el que aceptar al par solitario, y el carbono nunca puede formar más de cuatro enlaces, algo tiene que dar. Lo que da es el\(\mathrm{C—Br}\) enlace, que se rompe, y el bromo se lleva los electrones del enlace con él, produciendo un ion bromuro,\(\mathrm{Br}^{-}\).
Este tipo de reacción, si bien es esencialmente una reacción ácido-base de Lewis, generalmente se describe usando otro conjunto de términos, probablemente porque estas reacciones suelen pertenecer al ámbito de la química orgánica, que alguna vez fue considerada una disciplina química distinta. Para los químicos orgánicos, la especie con la pareja solitaria (en este caso la\(\mathrm{NH}_{3}\)) se llama nucleófila (literalmente, “amante del núcleo”) y se siente atraída por un centro de carga positivo. La especie que acepta el par solitario de electrones, en este caso la\(\mathrm{CH}_{3}\mathrm{Br}\) molécula, se llama el electrófilo (literalmente, “amante de los electrones”). La especie que se libera de su enlace con el carbono se llama grupo saliente. Los grupos de salida deben ser relativamente electronegativos (como en el caso de\(\mathrm{Br}\)) o estables cuando se asocian con un par extra de electrones. Entonces, los buenos grupos de salida son bases débiles. Las bases conjugadas de ácidos fuertes son excelentes grupos salientes porque son estables.
Si analizamos más a fondo la reacción en la figura, vemos al nucleófilo de nitrógeno acercándose al electrófilo de carbono: a medida que se forma el enlace entre el\(\mathrm{C}\) y\(\mathrm{N}\), el enlace se rompe entre el\(\mathrm{C}\) y el\(\mathrm{Br}\). La rotura de la unión y la formación de la unión ocurren simultáneamente. Dado lo que sabemos sobre el agua y las soluciones acuosas, incluso podríamos ser tan valientes como para predecir que el producto (\({}^{+}\mathrm{NH}_{3}\mathrm{CH}_{3} \mathrm{~Br}^{-}\)) perderá rápidamente un protón en solución acuosa para producir\(\mathrm{CH}_{3}—\mathrm{NH}_{2}\) y\(\mathrm{H}_{3}\mathrm{O}^{+}\). Este tipo de reacción a menudo se conoce como metilación (un\(-\mathrm{CH}_{3}\) grupo es un grupo metilo). El producto es un\(\mathrm{N}\) derivado metilado del amoníaco.
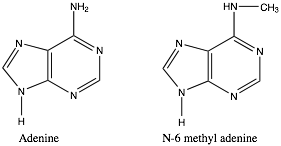
Como ya hemos visto, los compuestos nitrogenados son comunes en los sistemas biológicos. Ahora vemos cómo estos compuestos también pueden actuar como nucleófilos, y cómo la metilación del nitrógeno es una ocurrencia bastante común con una gama de efectos. Por ejemplo, la metilación y desmetilación de las bases nitrogenadas en\(\mathrm{DNA}\) adenina y citosina se utiliza para influir en la expresión génica y marcar cadenas recién sintetizadas a partir de\(\mathrm{DNA}\) cadenas más antiguas y preexistentes\(\mathrm{DNA}\). Al mismo tiempo, varias secuencias metiladas (como CpG) son mucho menos estables que la forma no metilada, y por lo tanto es más probable que muten. [11] Las reacciones de metilación también son bastante comunes en otras reacciones biológicas. Por ejemplo, la epinefrina (también conocida como adrenalina, la hormona de lucha o huida) se sintetiza en el cuerpo por metilación de la molécula relacionada norepinefrina.
Considerando las reacciones ácido-base:\(\mathrm{pH}\)
Es casi seguro que has escuchado el término\(\mathrm{pH}\), es otro de esos términos científicos que lo han convertido en la vida cotidiana, sin embargo su significado científico no es del todo obvio. Por ejemplo: ¿por qué un aumento en\(\mathrm{pH}\) corresponde a una disminución de la “acidez” y por qué\(\mathrm{pH}\) cambia con la temperatura? [12] ¿Cómo le damos sentido\(\mathrm{pH}\) y usamos esa información para comprender mejor los sistemas químicos?

La idea clave subyacente\(\mathrm{pH}\) es que el agua sufre una reacción ácido-base consigo misma. Recordemos que esta reacción implica la transferencia de un protón de una molécula de agua a otra. El protón nunca está libre ni “solo”; siempre está unido a un oxígeno dentro de otra molécula de agua. Otro punto importante al respecto\(\mathrm{pH}\) es que la reacción es fácilmente reversible. En condiciones normales (temperatura ambiente), la reacción procede en ambas direcciones. Si miramos la reacción, tiene sentido intuitivo que los reactivos de la derecha (\(\mathrm{H}_{3}\mathrm{O}^{+}\)y\({}^{-}\mathrm{OH}\)) puedan reaccionar juntos para dar dos\(\mathrm{H}_{2}\mathrm{O}\) moléculas simplemente por la interacción de las cargas positivas y negativas, y ya hemos visto que la reacción hacia adelante sí ocurre. Este es uno de los primeros ejemplos que hemos visto de una reacción que va tanto hacia adelante como hacia atrás en un mismo sistema. Como veremos, todas las reacciones son reversibles a nanoescala (consideraremos las implicaciones de este hecho en detalle en el próximo capítulo). En cualquier muestra de agua pura, hay tres especies moleculares diferentes: moléculas de agua (\(\mathrm{H}_{2}\mathrm{O}\)), iones hidronio (\(\mathrm{H}_{3}\mathrm{O}^{+}\)) e iones hidróxido (\({}^{-}\mathrm{OH}\)), como se muestra en la figura (\(\rightarrow\)). Estas tres especies interactúan constantemente entre sí a través de la formación de interacciones\(\mathrm{H}\) relativamente débiles, que se forman y rompen constantemente. Recuerde, en el agua líquida, las moléculas de agua están constantemente en movimiento y colisionando entre sí. Algunas de estas colisiones tienen suficiente energía para romper el\(\mathrm{H—O}\) enlace covalente en el agua o en el ion hidronio. El resultado es la transferencia\(\mathrm{H}^{+}\) y formación de un nuevo enlace con otra molécula de agua (para formar ion hidronio) o con un ion hidróxido (para formar una molécula de agua). Para tener una idea de lo dinámico que es este proceso, se estima que la vida útil promedio de un ión hidronio individual es del orden de 1 a 2 picosegundos (\(1 \times 10^{-12} \mathrm{~ps}\)), un periodo de tiempo inimaginablemente corto. En agua pura, a\(25 { }^{\circ}\mathrm{C}\), la concentración promedio de iones hidronio es\(1 \times 10^{-7} \mathrm{~mol/L}\). Usamos corchetes para indicar la concentración, así que escribimos esto como:\[\left[\mathrm{H}_{3} \mathrm{O}^{+}\right]=1 \times 10^{-7} \mathrm{~M}\]
Tenga en cuenta que esta es una fracción muy, muy, muy pequeña del total de moléculas de agua, dado que la concentración de moléculas de agua\(\left[\mathrm{H}_{2}\mathrm{O}\right]\) en el agua pura es\(\sim 55.4 \mathrm{~M}\).
En agua pura, cada vez que se produce un ion hidronio, también se debe formar un ion hidróxido. Por lo tanto, en agua pura en\(25 { }^{\circ}\mathrm{C}\), la siguiente ecuación debe ser cierta:\[\left[\mathrm{H}_{3} \mathrm{O}^{+}\right]=\left[{}^{-}\mathrm{OH}\right]=1 \times 10^{-7} \mathrm{~M}\]
También debe ser cierto que el producto de las concentraciones de iones hidronio e hidróxido,\(\left[\mathrm{H}_{3} \mathrm{O}^{+}\right]\left[{}^{-}\mathrm{OH}\right]\), es una constante a una temperatura particular. Esta constante es propiedad del agua. En\(25 { }^{\circ}\mathrm{C}\), esta constante es\(1 \times 10^{–14}\) y se le da el símbolo\(\mathrm{K}_{\mathrm{w}}\),\(25 { }^{\circ}\mathrm{C}\). Entonces, ¿por qué nos importa? Porque cuando añadimos un ácido o una base a una solución de agua en\(25 { }^{\circ}\mathrm{C}\), el producto de\(\left[\mathrm{H}_{3} \mathrm{O}^{+}\right]\left[{}^{-}\mathrm{OH}\right]\) sigue siendo el mismo:\(1 \times 10^{–14}\). Podemos usar este hecho para comprender mejor el comportamiento de ácidos, bases y soluciones acuosas.
Para muchas personas, tratar con exponentes negativos no es algo natural. Sus implicaciones y manipulaciones pueden ser difíciles. Lo creas o no, la\(\mathrm{pH}\) escala [13] fue diseñada para facilitar el trato con exponentes, pero sí requiere que entiendas cómo trabajar con logaritmos (quizás una tarea igualmente difícil). \(\mathrm{pH}\)se define como:\(\mathrm{pH} = -\log \left[\mathrm{H}_{3} \mathrm{O}^{+}\right]\). [14]
En agua pura (at\(25 { }^{\circ}\mathrm{C}\)), donde el\(\left[\mathrm{H}_{3}\mathrm{O}^{+}\right] = 1 \times 10^{-7} \mathrm{~M}\),\(\mathrm{pH} = 7\) (no\(\mathrm{pH}\) tiene unidades). Una solución con una mayor concentración de iones hidronio que el agua pura es ácida, y una solución con una mayor concentración de iones hidroxilo es básica. Esto lleva al hecho contrario a la intuición de que a medida que\(\left[\mathrm{H}_{3}\mathrm{O}^{+}\right]\) sube la acidez,\(\mathrm{pH}\) baja. Compruébalo tú mismo: calcula el\(\mathrm{pH}\) de una solución con un\(\left[\mathrm{H}_{3}\mathrm{O}^{+}\right]\) de\(1 \times 10^{-2} \mathrm{~M}\) (\(\mathrm{pH} = 2\)), y de\(1 \times 10^{-9} \mathrm{~M}\) (\(\mathrm{pH} = 9\)). Además, por ser logarítmico, un cambio de una unidad en\(\mathrm{pH}\) corresponde a un cambio en\(\left[\mathrm{H}_{3}\mathrm{O}^{+}\right]\) de un factor de\(10\).
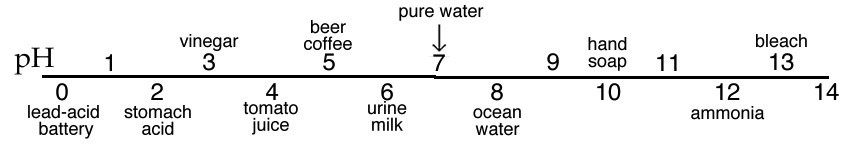
La\(\mathrm{pH}\) escala se considera comúnmente como unidades de expansión\(1–14\), pero de hecho muchas de las soluciones ácidas más fuertes tienen\(\mathrm{pH} < 1\). Las representaciones de la\(\mathrm{pH}\) escala suelen utilizar colores para indicar el cambio en\(\mathrm{pH}\). Esta convención se usa porque hay muchos compuestos que cambian de color dependiendo\(\left[\mathrm{H}_{3}\mathrm{O}^{+}\right]\) de la solución en la que se disuelven. Por ejemplo, el tornasol [15] es rojo cuando se disuelve en una solución ácida (\(\mathrm{pH} < 7\)), y azul cuando se disuelve en una solución básica (\(\mathrm{pH} > 7\)). Quizás te hayas dado cuenta de que cuando agregas jugo de limón (ácido) al té, el color cambia. No te confundas: las soluciones de ácidos y bases no difieren intrínsecamente en términos de color. El cambio de color depende de la naturaleza de las moléculas disueltas en la solución. Piense en cómo los cambios en\(\mathrm{pH}\) podrían afectar la estructura molecular y, por extensión, las interacciones entre las moléculas y la luz (un tema que se trata más extensamente en el suplemento de espectroscopia).
Es importante señalar que al valor\(37 { }^{\circ}\mathrm{C}\) de\(\mathrm{K}_{\mathrm{w}}\) es diferente:\(\left[\mathrm{H}_{3} \mathrm{O}^{+}\right]\left[{}^{-}\mathrm{OH}\right] = 2.5 \times 10^{-14}\) y por lo tanto el\(\mathrm{pH} = 6.8\). De manera extraña, esto no quiere decir que la solución sea ácida, ya que\(\left[\mathrm{H}_{3} \mathrm{O}^{+}\right] = \left[{}^{-}\mathrm{OH}\right]\). El efecto es pequeño, pero significativo; significa que un\(\mathrm{pH}\) of\(7\) no siempre significa que una solución sea neutra (depende de la temperatura). Esto es particularmente importante cuando el concepto de\(\mathrm{pH}\) se aplica a sistemas fisiológicos, ya que el cuerpo no suele estar a temperatura ambiente.
Ahora consideremos qué sucede cuando agregamos un ácido Brønsted—Lowry al agua.

Por ejemplo, si preparamos una solución de\(0.10 \mathrm{~M HCl}\) (donde disolvemos\(0.10 \mathrm{~mol HCl}(g)\) en suficiente agua para hacer 1 litro de solución), la reacción que resulta (ver figura) contiene más ion hidronio (\(\mathrm{H}_{3}\mathrm{O}^{+}\)). Ahora si medimos [16] la\(\mathrm{pH}\) de la solución de\(0.10 \mathrm{~M HCl}\), nos encontramos con que se trata de\(1.0 \mathrm{~pH}\) unidades. Si volvemos a convertir a unidades de concentración de\(\mathrm{pH}\) (si\(\mathrm{pH} = –\log \left[\mathrm{H}_{3} \mathrm{O}^{+}\right]\), entonces\(\left[\mathrm{H}_{3} \mathrm{O}^{+}\right] = 10^{-\mathrm{pH}}\)), encontramos que la concentración de\(\mathrm{H}_{3}\mathrm{O}^{+}\) in\(0.10 \mathrm{~M HCl}\) es\(0.10 \mathrm{~M}\). Esto tiene sentido, a la luz de nuestra discusión previa sobre cómo se disocia\(\mathrm{HCl}\) completamente en\(\mathrm{Cl}^{-}\) y\(\mathrm{H}^{+}\) (asociado con las moléculas de agua).
| \([\mathrm{HCl}] \mathrm{~M}\) | \(\left[\mathrm{H}_{2}\mathrm{O}\right] \mathrm{~M}\) | \(\left[\mathrm{H}_{3}\mathrm{O}^{+}\right] \mathrm{~M}\) | \([\mathrm{OH}] \mathrm{~M}\) | \(\left[\mathrm{Cl}^{-}\right] \mathrm{~M}\) | |
| Antes de la reacción | \(0.10\) | \(\sim 55.5\) | \(1.0 \times 10^{-7}\) | \(1.0 \times 10^{-7}\) | 0 |
| Después de la reacción | \(\sim 0\) | \(\sim 55.4\) | \(\sim 1.0 \times 10^{-1}\) | \(1.0 \times 10^{-13}\) | \(1.0 \times 10^{-1}\) |
Esta tabla da las concentraciones de todas las especies presentes tanto antes como después de la reacción. Hay varias cosas que notar sobre esta tabla. Debido a que el medido\(\mathrm{pH} = 1\) y añadimos\(0.1 \mathrm{~M}\) (o\(10^{-1} \mathrm{~M}\))\(\mathrm{HCl}\), es razonable suponer que todos los\(\mathrm{HCl}\) disociados y que la gran mayoría de los\(\mathrm{H}_{3}\mathrm{O}^{+}\) provenían de la\(\mathrm{HCl}\). Podemos ignorar el\(\mathrm{H}_{3}\mathrm{O}^{+}\) presente inicialmente en el agua. ¿Por qué? Debido a que era seis órdenes de magnitud\((0.0000001)(10^{-7})\) menor que el\(\mathrm{H}^{+}\) derivado de la\(\mathrm{HCl}\) (\(10^{-1}\)). Es raro ver\(\mathrm{pH}\) mediciones con más de tres cifras significativas, por lo que la\(\mathrm{H}_{3}\mathrm{O}^{+}\) originalmente presente en el agua no tiene un efecto significativo sobre el\(\mathrm{pH}\) valor medido. Aunque generalmente no nos preocupa la cantidad de hidróxido, vale la pena señalar que\(\left[\mathrm{H}_{3} \mathrm{O}^{+}\right]\left[{}^{-}\mathrm{OH}\right]\) sigue siendo una constante (\(\mathrm{K}_{\mathrm{w}}\)), y por lo tanto cuando\(\left[\mathrm{H}_{3} \mathrm{O}^{+}\right]\) aumenta las\(\left[{}^{-}\mathrm{OH}\right]\) disminuciones.
Aunque una serie de sustancias se disuelven en el agua, no todas se ionizan, y no todas las sustancias que ionizan alteran la\(\mathrm{pH}\). Por ejemplo, se\(\mathrm{NaCl}\) ioniza completamente cuando se disuelve en agua, sin embargo el\(\mathrm{pH}\) de esta solución está quieto\(7\). Los\(\mathrm{Cl}^{-}\) iones\(\mathrm{Na}^{+}\) y no afectan\(\mathrm{pH}\) al en absoluto. No obstante, si hacemos una\(1 \mathrm{~M}\) solución de cloruro amónico (\(\mathrm{NH}_{4}\mathrm{Cl}\)), encontramos que su\(\mathrm{pH}\) está alrededor\(5\). Aunque podría no ser completamente obvio por qué es el\(\mathrm{pH}\) de esta solución\(5\) y el\(\mathrm{pH}\) de una\(1\mathrm{M NaCl}\) solución es\(7\), una vez que sabes que es (y dado lo que sabes sobre\(\mathrm{pH}\)), puedes determinar las concentraciones de\(\mathrm{H}_{3}\mathrm{O}^{+}\),\(\mathrm{NH}_{4} {}^{+}\),\(\mathrm{NH}_{3}\) ,\(–\mathrm{OH}\) y\(\mathrm{Cl}^{-}\) presente (ver Capítulo\(8\)). La pregunta es: ¿Por qué son\(\mathrm{NH}_{4}\mathrm{Cl}\) y\(\mathrm{HCl}\) tan diferentes? (Consideramos este punto en el Capítulo\(9\).)
Dar sentido al vinagre y otros ácidos
Ahora consideremos otro ácido común: el ácido acético. Si el vino se deja abierto al aire, a menudo comenzará a tener un sabor agrio porque el etanol en el vino reacciona con el oxígeno en el aire y forma ácido acético. El ácido acético pertenece a una familia de compuestos orgánicos conocidos como ácidos carboxílicos. Tiene un protón ácido unido al oxígeno.

Si medimos el\(\mathrm{pH}\) de una\(0.10-\mathrm{M}\) solución de ácido acético, encontramos que se trata\(2.8\). La pregunta obvia es ¿por qué el\(\mathrm{pH}\) de una\(0.10-\mathrm{M}\) solución de ácido acético es diferente al\(\mathrm{pH}\) de una\(0.10-\mathrm{M}\) solución de ácido clorhídrico? La explicación radica en el hecho de que el ácido acético (\(\mathrm{CH}_{3}\mathrm{COOH}\)) no se disocia completamente en\(\mathrm{CH}_{3}\mathrm{CO}_{2} {}^{-}\) y\(\mathrm{H}_{3}\mathrm{O}^{+}\) cuando se disuelve en agua. A\(\mathrm{pH}\) de\(2.8\) indica que el\(\left[\mathrm{H}_{3}\mathrm{O}^{+}\right] = 10^{-2.8}\). Este número se puede convertir en\(1.6 \times 10^{–3} \mathrm{~M}\). Acerca\(1.6 \%\) del ácido acético agregado se ioniza (una forma conocida como ion acetato,\(\mathrm{CH}_{3}\mathrm{COO}^{-}\)). El resto está en forma protonada (ácido acético,\(\mathrm{CH}_{3}\mathrm{COOH}\)). Las moléculas específicas que están ionizadas cambian todo el tiempo; los protones se transfieren constantemente de un oxígeno a otro. Se puede pensar en este proceso de otra manera: es el sistema el que tiene una\(\mathrm{pH}\), no moléculas individuales. Si miramos una sola molécula de ácido acético en la solución, encontramos que está ionizada\(1.6 \%\) de la época. Esto puede parecer una forma extraña de pensar sobre el sistema, pero recuerde, muchos sistemas biológicos (como las bacterias) son bastante pequeños, con un volumen de solo unas pocas micras cúbicas o micrómetros (una micra cúbica es un cubo\(10^{–6} \mathrm{~m}\) en un lado) y pueden contener un número bastante pequeño de cualquier tipo de molécula. Así, en lugar de pensar en el comportamiento masivo de estas moléculas, que son relativamente pocas, puede ser más útil pensar en el comportamiento de moléculas individuales promediadas a lo largo del tiempo. Nuevamente, en una solución acuosa de moléculas de ácido acético, la mayoría de las moléculas (\(\sim 98.4 \%\)) están en la forma no ionizada, por lo que cualquier molécula particularmente está no ionizada\(\sim 98.4 \%\) por ciento del tiempo.
Podemos medir la\(\mathrm{pH}\) de las soluciones de muchos ácidos de concentraciones conocidas, y a partir de estas mediciones hacer estimaciones de la fuerza del ácido. Los ácidos fuertes, como el nítrico, el sulfúrico y el clorhídrico, están totalmente ionizados en solución. Los ácidos más débiles, como los ácidos orgánicos, se ionizan en mucho menor grado. Sin embargo, dadas las bajas concentraciones naturales de iones hidronio e hidróxido en agua pura, incluso los ácidos débiles pueden alterar significativamente el\(\mathrm{pH}\) de una solución acuosa. El mismo comportamiento se aplica a las bases débiles.
Por el contrario, si los ácidos o bases débiles se disuelven en soluciones de diferentes\(\mathrm{pH}\), la cantidad de ionización del grupo puede cambiar significativamente. Por ejemplo, como veremos en capítulos\(8\) y\(9\), si añadimos un ácido débil a una solución que era básica (por ejemplo en\(\mathrm{pH} 9\)), encontraríamos que mucha más del ácido se ionizará. Muchas moléculas biológicas contienen partes (llamadas grupos funcionales) que se comportan como ácidos débiles o bases débiles. Por lo tanto, el\(\mathrm{pH}\) de la solución en la que se encuentran estas moléculas influye en la medida en que estos grupos funcionales se ionizan. Si una parte de una molécula grande está ionizada o no puede influir dramáticamente en el comportamiento, la estructura y las interacciones de una biomolécula con otras moléculas. Así, los cambios en\(\mathrm{pH}\) pueden tener efectos dramáticos en un sistema biológico. Por ejemplo, si el\(\mathrm{pH}\) de tu sangre cambia por\(\pm 0.3 \mathrm{~pH}\) unidades, es probable que mueras. Los sistemas biológicos gastan gran parte de la energía que utilizan manteniendo una constante\(\mathrm{pH}\) (típicamente alrededor\(7.35 - 7.45\)). [17] Además, el\(\mathrm{pH}\) interior de tus células está estrechamente regulado y puede influir en el comportamiento celular. [18]
Preguntas para responder
- ¿Cómo calcularías la molaridad del agua pura?
- ¿En qué porcentaje de moléculas de agua están ionizadas\(25 { }^{\circ}\mathrm{C}\)?
- Si el\(\mathrm{pH}\) de una solución (at\(25 { }^{\circ}\mathrm{C}\)) es\(2.0\), ¿cuál es el\(\left[\mathrm{H}_{3} \mathrm{O}^{+}\right]\)? ¿Cuál es el\(\left[{}^{-}\mathrm{OH}\right]\)?
- Si el\(\mathrm{pH}\) de una solución (at\(37 { }^{\circ}\mathrm{C}\)) es\(2.0\), ¿cuál es el\(\left[\mathrm{H}_{3} \mathrm{O}^{+}\right]\)? ¿Cuál es el\(\left[{}^{-}\mathrm{OH}\right]\)?
- ¿Cuál sería el\(\mathrm{pH}\) de una\(0.01-\mathrm{M}\) solución de\(\mathrm{HCl}\) al\(25 { }^{\circ}\mathrm{C}\)?
- Si el\(\mathrm{pH}\) de una\(0.1-\mathrm{M}\) solución de\(\mathrm{NH}_{4}\mathrm{Cl}\) es\(5.1\), ¿cuál es el\(\left[\mathrm{H}_{3} \mathrm{O}^{+}\right]\)?
- Dibuja una imagen a nivel molecular de lo que imaginas soluciones\(\mathrm{NaCl}\) y\(\mathrm{NH}_{4}\mathrm{Cl}\) aspecto.
- ¿Por qué el ácido acético solo tiene un protón ácido (después de todo, tiene un total de cuatro protones)?
- ¿Por qué el ácido acético es más ácido que el etanol? ¿Qué tiene la estructura del ácido acético que lo hace más ácido?
Preguntas para más tarde
- ¿Por qué cree que seguimos especificando la temperatura en nuestras discusiones de reacciones?
Preguntas para reflexionar
- Los grupos de ácido carboxílico\(–\mathrm{COOH}\),, son comunes en biomoléculas grandes. ¿Cuál sería el efecto de subir o bajar\(\mathrm{pH}\) las cadenas laterales de carboxilato?
- ¿Qué efecto crees que podría tener en las propiedades de la biomolécula (solubilidad, interacciones con otras moléculas, etc.)?
- Los grupos amino también son comunes. ¿Cuál sería el efecto de elevar o bajar el\(\mathrm{pH}\) sobre un grupo amino?


