7.6: Cambios Energéticos y Reacciones Químicas
- Page ID
- 76700
Todas las reacciones químicas van acompañadas de cambios energéticos. En la mayoría de las circunstancias, particularmente cuando la presión y el volumen se mantienen constantes, estos cambios pueden atribuirse a cambios en la entalpía\(\Delta \mathrm{H}\). Por ejemplo, las reacciones de combustión (reacciones redox que involucran oxígeno) son una fuente importante de energía para la mayoría de los organismos. En los organismos de sangre caliente, la energía liberada a través de tales reacciones se utiliza para mantener una temperatura corporal establecida. Dentro de los organismos, las reacciones de combustión ocurren en etapas altamente controladas (razón por la cual no estalla en llamas), a través del proceso conocido como respiración (diferente a la respiración, aunque la respiración es necesaria para llevar oxígeno molecular a tus células).
No todas las formas biológicas de respiración utilizan oxígeno molecular. [23] Hay otras moléculas que sirven para aceptar electrones; este proceso se conoce como respiración anaeróbica (libre de aire). Todos los organismos conocidos utilizan la molécula adenosina trifosfato (\(\mathrm{ATP}\)) como un lugar conveniente para almacenar energía. \(\mathrm{ATP}\)se sintetiza a partir de adenosina difosfato (\(\mathrm{ADP}\)) y fosfato inorgánico. Como dos especies separadas,\(\mathrm{ADP}\) y el fosfato inorgánico son más estables que\(\mathrm{ATP}\) y la energía capturada del uso ambiental para impulsar la síntesis de\(\mathrm{ATP}\) puede ser liberada nuevamente a través de la formación de\(\mathrm{ADP}\) fosfato inorgánico:\[\mathrm{ADP}+\mathrm{Pi}+\text { energy } \rightleftarrows \mathrm{ATP }+\mathrm{H}_{2} \mathrm{O}\]
Si observáramos de cerca el mecanismo de\(\mathrm{ATP}\) síntesis a nivel molecular, veríamos que es otro ejemplo de una interacción electrófilo-nucleófila. Pero independientemente del tipo de reacciones, podemos hacer la misma pregunta: ¿De dónde (en última instancia) proviene la energía liberada en una reacción exotérmica? Cuando se produce una reacción exotérmica y se transfiere energía del sistema al entorno, el resultado es un aumento de temperatura en el entorno y un cambio negativo de entalpía)\(–\Delta \mathrm{H}\). ¿Cuál es la fuente de esa energía? Por supuesto, ya sabes la respuesta, ¡tiene que ser la energía liberada cuando se forma un vínculo!
El rasgo definitorio de una reacción química es un cambio en la identidad química de los reactivos: se producen nuevos tipos de moléculas. Para que esto ocurra, al menos algunos de los enlaces en el material de partida deben romperse y deben formarse nuevos enlaces en los productos, de lo contrario no ocurre reacción alguna. Entonces, para analizar los cambios energéticos en las reacciones químicas, observamos qué enlaces se rompen y cuáles se forman, para luego comparar sus energías. Como discutiremos más adelante, el proceso no es tan sencillo, dado que la vía para la reacción puede incluir intermedios de mayor energía. Como veremos es la vía de una reacción la que determina su velocidad (qué tan rápido ocurre), mientras que la diferencia entre productos y reacciones determina el grado en que ocurrirá la reacción. El siguiente análisis conducirá a algunas aproximaciones razonables para estimar los cambios de energía durante una reacción.
Como ya hemos visto, la formación de enlaces libera energía y la ruptura del enlace requiere energía. Las tablas de energías de disociación de enlaces se encuentran en la mayoría de los libros de química y se pueden recuperar fácilmente de Internet. [24] Una advertencia: estas mediciones se toman típicamente en fase gaseosa y se refieren a un proceso donde el enlace se rompe homolíticamente (cada átomo en el enlace original termina con un electrón y las especies formadas se conocen como radicales). [25] La energía de disociación del enlace para el hidrógeno es la energía requerida para impulsar el proceso:\[\mathrm{H}-\mathrm{H}(g) \rightleftarrows 2 \mathrm{H}\cdot\]
donde el punto representa un electrón desapareado. El cambio de entalpía para este proceso es\(\Delta \mathrm{H} = +436 \mathrm{~kJ/mol}\). Tenga en cuenta que las tablas de energías de enlace registran la energía requerida para romper el vínculo. Como señalamos anteriormente, la entalpía es una función de estado — su valor no depende del camino tomado para que ocurra el cambio, por lo que también sabemos cuál es el cambio de entalpía para el proceso inverso. Es decir, cuando una molécula de hidrógeno se forma a partir de dos átomos de hidrógeno, el proceso es exotérmico:\[2 \mathrm{H} \cdot \rightleftarrows \mathrm{H}-\mathrm{H}(g) \quad \Delta \mathrm{H}=-436 \mathrm{~kJ} / \mathrm{mol}\]
Tenemos tablas de valores de energía de enlace para la mayoría de los tipos de enlaces comunes, por lo que una forma de averiguar los cambios de energía (o al menos los cambios de entalpía) para una reacción en particular es analizar la reacción en términos de qué enlaces se rompen y qué enlaces se forman. Los enlaces rotos contribuyen con un término positivo al cambio total de energía de reacción, mientras que la formación de enlaces contribuye con un término negativo. Por ejemplo, echemos un vistazo más de cerca a la combustión del metano: [26]\[\mathrm{CH}_{4}(g)+2 \mathrm{O}_{2}(g) \rightleftarrows \mathrm{CO}_{2}(g)+2 \mathrm{H}_{2} \mathrm{O}(g)\]
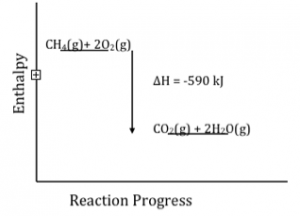
En el transcurso de esta reacción, se rompen cuatro\(\mathrm{C}—\mathrm{H}\)\(\mathrm{O=O}\) enlaces\(\left[4 \times \mathrm{C}—\mathrm{H } (436 \mathrm{~kJ/mol})\right]\) y dos enlaces (\(498 \mathrm{~kJ/mol}\)). Los nuevos lazos formados son\(2 \times \mathrm{C=O} (803 \mathrm{~kJ/mol})\) y\(4 \times \mathrm{O—H} (460 \mathrm{~kJ/mol})\). Si haces las cuentas, encontrarás que la suma de las energías de enlace rotas es\(2740 \mathrm{~kJ}\), mientras que la suma de las energías de enlace formadas es\(–3330 \mathrm{~kJ}\). En otras palabras, los enlaces en los productos son\(706 \mathrm{~kJ}\) más estables que los enlaces en los reactivos. Esto es más fácil de ver si trazamos el progreso de la entalpía versus la reacción; se vuelve más obvio que los productos son más bajos en energía (más estables).
Hay varios aspectos importantes a tener en cuenta sobre este análisis:
- Esto es solo una estimación del cambio de entalpía, ya que (como se señaló anteriormente) las energías de enlace son promedios y se miden en fase gaseosa. En el mundo real, la mayoría de las reacciones no ocurren en la fase gaseosa. En las soluciones, hay todo tipo de otras interacciones (fuerzas intermoleculares) que pueden afectar el cambio de entalpía, pero para una aproximación inicial este método suele dar resultados sorprendentemente buenos.
- Recuerde, toda reacción debe ser considerada como parte del sistema. Tanto los reactivos como los productos tienen que ser incluidos en cualquier análisis, así como la dirección de transferencia de energía entre el sistema de reacción y el entorno.
- Una reacción exotérmica ocurre cuando los enlaces formados son más fuertes que los enlaces que se rompen. Si observamos de cerca este cálculo, podemos ver que las reacciones de combustión son tan exotérmicas porque producen dióxido de carbono. La energía de enlace del doble enlace carbono-oxígeno es muy alta (aunque no dos veces la del enlace\(\mathrm{C}—\mathrm{O}\) simple, ¿puedes pensar por qué?) La producción de\(\mathrm{CO}_{2}\) es muy favorable desde el punto de vista energético: se asienta en un pozo energético profundo porque tiene vínculos tan fuertes. Este punto tiene importantes ramificaciones para el mundo en el que vivimos. El dióxido de carbono es bastante estable; aunque puede hacerse reaccionar, tales reacciones requieren el aporte de energía. Un gran número de nosotros expulsamos a la\(\mathrm{CO}_{2}\) atmósfera quemando combustibles fósiles y respirando, a un ritmo mayor que el que actualmente se está eliminando a través de diversos tipos de procesos de secuestro, incluyendo reacciones químicas y fotosíntesis. Ciertamente has oído hablar del efecto invernadero, causado por la acumulación de\(\mathrm{CO}_{2}\). \(\mathrm{CO}_{2}\)es difícil deshacerse de él porque fuertes lazos le dan estabilidad. (Dada la notoriedad de\(\mathrm{CO}_{2}\) en términos de cambio climático, volveremos a este tema más adelante.)
Preguntas para responder
- Muchos textos de biología se refieren a que la energía se libera cuando\(\mathrm{ATP}\) se rompen los enlaces de alta energía. A la luz de lo que sabe, ¿es ésta una declaración razonable? ¿Qué significan realmente estos textos?
- ¿Por qué cree que el cambio de entalpía para la mayoría de las reacciones ácido-base de Brønsted—Lowry es independiente de la naturaleza del ácido o la base? (Pista: ¿Cuál es la reacción que realmente está ocurriendo?)
- Usando tablas de energías de disociación de enlaces, calcular el cambio de energía para la reacción de\(\mathrm{CH}_{2}\mathrm{=CH}_{2}+\mathrm{HCl} \rightleftarrows \mathrm{CH}_{3} \mathrm{CH}_{2} \mathrm{Cl}\). ¿Qué pasos tienes que tomar para completar este cálculo? Hacer una lista.
- Si buscas el cambio de entalpía para esta reacción (\(\Delta \mathrm{H}^{\circ}\)) encontrarás que no es exactamente lo que calculaste. ¿Por qué crees que es eso? (Pista: Esta reacción normalmente se lleva a cabo en un disolvente. ¿Qué papel podría desempeñar el solvente en la reacción?)


