8.4: Catálisis
- Page ID
- 76517
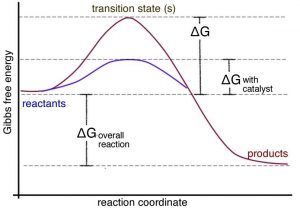
Un catalizador proporciona una vía alternativa para que ocurra una reacción. Más importante aún, esta vía generalmente implica una energía de activación menor que la vía no catalizada, como se muestra en la gráfica. Esto significa que la velocidad de la reacción puede aumentar. Puede hacerlo porque a una temperatura dada, las colisiones con suficiente energía para superar la nueva barrera de energía de activación inferior ocurren con mayor frecuencia. Pero debido a que el catalizador no es ni un reactivo ni un producto de la reacción, no influye en el cambio energético general de la reacción. En los sistemas biológicos, existen catalizadores basados en proteínas y ARN (enzimas y ribozimas); en los sistemas no vivos, los minerales y los metales suelen actuar como catalizadores. Incluso especies simples como los protones pueden considerarse catalizadores. Cualquier cosa que se encuentre inalterada al inicio y al final de la reacción puede considerarse un catalizador. Existen muchos mecanismos diferentes a través de los cuales pueden actuar los catalizadores. Los catalizadores biológicos son generalmente muy selectivos en términos de las reacciones que catalizan y muy efectivos para acelerar las reacciones. No es raro que la velocidad de una reacción catalizada sea millones de veces más rápida que la reacción no catalizada. En un complejo sistema de reacción, acelerar una reacción a expensas de otras puede tener efectos profundos. Sin embargo, también hay muchos ejemplos en los que las enzimas catalizan reacciones “fuera de objetivo” del mismo tipo o de diferentes tipos (aunque estas reacciones generalmente se aceleran en mucho menor medida). Esta capacidad para catalizar una variedad de reacciones ocurre porque las superficies de las moléculas enzimáticas son complejas y a menudo acomodan y se unen a una variedad de moléculas. En otras palabras, son promiscuos. [13] La analogía común de una enzima como cerradura y las moléculas reaccionantes son vistas como la clave única, pero esto es demasiado simplista. En realidad, hay muchas moléculas que pueden unirse a un sitio activo específico en una enzima con afinidades muy variables. Aunque el modo de acción de las enzimas varía, en muchos casos el sitio activo mantiene a las dos moléculas reactivas en estrecha yuxtaposición, lo que puede acelerar su reacción. ¿Te imaginas por qué? [14]
Una reacción química orgánica que requiere un catalizador es la adición de hidrógenos a través de un\(\mathrm{C=C}\) enlace. Sin el catalizador, esta reacción no ocurriría en una escala de tiempo humana. Es una reacción importante en muchas síntesis farmacéuticas y en la producción de grasa (sólida) a partir de aceite (líquidos). Por ejemplo, la margarina se produce añadiendo hidrógeno a los\(\mathrm{C=C}\) enlaces de los aceites extraídos de las plantas, como se muestra en la figura. La eliminación del\(\mathrm{C=C}\) enlace hace que las moléculas se empaqueten mejor juntas. Esto se debe a que las fuerzas de dispersión de Londres ahora pueden actuar sobre toda la longitud de la molécula, aumentando la fuerza de las interacciones de van der Waals entre las moléculas. Así, el aceite hidrogenado es un sólido a temperatura ambiente. El catalizador suele ser un metal de transición, paladio (\(\mathrm{Pd}\)) o platino (\(\mathrm{Pt}\)), finamente dividido y adsorbido sobre la superficie de una sustancia inerte como el carbón vegetal (carbono), como se muestra en la figura. El metal de transición tiene\(\mathrm{d}\) orbitales vacíos que interactúan con el orbital pi del\(\mathrm{C=C}\) enlace, desestabilizando el enlace pi y haciéndolo más susceptible a la reacción. \(\mathrm{H}_{2}\)las moléculas también se adsorben sobre (interactúan con) la superficie del metal de transición y se insertan entre el catalizador\(C\) y el catalizador, formando una grasa completamente hidrogenada. Desafortunadamente, en muchos casos el hidrógeno no se suma a través del doble enlace. En cambio, el enlace isomeriza de cis a trans, formando el isómero trans antinatural que ha sido implicado en el desarrollo de enfermedades cardíacas. [15]
Preguntas para responder
- Dibujar una representación de un sitio activo enzimático. ¿Qué tipo de interacciones crees que mantienen la molécula sustrato en el sitio activo?
- ¿Por qué cree que unir dos reactivos en estrecha proximidad aumentará la velocidad de reacción?


