8.5: Equilibrio
- Page ID
- 76546
Ahora que tenemos una buena idea sobre los factores que afectan la rapidez con que va una reacción, volvamos a una discusión de qué factores afectan hasta dónde llega una reacción. Como se discutió anteriormente, una reacción alcanza el equilibrio cuando la velocidad de la reacción directa es igual a la velocidad de la reacción inversa, por lo que las concentraciones de reactivos y productos no cambian con el tiempo. El estado de equilibrio de una reacción particular se caracteriza por lo que se conoce como la constante de equilibrio,\(\mathrm{K}_{eq}\).
Podemos generalizar esta relación para una reacción general:\[n\mathrm{A}+m\mathrm{B} \rightleftarrows o\mathrm{C}+p\mathrm{D} .\]
![Una imagen de una ecuación. Empezando con los iguales Keq. El numerador tiene “[C] ^0 [D] ^0" y está etiquetado como productos. Y el denominador es “[A] ^n [B] ^m” y se etiqueta como reactantes.](https://chem.libretexts.org/@api/deki/files/393494/ch08-08_Keq.jpg)
Obsérvese que cada concentración se eleva a la potencia de su coeficiente en la reacción equilibrada. Por convención, la constante siempre se escribe con los productos en el numerador, y los reactivos en el denominador. Tan grandes valores de\(\mathrm{K}_{eq}\) indican que, en equilibrio, la mezcla de reacción tiene más productos que reactivos. Por el contrario, un pequeño valor de\(\mathrm{K}_{eq}\) (típicamente <1, dependiendo de la forma de\(\mathrm{K}_{eq}\)) indica que hay menos productos que reactivos en la mezcla en equilibrio. La expresión para\(\mathrm{K}_{eq}\) depende de cómo escribas la dirección de la reacción. Puedes trabajar por ti mismo eso\(\mathrm{K}_{eq} (\text{forward})= 1/\mathrm{K}_{eq}(\text{reverse})\). Otra cosa a tener en cuenta es que si un líquido o sólido puro participa en la reacción, se omite de la expresión de equilibrio para\(\mathrm{K}_{eq}\). Esto tiene sentido porque la concentración de un sólido o líquido puro es constante (a temperatura constante). La constante de equilibrio para cualquier reacción a una temperatura particular es una constante. Esto significa que se pueden agregar reactivos o productos y la constante no cambia. [16] No se puede, sin embargo, cambiar la temperatura, porque eso cambiará la constante de equilibrio como veremos en breve. Las implicaciones de esto son bastante profundas. Por ejemplo, si agrega o quita productos o reactivos de una reacción, las cantidades de reactivos o productos cambiarán para que la reacción vuelva a alcanzar el equilibrio, con el mismo valor de\(\mathrm{K}_{eq}\). Y porque sabemos (o podemos buscar y calcular) cuál es la constante de equilibrio, somos capaces de averiguar exactamente qué hará el sistema para reafirmar la condición de equilibrio.
Volvamos a la reacción del ácido acético y el agua:\[\mathrm{ACOH}+\mathrm{H}_{2} \mathrm{O} \rightleftarrows \mathrm{H}_{3} \mathrm{O}^{+}+\mathrm{AcO}^{-} ,\]
podemos entender que la constante de equilibrio se escribiría como:\[\mathrm{K}_{eq}=\left[\mathrm{H}_{3} \mathrm{O}^{+}\right]\left[\mathrm{AcO}^{-}\right] /[\mathrm{AcOH}] .\]
K eq = [H 3 O +] [AcO —]/[AcOH].
El\(\mathrm{H}_{2}\mathrm{O}\) término en los reactivos puede omitirse aunque participe en la reacción, ya que es un líquido puro y su concentración no cambia apreciablemente durante la reacción. (¿Se puede calcular la concentración de agua pura?) Ya sabemos que una\(0.10-\mathrm{M}\) solución de\(\mathrm{AcOH}\) tiene un\(\mathrm{pH}\) de\(2.9\), por lo que podemos utilizar estos datos determinados experimentalmente para calcular la constante de equilibrio para una solución de ácido acético. Una manera útil de pensar sobre esto es establecer una tabla en la que anote las concentraciones de todas las especies antes y después del equilibrio.
| \([\mathrm{AcOH}]\mathrm{~M}\) | \(\left[\mathrm{H}_{3} \mathrm{O}^{+}\right]\) | \(\left[\mathrm{AcO}^{-}\right] \mathrm{~M}\) | |
| Concentración Inicial | \(0.10\) | \(1 \times 10^{-7}\)(del agua) | \(0\) |
| Cambio en la Concentración (esto es igual a la cantidad de\(\mathrm{AcOH}\) ese ionizado — y se puede calcular a partir de la\(\mathrm{pH}\)) | \(– 1.3 \times 10^{-3}\mathrm{~M}\)
(porque el\(\mathrm{AcOH}\) debe reducir por la misma cantidad que los\(\mathrm{H}^{+}\) aumentos) |
\ (10^ {-\ mathrm {pH}
= 1.3\ times 10^ {-3}\ mathrm {~M}\) |
\(1.3 \times 10^{-3} \mathrm{~M}\)(porque se debe producir la misma cantidad de acetato que\(\mathrm{H}^{+}\)) |
| Final
(concentración de equilibrio) |
\(0.10 – 1.3 \times 10^{-3}\)
\(\sim 0.10\) |
\ (1.3\ times 10^ {-3})
+ (1\ times 10^ {-7}) \ sim 1.3\ veces 10^ {-3}\) |
\(1.3 \times 10^{-3}\) |
También puede incluir el cambio en la concentración a medida que el sistema se mueve al estado de equilibrio:\(\mathrm{ACOH}+\mathrm{H}_{2} \mathrm{O} \rightleftarrows \mathrm{H}_{3} \mathrm{O}^{+}+\mathrm{AcO}^{-}\). Utilizando los datos de este tipo de análisis, podemos calcular la constante de equilibrio:\(\mathrm{K}_{e q}=\left(1.3 \times 10^{-3}\right)^{2} / 0.1\), lo que indica que Keq para estas reacciones es igual\(1.8 \times 10^{-5}. Note that we do not use a large number of significant figures to calculate \(\mathrm{K}_{eq}\) porque no son particularmente útiles, ya que estamos haciendo aproximaciones que hacen que un cálculo más preciso no sea justificable. Además, tenga en cuenta que\(\mathrm{K}_{eq}\) en sí no tiene unidades asociadas a ella.
Energías Libres y Constantes de Equilibrio
Ahora podemos calcular la constante de equilibrio\(\mathrm{K}_{eq}\), asumiendo que podemos medir o calcular las concentraciones de reactivos y productos en equilibrio. Todo bien y bien, pero ¿es esto simplemente una medida empírica? Ciertamente fue descubierto empíricamente y ha demostrado ser aplicable a un gran número de sistemas reactivos. Simplemente no parece muy satisfactorio decir que así son las cosas sin una explicación de por qué la constante de equilibrio es constante. ¿Cómo se relaciona con la estructura molecular? ¿Qué determina la constante de equilibrio? ¿Cuál es la fuerza impulsora que mueve una reacción hacia el equilibrio y luego inhibe cualquier avance hacia los productos?
Recordarás (esperamos) que es la segunda ley de la termodinámica la que nos habla de la probabilidad de que ocurra un proceso. El criterio para proceder a una reacción es que la entropía total del universo debe aumentar. También aprendimos que podemos sustituir el cambio de energía libre del Gibb (\(\Delta \mathrm{G}\)) por el cambio de entropía del universo, y eso\(\Delta \mathrm{G}\) es mucho más fácil de relacionar y calcular porque solo pertenece al sistema. Por lo que no debería sorprenderte que exista una relación entre el impulso hacia el equilibrio y el cambio de energía libre de Gibbs en una reacción. Ya hemos visto que un gran cambio negativo de energía libre de Gibbs (de reactivos a productos) indica que ocurrirá un proceso (o será espontáneo, en términos termodinámicos [17]), mientras que una gran constante de equilibrio positivo significa que la mezcla de reacción contendrá mayormente productos en equilibrio.
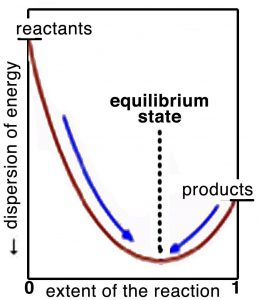
Piénsalo de esta manera: la posición de equilibrio es donde se encuentra el máximo cambio de entropía del universo. A ambos lados de esta posición, el cambio de entropía es negativo y por lo tanto la reacción es poco probable. Si trazamos la extensión de la reacción versus la dispersión de la energía (en el universo) o la energía libre, como se muestra en la gráfica, podemos ver mejor qué se entiende por esto. En equilibrio, el sistema se asienta en el fondo de un pozo de energía (o al menos un mínimo de energía local) donde un movimiento en cualquier dirección conducirá a un aumento en la energía de Gibbs (y una disminución correspondiente de la entropía). Recuerde que aunque a nivel macroscópico el sistema parece estar en reposo, a nivel molecular siguen ocurriendo reacciones. En equilibrio, la diferencia en la energía libre de Gibbs\(\Delta \mathrm{G}\),, entre los reactivos y los productos es cero. Cabe repetir: el criterio para el equilibrio químico es el\(\Delta \mathrm{G} = 0\) de la reacción de los\(\rightleftarrows\) productos reactivos. Esto también es cierto para cualquier cambio de fase. Por ejemplo, a\(100 { }^{\circ}\mathrm{C}\) y 1 atmósfera de presión, la diferencia en la energía libre para\(\mathrm{H}_{2}\mathrm{O}(g)\) y\(\mathrm{H}_{2}\mathrm{O}(l)\) es cero. Debido a que cualquier sistema tenderá naturalmente a esta condición de equilibrio, un sistema lejos del equilibrio puede ser aprovechado para hacer trabajo para alejar alguna otra reacción o sistema no favorable del equilibrio. Por otro lado, un sistema en equilibrio no puede hacer trabajo, como lo examinaremos con mayor detalle.
La relación entre el cambio estándar de energía libre y la constante de equilibrio viene dada por la ecuación:\ [\ Delta\ mathrm {G} ^ {\ circ} = -\ mathrm {RT}\ ln\ mathrm {K}\)
que se puede convertir en la ecuación\[\ln \mathrm{K}_{eq}=-\Delta \mathrm{G}^{\circ} / \mathrm{RT} \text { or } \mathrm{K}_{eq}=e^{-\Delta \mathrm{G}^{\circ} / \mathrm{RT}} .\]
Como vimos anteriormente, el superíndice\({}^{\circ}\) se refiere a cantidades termodinámicas que se miden y calculan en estados estándar. En este caso\(\Delta \mathrm{G}^{\circ}\) se refiere a la presión de 1 atmósfera\(298 \mathrm{~K}\) y y (crítico para nuestra discusión actual)\(1 \mathrm{~M}\) concentraciones tanto para reactivos como para productos. Es decir,:\ Delta\ mathrm {G} ^ {\ circ} te habla del cambio de energía libre si todas las sustancias en el sistema de reacción se mezclaron con concentraciones iniciales de\(1.0 \mathrm{~M}\). Permite calcular constantes de equilibrio a partir de tablas de valores de energía libre (ver Capítulo\(9\)). Por supuesto, esta es una situación bastante artificial y podrías sentirte tentado a pensar que eso no\(\Delta \mathrm{G}^{\circ}\) es muy útil en el mundo real donde las concentraciones iniciales tanto de reactivos como de productos rara vez son\(1.0 \mathrm{~M}\). Pero\(\Delta \mathrm{G}^{\circ}\) no, sí nos dice algo útil: nos dice de qué manera procederá una reacción bajo estas condiciones de partida. Si tenemos un conjunto específico de condiciones, podemos usar\(\Delta \mathrm{G}^{\circ}\) para calcular el cambio de energía libre real\(\Delta \mathrm{G}\), donde:\ [\ Delta\ mathrm {G} =\ Delta\ mathrm {G} ^ {\ circ} +\ mathrm {RT}\ ln\ mathrm {Q}\)
En esta ecuación, la variable\(\mathrm{Q}\) se denomina cociente de reacción. Tiene la misma forma que\(\mathrm{K}_{eq}([\text{products}]/[\text{reactants}]\), salvo que las concentraciones no lo son\(1.0 \mathrm{~M}\). Más bien, son las concentraciones reales en el punto de la reacción que nos interesa. El signo y la magnitud de\(\Delta \mathrm{G}\) entonces nos dirán en qué dirección procederá la reacción y hasta dónde llegará en esa dirección.
Las diferencias entre\(\mathrm{Q}\) y\(\mathrm{K}_{eq}\),\(\Delta \mathrm{G}\), y\(\Delta \mathrm{G}^{\circ}\) son importantes a tener en cuenta. Es fácil mezclarse y aplicarlos incorrectamente. \(\mathrm{Q}\)y\(\Delta \mathrm{G}\) relacionarse con sistemas de no equilibrio mientras que\(\mathrm{K}_{eq}\) y nos\(\Delta \mathrm{G}^{\circ}\) dicen sobre el propio estado de equilibrio. En equilibrio,\(\mathrm{Q} = \mathrm{K}_{eq}\), y\(\Delta \mathrm{G} = 0\), para que la ecuación\(\Delta \mathrm{G} = \Delta \mathrm{G}^{\circ} +\mathrm{RT} \ln \mathrm{Q}\) se convierta\(\Delta \mathrm{G}^{\circ} = – \mathrm{RT} \ln \mathrm{K}_{eq}\). Obsérvese que\(\mathrm{K}_{eq}\) y\(\Delta \mathrm{G}^{\circ}\) son constantes para una reacción dada a una temperatura dada, pero\(\mathrm{Q}\) y no lo\(\Delta \mathrm{G}\) son; sus valores varían según las condiciones de reacción. De hecho, al usar\(\mathrm{Q}\) y/o\(\Delta \mathrm{G}\), podemos predecir cómo se comportará un sistema bajo una condición específica a medida que se mueve hacia el estado de entropía más alto (a dónde\(\Delta \mathrm{G} = 0\)).
Estados de Equilibrio y de No Equilibrio
Veamos un sistema químico macroscópicamente. Si consideramos un sistema de reacción que comienza a cambiar cuando los reactivos se mezclan (es decir, ocurre espontáneamente), eventualmente veremos que el cambio se ralentiza y luego se detiene. No sería irrazonable pensar que el sistema es estático y asumir que las moléculas en el sistema son estables y ya no reaccionan. Sin embargo, como comentamos anteriormente, a nivel molecular vemos que el sistema sigue cambiando y las moléculas de reactivos y productos siguen reaccionando tanto en las reacciones hacia adelante como en las reacciones inversas. En el caso de nuestro ejemplo de ácido acético, todavía hay moléculas de ácido acético, (\(\mathrm{AcOH}\)), acetato (\(\mathrm{AcO}^{-}\)) e ion hidronio (\(\mathrm{H}_{3}\mathrm{O}^{+}\)) colisionando con moléculas de agua solvente y entre sí. Algunas de estas reacciones tendrán suficiente energía para ser productivas; las moléculas de acetato transferirán protones a moléculas de agua y también ocurrirá la reacción inversa. Lo que ha cambiado es que la tasa de formación de acetato (\(\mathrm{AcO}^{-}\)) e ion hidronio (\(\mathrm{H}_{3}\mathrm{O}^{+}\)) es igual y opuesta a la velocidad de desprotonación del ácido acético (transferencia del protón al agua). Aunque no hay ningún cambio neto a nivel macroscópico, las cosas están sucediendo a nivel molecular. Los bonos se están rompiendo y formando. Este es el equilibrio dinámico que discutimos anteriormente.
Ahora qué pasa cuando perturbaremos el sistema. En equilibrio, el sistema ácido acético-agua contiene ácido acético (\(\mathrm{AcOH}\)), protones (\(\mathrm{H}_{3}\mathrm{O}^{+}\)) e ion acetato (\(\mathrm{AcO}^{-}\)). Sabemos que una\(0.10-\mathrm{M}\) solución de ácido acético tiene concentraciones de\(\left[\mathrm{H}_{3}\mathrm{O}^{+}\right] = \left[\mathrm{AcO}^{-}\right] = 1.3 \times 10^{-3} \mathrm{~M}\). Ahora agregamos suficiente acetato [18] para hacer la concentración de acetato\(0.10 \mathrm{~M}\)? Una manera de pensar sobre esta nueva situación es considerar las probabilidades de las reacciones hacia adelante y hacia atrás. Si agregamos más producto (acetato), la velocidad de la reacción hacia atrás debe aumentar (porque hay más iones acetato alrededor con los que colisionar). Tenga en cuenta que para ello, el acetato debe reaccionar con el ion hidronio, por lo que predecimos que el\(\left[\mathrm{H}_{3}\mathrm{O}^{+}\right]\) disminuirá y el acetato aumentará. Pero como vimos anteriormente, en cuanto se forma más ácido acético, la probabilidad de la reacción hacia adelante aumenta y se establece una nueva posición de equilibrio, donde la velocidad de las reacciones hacia adelante es igual a la velocidad de las reacciones hacia atrás. Usando este argumento podríamos esperar que en la nueva posición de equilibrio habrá más ácido acético, más acetato y menos iones hidronio de lo que había originalmente. Predecimos que la posición de equilibrio se desplazará hacia atrás hacia el ácido acético.
Este argumento de probabilidad nos da una idea de lo que sucederá cuando se perturbe una reacción en equilibrio, pero no nos dice exactamente dónde va a reestabilizarse. Para eso tenemos que mirar\(\mathrm{Q}\) y\(\mathrm{K}_{eq}\). Si tomamos las nuevas condiciones iniciales de reacción (\(0.10 \mathrm{~M AcOH}, 0.10 \mathrm{~M AcO}^{-}\), y\(1.3 \times 10^{-3}\mathrm{~M H}_{3}\mathrm{O}^{+}\)) y las analizamos para determinar las concentraciones de todas las especies participantes, podemos calcularlas\(\mathrm{Q}\) y compararlas con\(\mathrm{K}_{eq}\):\[\mathrm{Q}=\left[\mathrm{H}_{3} \mathrm{O}^{+}\right]\left[\mathrm{AcO}^{-}\right] /[\mathrm{AcOH}]=\left(1.3 \times 10^{-3}\right)(0.1) /(0.1)\]
Esto genera un valor para\(\mathrm{Q}\) as\(1.3 \times 10^{-3}\). Ahora bien, si comparamos\(\mathrm{Q}\) y\(\mathrm{K}_{eq}\), vemos que\(\mathrm{Q}\) es mayor que\(\mathrm{K}_{eq}\) (\(1.3 \times 10^{-3} > 1.8 \times 10^{-5}\)). Para restablecer el equilibrio, el sistema tendrá que desplazarse para que\(\mathrm{Q}\) se vuelva más pequeño o igual a\(\mathrm{K}_{eq}\) (momento en el que\(\Delta \mathrm{G} = 0\)). Para ello, el numerador (productos) debe disminuir, mientras que el denominador (reactivos) debe aumentar. [19] En otras palabras, la reacción debe retroceder para restablecer un estado de equilibrio. Este enfoque nos lleva a la misma conclusión que nuestro argumento de probabilidad anterior.
Si recalculamos el\(\left[\mathrm{H}_{3}\mathrm{O}^{+}\right]\) bajo las nuevas condiciones de equilibrio (es decir\(0.10 \mathrm{~M AcOH}\) y\(0.10 \mathrm{~M}\) acetato), encontramos que ha disminuido considerablemente desde su valor inicial de\(1.3 \times 10^{-3}\), hasta el nuevo valor de\(1.8 \times 10^{-5} \mathrm{~M}\). [20] Usando esto para calcular el\(\mathrm{pH}\), descubrimos que la adición de acetato de sodio hace que el\(\mathrm{pH}\) aumente de\(2.9\) a\(4.5\). Esto puede no parecer mucho, pero recuerde que cada\(\mathrm{pH}\) unidad es un factor de 10, por lo que este aumento en en\(\mathrm{pH}\) realidad indica una caída en la concentración de iones hidronio de un poco menos de cien veces. Para recuperar la situación más estable, el sistema se desplaza hacia la izquierda, reduciendo así la cantidad de producto:\[\mathrm{ACOH}+\mathrm{H}_{2} \mathrm{O} \rightleftarrows \mathrm{H}_{3} \mathrm{O}^{+}+\mathrm{AcO}^{-}\]
Hay una serie de ejercicios que le permitirán comprender mejor los cálculos involucrados en la definición de los efectos de las perturbaciones (cambios en las condiciones, concentraciones y temperatura) sobre el estado de equilibrio de un sistema. (Muchos libros de química están llenos de tales problemas de tampón y pH). Lo que es realmente importante tener en cuenta es que un sistema volverá al equilibrio tras la perturbación. Aquí es donde el sistema es más estable. Y una vez que el sistema esté en equilibrio, nuevas perturbaciones conducirán a un nuevo estado de equilibrio.
Principio de Le Chatelier
Se puede reconocer la discusión anterior como una idea bastante conocida articulada por Henry Louis Le Chatelier: “Si un sistema químico en equilibrio experimenta un cambio en la concentración, temperatura, volumen o presión parcial, entonces el equilibrio cambia para contrarrestar el cambio impuesto y se establece un nuevo equilibrio”. El principio de Le Chatelier es una de las heurísticas más conocidas y de mayor aplicación (una regla general que te ayuda a predecir un resultado) en la ciencia. No obstante, es importante entender por qué funciona este principio. El principio de Le Chatelier es otro recordatorio más de que la segunda ley de la termodinámica siempre está vigente.
El principio de Le Chatelier menciona específicamente diferentes tipos de cambios que pueden afectar la posición de equilibrio, sin embargo, solo hemos discutido cambios en las concentraciones. ¿Qué pasa con la temperatura, el volumen y la presión parcial? ¿Cómo afectan al equilibrio? Tampoco hemos abordado específicamente las reacciones de equilibrio que tienen lugar en la fase gaseosa. Como ejemplo, importantes reacciones atmosféricas como la formación y agotamiento del ozono tienen lugar en la fase gaseosa. No hay nada particularmente especial o diferente en calcular la constante de equilibrio para las reacciones en fase gaseosa. Podemos utilizar presiones parciales de cada gas o concentraciones (\(\mathrm{mol/L}\)), aunque el valor de\(\mathrm{K}_{eq}\) difiere dependiendo de las unidades que elija. Además, no puedes mezclar y combinar; debes usar todas las presiones o todas las concentraciones. El efecto de aumentar el volumen es lo mismo que disminuir la concentración, y aumentar la presión tiene el mismo efecto que aumentar la concentración. Obsérvese, sin embargo, que agregar un gas que no sea participante en la reacción no tiene efecto a pesar de que se incremente la presión total.
Temperatura, Equilibrio y Tasas de Reacción
El efecto de cambiar la temperatura en la posición de equilibrio es un poco más complejo. A primera suposición, se podría predecir que el aumento de la temperatura afectará las tasas tanto de las reacciones hacia adelante como hacia atrás por igual. No obstante, si miramos más de cerca, vemos que esto no es cierto. Vuelva a pensar en las discusiones sobre la temperatura y la energía térmica. Si se eleva la temperatura del sistema, significa que se ha agregado energía térmica al sistema desde los alrededores. Podemos tratar la adición de energía al sistema como una perturbación y de acuerdo con el principio de Le Chatelier, si algo en el sistema cambia (concentración, volumen, presión, temperatura), entonces el sistema cambia a un nuevo estado de equilibrio. Para predecir el efecto de agregar energía al sistema, necesitamos tener más información sobre los cambios energéticos asociados con ese sistema. Como vimos anteriormente, el cambio de entalpía (\(\Delta \mathrm{H}\)) nos habla del cambio de energía térmica para sistemas bajo presión constante (la mayoría de los sistemas que nos interesan). Podemos medir o calcular los cambios de entalpía para muchas reacciones y, por lo tanto, utilizarlos para predecir el efecto de aumentar la temperatura (agregando energía térmica). Por ejemplo, tomar la reacción de nitrógeno e hidrógeno para formar amoníaco. [21] Esta reacción es:\[\mathrm{N}_{2}(g)+3 \mathrm{H}_{2}(g) \rightleftarrows 2 \mathrm{NH}_{3}(g)(\Delta \mathrm{H}=-92.4 \mathrm{~kJ} / \mathrm{mol})\]
La reacción es exotérmica porque por cada mol de amoníaco (\(17\mathrm{g}\)),\(92.4 \mathrm{~kJ}\) de energía térmica se produce y se transfiere al entorno (como lo indica el signo negativo del cambio de entalpía). Ahora bien, si calentamos esta reacción, ¿qué pasará con la posición de equilibrio? Reescribamos la ecuación para mostrar que se produce energía térmica:\[\mathrm{N}_{2}(g)+3 \mathrm{H}_{2}(g) \rightleftarrows 2 \mathrm{NH}_{3}(g)+184.8 \mathrm{~kJ}\]
(\(2 \times 92.4 \mathrm{~kJ}\)ya que se producen dos moles de amoníaco). Si la energía térmica es un producto de la reacción, el principio de Le Chatelier nos dice que si agregamos más producto, la reacción debe cambiar hacia los reactivos. Efectivamente, si calentamos esta reacción, la posición de equilibrio cambia hacia el amoníaco y el hidrógeno, ¡comienza a retroceder! Esto en realidad es todo un problema, ya que esta reacción requiere de una temperatura bastante alta para hacerla ir en primer lugar. La producción de amoníaco es difícil si calentar la reacción hace que vaya en dirección opuesta a la que se desea.
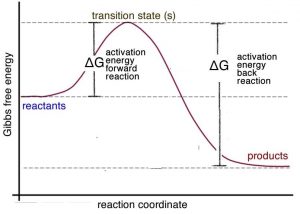
Es importante recordar que el principio de Le Chatelier es sólo una heurística; no nos dice por qué el sistema se desplaza hacia la izquierda. Para responder a esta pregunta, consideremos el perfil energético para una reacción exotérmica. Podemos ver en la gráfica\(\rightarrow\) que la energía de activación para la reacción inversa (o posterior) (\(\Delta \mathrm{G} \neq \text{ reverse}\)) es mayor que la de la reacción directa (\(\Delta \mathrm{G} \neq \text{ forward}\)). Dicho de otra manera: se requiere más energía para que las moléculas reaccionen de manera que se produzca la reacción inversa (inversa) que para la reacción directa. Por lo tanto, tiene sentido que si se suministra más energía, la reacción inversa se vea afectada más que la reacción directa. [22]
Existe una diferencia importante entre alterar una reacción en equilibrio cambiando las concentraciones de reactivos o productos, y cambiando la temperatura. Cuando cambiamos las concentraciones, las concentraciones de todos los reactivos y productos cambian a medida que la reacción vuelve a avanzar hacia el equilibrio, pero la constante de equilibrio permanece constante y no cambia. Sin embargo, si cambiamos la temperatura, la constante de equilibrio cambia de valor, en una dirección que puede predecirse por el principio de Le Chatelier.
Equilibrio y estado estacionario
Ahora bien, aquí hay un punto interesante: imagina una situación en la que continuamente se agregan y eliminan reactivos y productos de un sistema. Dichos sistemas se describen como sistemas abiertos, es decir, que la materia y la energía son capaces de entrar o salir de ellos. Los sistemas abiertos nunca están en equilibrio. Suponiendo que los cambios en el sistema ocurren en una escala de tiempo que es más rápida que la velocidad a la que el sistema vuelve al equilibrio después de una perturbación, el sistema bien podría ser estable. Dichos sistemas estables de no equilibrio se denominan sistemas de estado estacionario. Piensa en una taza con un agujero en ella llenándose de un grifo. Si la velocidad a la que el agua fluye hacia la taza es igual a la velocidad a la que fluye hacia afuera, el nivel de agua en la taza permanecería igual, aunque constantemente se agregaría agua y saldría del sistema (la taza). Los organismos vivos son ejemplos de sistemas de estado estacionario; son sistemas abiertos, con energía y materia entrando y saliendo. Sin embargo, la mayoría de los sistemas de equilibrio estudiados en química (al menos los discutidos en textos introductorios) son cerrados, lo que significa que ni la energía ni la materia pueden entrar o salir del sistema.

Además, los sistemas biológicos se caracterizan por el hecho de que hay múltiples reacciones que ocurren simultáneamente y que varias de estas reacciones comparten componentes; los productos de una reacción son los reactivos en otras reacciones. A esto lo llamamos un sistema de reacciones acopladas. Dichos sistemas pueden producir comportamientos bastante complejos (como exploraremos más a fondo en el Capítulo\(9\)). Un interesante sistema de reacción de acoplamiento (aparte de la vida misma) es la reacción de Belousov—Zhabotinsky (BZ) en la que el cesio cataliza la oxidación y bromación del ácido malónico. [23] Si el sistema no se agita, esta reacción puede producir patrones espaciales bastante complejos y dinámicos, como se muestra en la figura. La reacción típica de BZ involucra un sistema cerrado, por lo que eventualmente alcanzará un estado de equilibrio aburrido (macroscópicamente estático). La naturaleza abierta de los sistemas biológicos hace que los comportamientos complejos no tengan que detenerse; continúan durante periodos de tiempo muy largos. La teoría celular de la vida (la teoría de que todas las células se derivan de células preexistentes y que todos los organismos se construyen a partir de células o sus productos), junto con el registro fósil, indica que el sistema de no equilibrio de reacciones químicas acopladas que ha dado lugar a todos los organismos ha persistido, ininterrumpida, durante al menos\(\sim 3.5\) mil millones de años (una base muy compleja para algo tan frágil como la vida).
Los sistemas de estado estacionario que se encuentran en los organismos muestran dos propiedades extremadamente importantes: son adaptativos y homeostáticos. Esto significa que pueden cambiar en respuesta a diversos estímulos (adaptación) y que tienden a regresar a su estado original tras una perturbación (homeostasis). Ambos son distintos del principio de Le Chatelier en que no son pasivos; son procesos activos que requieren energía. La adaptación y la homeostasis pueden parecer contradictorias, pero de hecho trabajan en conjunto para mantener vivos a los organismos y capaces de adaptarse a las condiciones cambiantes. [24] Incluso los organismos más simples se caracterizan por una gran complejidad debido a la naturaleza interconectada y evolucionada de sus sistemas adaptativos y homeostáticos.
Preguntas para responder
- ¿Qué significa cuando decimos que una reacción ha alcanzado el equilibrio?
- ¿Qué implica la magnitud de la constante de equilibrio sobre el grado en que el ácido acético se ioniza en el agua?
- Escriba la constante de equilibrio para la reacción\(\mathrm{H}_{3} \mathrm{O}^{+}+\mathrm{AcO}^{-} \rightleftarrows \mathrm{ACOH}+\mathrm{H}_{2} \mathrm{O}\).
- ¿Cuál sería el valor de esta constante de equilibrio? ¿Tiene sentido en términos de lo que sabes sobre las reacciones ácido-base?
- Si el\(\mathrm{pH}\) de una\(0.15-\mathrm{M}\) solución de un ácido es\(3.6\), ¿cuál es la constante de equilibrio Ka para este ácido? ¿Es el ácido un ácido débil o fuerte? ¿Cómo lo sabes?
- El carbonato de calcio (\(\mathrm{CaCO}_{3}\)) no es (muy) soluble en agua. Escriba la ecuación para la disolución de\(\mathrm{CaCO}_{3}\). ¿Cuál sería la expresión para su\(\mathrm{K}_{eq}\)? (Pista: recordar sólidos puros y líquidos no aparecen en la expresión.) Si\(\mathrm{K}_{eq}\) para este proceso es\(6.0 \times 10^{-9}\), ¿cuál es la solubilidad de\(\mathrm{CaCO}_{3}\) in\(\mathrm{mol/L}\)?
- ¿Qué factores determinan las concentraciones de equilibrio para una reacción?
- Para la reacción\(\mathrm{N}_{2}(g)+3 \mathrm{H}_{2}(g) \rightleftarrows 2 \mathrm{NH}_{3}(g)(\Delta \mathrm{H}=-92.4 \mathrm{~kJ} / \mathrm{mol})\), predice el efecto sobre la posición de equilibrio, y sobre las concentraciones de todas las especies en el sistema, si:
- añadir nitrógeno
- eliminar hidrógeno
- añadir amoníaco
- calentar la reacción
- enfriarlo
- Dibuja un diagrama de energía de reacción en el que la reacción inversa sea mucho más rápida que la reacción directa (y viceversa).
- A medida que un sistema avanza hacia el equilibrio, ¿cuál es el signo de\(\Delta \mathrm{G}\)? A medida que se aleja del equilibrio, ¿cuál es el signo de\(\Delta \mathrm{G}\)?
- Explica con tus propias palabras la diferencia entre\(\Delta \mathrm{G}^{\circ}\) y\(\Delta \mathrm{G}\).
- Imagina que tienes un sistema de reacción\(\mathrm{A} \rightleftarrows \mathrm{B}\) para el cual\(\mathrm{K}_{eq} = 1\). Dibuja una gráfica de cómo\(\Delta \mathrm{G}\) cambia a medida que cambian las cantidades relativas de\([\mathrm{A}]\) y\([\mathrm{B}]\) cambian.
- ¿Cómo se vería esta gráfica si\(\mathrm{K}_{eq} = 0.1\)? o\(\mathrm{K}_{eq} = 2\)?
- Si\(\Delta \mathrm{G}^{\circ}\) es grande y positivo, ¿qué significa esto para el valor de\(\mathrm{K}_{eq}\)?
- Y si\(\Delta \mathrm{G}^{\circ}\) es grande y negativo, ¿cómo influye la influencia\(\mathrm{K}_{eq}\)?
Preguntas para más tarde
- ¿Por qué es\(\mathrm{K}_{eq}\) dependiente de la temperatura?
- Explicar mecanísticamente por qué se invierten las desviaciones aleatorias del equilibrio.
- Si el valor de\(\mathrm{Q}\) es\(> \mathrm{K}_{eq}\), ¿qué te dice eso del sistema? ¿Y si lo\(\mathrm{Q}\) es\(< \mathrm{K}_{eq}\)?
Preguntas para reflexionar
- La constante de disociación ácida para etanol (\(\mathrm{CH}_{3}\mathrm{CH}_{2}\mathrm{OH}\)) es\(\sim 10^{-15}\). ¿Por qué crees que el ácido acético es 10 mil millones de veces más ácido que el etanol? (Pista: dibujar las estructuras y pensar en la estabilidad de la base conjugada.)
- Si\(\Delta \mathrm{G}\) para un sistema es = 0, ¿qué significa eso?


