8.6: Volver a Mecanismos de reacción
- Page ID
- 76532
Recordemos que una de las razones más importantes para estudiar la cinética de reacción es obtener información sobre la vía de reacción, o mecanismo. Ahora que tenemos todos los conceptos que necesitamos para entender estas ideas, volvamos y veamos cómo armarlo todo. La ecuación de velocidad, junto con la constante de equilibrio, es la clave para desentrañar lo que sucede durante una reacción.
Hemos visto que, a una temperatura dada, la velocidad de reacción depende de la magnitud de la constante de velocidad y de las concentraciones de uno o más de los reactivos. Sin embargo, para las dos reacciones de sustitución aparentemente similares que discutimos anteriormente, las ecuaciones de tasa son diferentes. ¿Qué está pasando aquí? La respuesta radica en el hecho de que la mayoría de las reacciones no ocurren en un solo paso. En muchos casos, no hay una transición suave de reactivos a productos con un solo estado de transición y energía de activación, como lo hemos retratado de manera simplista. Más bien, hay una serie de pasos, cada uno con su propio estado de transición y energía de activación. Aquí, solo consideraremos reacciones de un paso y dos etapas, pero en realidad podría haber muchos pasos distintos desde el reactivo hasta el producto. Cada paso representa una especie de sub-reacción, cada una con su propia energía de activación y estado de equilibrio. La cinética de una reacción generalmente está determinada por la más lenta de estas sub-reacciones, por lo que se forma una especie de cuello de botella o etapa limitante de velocidad. La ecuación de velocidad nos da información sobre qué reactivos están presentes en la etapa de determinación de la velocidad de la reacción. La reacción solo puede ir tan rápido como el paso más lento (el paso con la barrera de energía de activación más alta). Como analogía, imagina que estás viajando\(70 \mathrm{~mph}\) en una autopista de cinco carriles. Si los carriles de repente se estrechan para permitir solo un carril de tránsito, todos los autos disminuyen la velocidad. A pesar de que son capaces de viajar más rápido, nadie puede pasar de los autos más lentos.
La reacción que discutimos anteriormente entre bromuro de metilo (\(\mathrm{CH}_{3}\mathrm{Br}\)) e hidróxido (\({}^{-}\mathrm{OH}\)):\[\mathrm{CH}_{3} \mathrm{Br}+{ }^{-} \mathrm{OH}+\mathrm{Na}^{+} \rightleftarrows \mathrm{CH}_{3} \mathrm{OH}+\mathrm{Br}^{-}+\mathrm{Na}^{+}\]
se ha demostrado experimentalmente que tiene la ecuación de tasa:\(\text{ rate } = k \left[\mathrm{CH}_{3}\mathrm{Br}\right] \left[{}^{-}\mathrm{OH}\right]\)
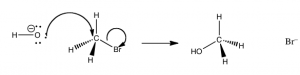
Lo que esto nos dice que la velocidad de esta reacción depende de ambos reactivos. Esto significa que cualquiera que sea el mecanismo de la reacción, ambos reactivos deben estar presentes en el estado de transición (la especie a la energía más alta en el perfil energético) que determina la velocidad de reacción. A partir de esta información podríamos comenzar a pensar cuál podría ser el camino para la reacción. Resulta que la posibilidad más simple es en realidad la correcta —que es que la reacción se lleve a cabo en un solo paso, como se muestra en la figura. es decir, el hidróxido (el nucleófilo) es atraído por el carbono, y al mismo tiempo se rompe el enlace de bromo carbono. es decir, la reacción se lleva a cabo en un solo paso que involucra tanto el hidróxido como el bromuro de metilo.
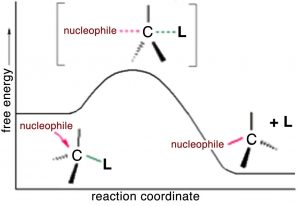
Podemos imaginar cómo podría ser la estructura del estado de transición (aunque no podemos detectarlo por ningún método tradicional porque los estados de transición solo existen para una vibración molecular y son muy difíciles de detectar). El nucleófilo (\({}^{-}\mathrm{OH}\)) es atraído por\(\delta +\) el carbono metílico. Al mismo tiempo, el ion bromuro comienza a salir, de manera que en la “parte superior” del estado de transición (el punto más inestable, que requiere la mayor cantidad de energía para formarse), tenemos un carbono que se coordina a otros cinco átomos por enlaces parciales o completos. Dado que el carbono normalmente hace cuatro enlaces, no es de extrañar que esta especie pentavalente se asiente en el punto de energía más alto de la reacción.
Sin embargo, si analizamos lo que parece ser una reacción muy similar:\[\left(\mathrm{CH}_{3}\right)_{3} \mathrm{CBr}+{}^{-}\mathrm{OH} \rightleftarrows \left(\mathrm{CH}_{3}\right)_{3} \mathrm{COH}+\mathrm{Br} .\]
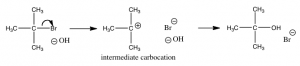
Debemos llegar a la conclusión de que tiene un mecanismo diferente. ¿Por qué? Porque la ecuación de velocidad para esta reacción es de primer orden:\(\text{ rate } = k \left[\left(\mathrm{CH}_{3}\right)_{3} \mathrm{CBr}\right]\). Esto nos dice que sólo\(\left(\mathrm{CH}_{3}\right)_{3} \mathrm{CBr}\) está involucrado en el paso que determina la tasa. En otras palabras, el estado de transición con la mayor energía de activación involucra solo la molécula de bromuro de t-butilo. No hay ningún nucleófilo (el hidróxido) presente durante el paso que determine qué tan rápido va la reacción.
Si bien hay una serie de mecanismos posibles que podríamos postular para esta reacción, el mecanismo para esta reacción implica dos pasos discretos, como se muestra en la figura.
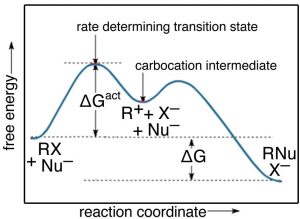
El primero es la ionización del bromuro de t-butilo, que implica romper el\(\mathrm{C—Br}\) enlace. Esto da como resultado un carbono cargado positivamente (el bromo toma todos los electrones y se convierte en ion bromuro), una especie muy inestable y distinta conocida como carbocatión. El carbocatión resultante es un intermedio: se asienta en un pozo energético entre dos estados menos estables. Esto lo distingue del estado de transición, que se asienta precariamente en el estado energético local más alto (rodeado de estados de menor energía). Los intermedios se encuentran en los “valles” energéticos, mientras que los estados de transición se encuentran en la cima de un “cerro” energético, como se muestra en la figura. El carbocatión puede reaccionar con el hidróxido, para formar el alcohol t-butílico, o puede reaccionar con el bromuro para reformar el producto original (o puede ocurrir una variedad de otras reacciones secundarias). El punto importante aquí es que podemos deducir cómo procederá la reacción a partir de la ecuación de velocidad para cada reacción.
Preguntas para responder
- Dibuje un diagrama de energía de reacción para una reacción de dos etapas en la que la segunda (o primera) etapa es la determinación de la velocidad.
- Cuál es la ecuación de velocidad para una reacción que ocurre en los siguientes pasos:
- \(A + B \rightarrow C\)(rápido)?
- \(A + C \rightarrow D\)(lento)?
- Explique por qué no es posible escribir una ecuación de velocidad a partir de la ecuación de reacción.
En este capítulo hemos explorado cómo el destino de las reacciones está determinado por una variedad de factores, incluyendo las concentraciones de reactivos y productos, la temperatura y el cambio de energía de Gibbs. Hemos aprendido que podemos hacer que una reacción vaya hacia atrás, hacia adelante, más rápida o más lenta examinando la naturaleza de la reacción y las condiciones en las que se realiza. Ahora puedes extender estos principios para imaginar cómo podríamos controlar las reacciones para hacer lo que queremos, en lugar de dejar que la naturaleza (o la entropía) siga su curso. En el siguiente capítulo, llevaremos esto un paso más allá para ver qué sucede cuando las reacciones se eliminan del aislamiento y se les permite interactuar entre sí.


