4.3: Estequiometría de Reacción
- Page ID
- 75848
- Explicar el concepto de estequiometría en lo que respecta a las reacciones químicas
- Usar ecuaciones químicas balanceadas para derivar factores estequiométricos que relacionan cantidades de reactivos y productos
- Realizar cálculos estequiométricos que involucren masa, moles y molaridad de solución
Una ecuación química equilibrada proporciona una gran cantidad de información en un formato muy sucinto. Las fórmulas químicas proporcionan las identidades de los reactivos y productos involucrados en el cambio químico, permitiendo la clasificación de la reacción. Los coeficientes proporcionan los números relativos de estas especies químicas, permitiendo una evaluación cuantitativa de las relaciones entre las cantidades de sustancias consumidas y producidas por la reacción. Estas relaciones cuantitativas se conocen como estequiometría de la reacción, término derivado de las palabras griegas stoicheion (que significa “elemento”) y metron (que significa “medida”). En este módulo se explora el uso de ecuaciones químicas balanceadas para diversas aplicaciones estequiométricas.
El enfoque general para el uso de relaciones estequiométricas es similar en concepto a la forma en que las personas realizan muchas actividades comunes. Cocinar, por ejemplo, ofrece una comparación adecuada. Supongamos que una receta para hacer ocho panqueques requiere 1 taza de mezcla para panqueques,\(\dfrac{3}{4}\) taza de leche y un huevo. La “ecuación” que representa la preparación de panqueques según esta receta es
\[\mathrm{1\:cup\: mix+\dfrac{3}{4}\:cup\: milk+1\: egg \rightarrow 8\: pancakes} \label{4.4.1} \]
Si se necesitan dos docenas de panqueques para un gran desayuno familiar, las cantidades de ingredientes deben aumentarse proporcionalmente de acuerdo con las cantidades dadas en la receta. Por ejemplo, la cantidad de huevos requeridos para hacer 24 panqueques es
\[\mathrm{24\: \cancel{pancakes} \times \dfrac{1\: egg}{8\: \cancel{pancakes}}=3\: eggs} \label{4.4.2} \]
Las ecuaciones químicas equilibradas se utilizan de la misma manera para determinar la cantidad de un reactivo requerida para reaccionar con una cantidad dada de otro reactivo, o para producir una cantidad dada de producto, y así sucesivamente. Los coeficientes en la ecuación balanceada se utilizan para derivar factores estequiométricos que permiten el cálculo de la cantidad deseada. Para ilustrar esta idea, considere la producción de amoníaco por reacción de hidrógeno y nitrógeno:
\[\ce{N2}(g)+\ce{3H2}(g)\rightarrow \ce{2NH3}(g) \label{4.4.3} \]
Esta ecuación muestra que las moléculas de amoníaco se producen a partir de moléculas de hidrógeno en una proporción 2:3, y los factores estequiométricos pueden derivarse usando cualquier cantidad (número) unidad:
\[\ce{\dfrac{2NH3 \: molecules}{3H2 \: molecules}\: or \: \dfrac{2 \: doz \: NH3\: molecules}{3\: doz\:H2 \:molecules} \: or \: \dfrac{2\: mol\: NH3\: molecules}{3\: mol\: H2\: molecules}} \label{4.4.4} \]
Estos factores estequiométricos pueden usarse para calcular el número de moléculas de amoníaco producidas a partir de un número dado de moléculas de hidrógeno, o el número de moléculas de hidrógeno requeridas para producir un número dado de moléculas de amoníaco. Se pueden derivar factores similares para cualquier par de sustancias en cualquier ecuación química.
¿Cuántos moles de I2 se requieren para reaccionar con 0.429 mol de Al según la siguiente ecuación (ver Figura\(\PageIndex{2}\))?
\[\ce{2Al + 3I2 \rightarrow 2AlI3} \label{4.4.5} \]

Solución
Refiriéndose a la ecuación química equilibrada, el factor estequiométrico que relaciona las dos sustancias de interés es\(\ce{\dfrac{3\: mol\: I2}{2\: mol\: Al}}\). La cantidad molar de yodo se deriva multiplicando la cantidad molar proporcionada de aluminio por este factor:

\[\begin{align*} \mathrm{mol\: I_2} &=\mathrm{0.429\: \cancel{mol\: Al}\times \dfrac{3\: mol\: I_2}{2\:\cancel{mol\: Al}}} \\[4pt] &=\mathrm{0.644\: mol\: I_2} \end{align*} \nonumber \]
¿Cuántos moles de Ca (OH) 2 se requieren para reaccionar con 1.36 mol de H 3 PO 4 para producir Ca 3 (PO 4) 2 según la ecuación\(\ce{3Ca(OH)2 + 2H3PO4 \rightarrow Ca3(PO4)2 + 6H2O}\)?
- Contestar
-
2.04 mol
¿Cuántas moléculas de dióxido de carbono se producen cuando se queman 0.75 mol de propano de acuerdo con esta ecuación?
\[\ce{C3H8 + 5O2 \rightarrow 3CO2 + 4H2O} \label{4.4.6} \]
S olución
El enfoque aquí es el mismo que para Ejemplo\(\PageIndex{1}\), aunque se solicita el número absoluto de moléculas, no el número de moles de moléculas. Esto simplemente requerirá el uso del factor de conversión de moles a números, el número de Avogadro.
La ecuación equilibrada muestra que el dióxido de carbono se produce a partir del propano en una proporción 3:1:
\[\ce{\dfrac{3\: mol\: CO2}{1\: mol\: C3H8}} \label{4.4.7} \]
Usando este factor estequiométrico, la cantidad molar proporcionada de propano y el número de Avogadro,

\[\mathrm{0.75\: \cancel{mol\: C_3H_8}\times \dfrac{3\: \cancel{mol\: CO_2}}{1\:\cancel{mol\:C_3H_8}}\times \dfrac{6.022\times 10^{23}\:CO_2\:molecules}{\cancel{mol\:CO_2}}=1.4\times 10^{24}\:CO_2\:molecules} \label{4.4.8} \]
Cuántas moléculas NH 3 se producen por la reacción de 4.0 mol de Ca (OH) 2 según la siguiente ecuación:
\[\ce{(NH4)2SO4 + Ca(OH)2 \rightarrow 2NH3 + CaSO4 + 2H2O} \label{4.4.9} \]
- Contestar
-
4.8 × 10 24 NH 3 moléculas
Estos ejemplos ilustran la facilidad con la que pueden relacionarse las cantidades de sustancias implicadas en una reacción química de estequiometría conocida. Sin embargo, medir directamente números de átomos y moléculas no es una tarea fácil, y la aplicación práctica de la estequiometría requiere que usemos la propiedad de masa más fácil de medir.
¿Qué masa de hidróxido de sodio, NaOH, se requeriría para producir 16 g de la leche antiácida de magnesia [hidróxido de magnesio, Mg (OH) 2] por la siguiente reacción?
S olución
El enfoque utilizado anteriormente en los Ejemplos\(\PageIndex{1}\) y\(\PageIndex{2}\) así mismo se emplea aquí; es decir, debemos derivar un factor estequiométrico apropiado de la ecuación química equilibrada y utilizarlo para relacionar las cantidades de las dos sustancias de interés. En este caso, sin embargo, se proporcionan y solicitan masas (no cantidades molares), por lo que se requieren pasos adicionales del tipo aprendido en el capítulo anterior. Los cálculos requeridos se describen en este diagrama de flujo:
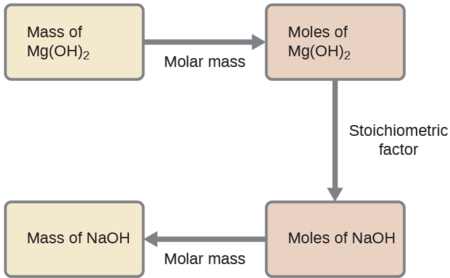
\[\mathrm{16\:\cancel{g\: Mg(OH)_2} \times \dfrac{1\:\cancel{mol\: Mg(OH)_2}}{58.3\:\cancel{g\: Mg(OH)_2}}\times \dfrac{2\:\cancel{mol\: NaOH}}{1\:\cancel{mol\: Mg(OH)_2}}\times \dfrac{40.0\: g\: NaOH}{\cancel{mol\: NaOH}}=22\: g\: NaOH} \nonumber \]
¿Qué masa de óxido de galio, Ga 2 O 3, se puede preparar a partir de 29.0 g de metal galio? La ecuación para la reacción es\(\ce{4Ga + 3O2 \rightarrow 2Ga2O3}\).
- Contestar
-
39.0 g
¿Qué masa de gas oxígeno, O 2, del aire se consume en la combustión de 702 g de octano, C 8 H 18, uno de los principales componentes de la gasolina?
\[\ce{2C8H18 + 25O2 \rightarrow 16CO2 + 18H2O} \nonumber \]
S olución
El enfoque aquí requerido es el mismo que para el Ejemplo\(\PageIndex{3}\), difiriendo sólo en que las masas proporcionadas y solicitadas son ambas para especies reaccionantes.
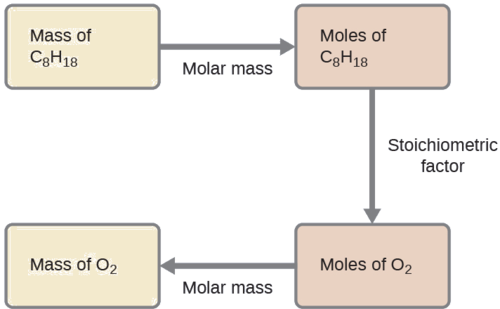
\(\mathrm{702\:\cancel{g\:\ce{C8H18}}\times \dfrac{1\:\cancel{mol\:\ce{C8H18}}}{114.23\:\cancel{g\:\ce{C8H18}}}\times \dfrac{25\:\cancel{mol\:\ce{O2}}}{2\:\cancel{mol\:\ce{C8H18}}}\times \dfrac{32.00\: g\:\ce{O2}}{\cancel{mol\:\ce{O2}}}=2.46\times 10^3\:g\:\ce{O2}}\)
¿Qué masa de CO se requiere para reaccionar con 25.13 g de Fe 2 O 3 según la ecuación\(\ce{Fe2O3 + 3CO \rightarrow 2Fe + 3CO2}\)?
- Contestar
-
13.22 g
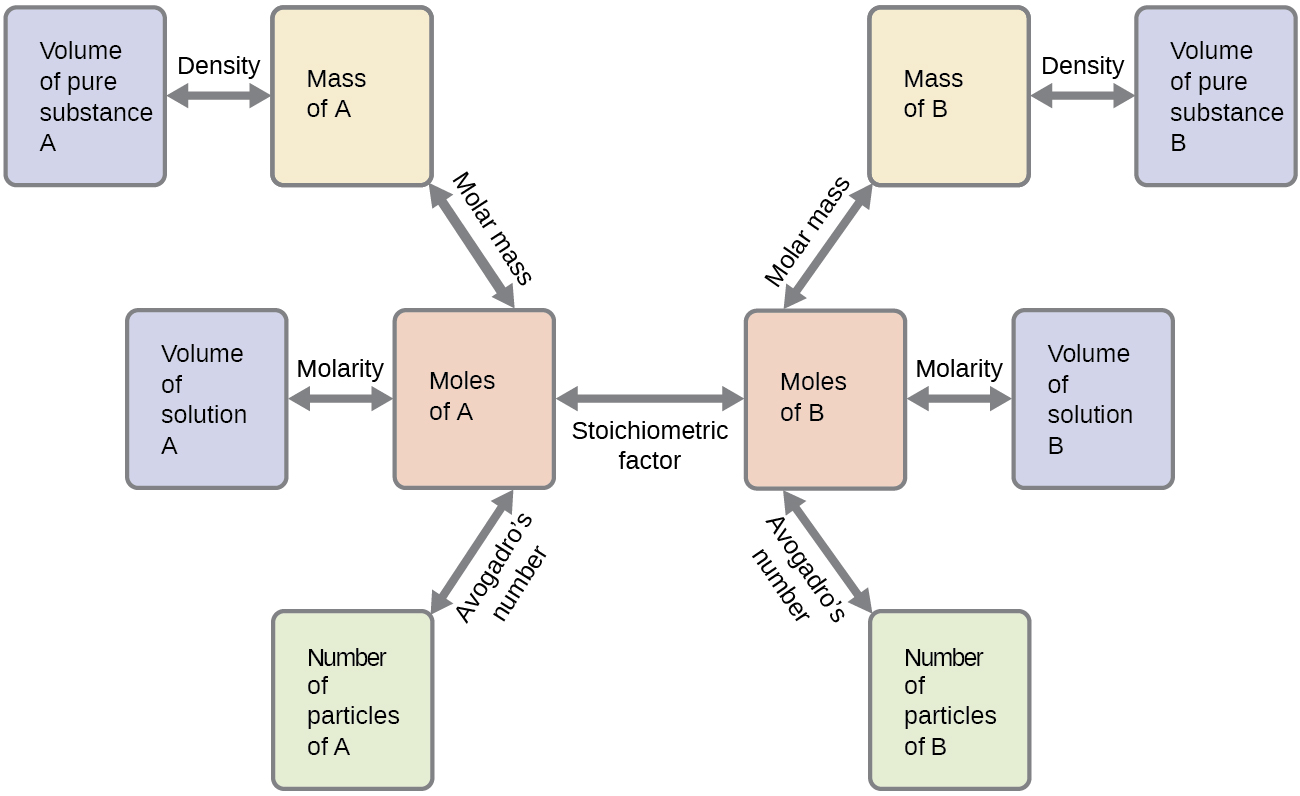
Estos ejemplos ilustran solo algunos casos de cálculos estequiométricos de reacción. Numerosas variaciones en los pasos computacionales iniciales y finales son posibles dependiendo de qué cantidades particulares se proporcionan y buscan (volúmenes, concentraciones de solución, etc.). Independientemente de los detalles, todos estos cálculos comparten un componente esencial común: el uso de factores estequiométricos derivados de ecuaciones químicas balanceadas. La Figura\(\PageIndex{2}\) proporciona un esquema general de las diversas etapas computacionales asociadas con muchos cálculos estequiométricos de reacción.
Los airbags (Figura\(\PageIndex{3}\)) son una característica de seguridad proporcionada en la mayoría de los automóviles desde la década de 1990. El funcionamiento efectivo de un airbag requiere que se infle rápidamente con una cantidad apropiada (volumen) de gas cuando el vehículo está involucrado en una colisión. Este requisito se satisface en muchos sistemas de airbag automotrices mediante el uso de reacciones químicas explosivas, siendo una opción común la descomposición de la azida sódica, NaN 3. Cuando los sensores en el vehículo detectan una colisión, se pasa una corriente eléctrica a través de una cantidad cuidadosamente medida de NaN 3 para iniciar su descomposición:
\[\ce{2NaN3}(s)\rightarrow \ce{3N2}(g)+\ce{2Na}(s) \nonumber \]
Esta reacción es muy rápida, generando nitrógeno gaseoso que puede desplegar e inflar completamente un airbag típico en una fracción de segundo (~0.03—0.1 s). Entre muchas consideraciones de ingeniería, la cantidad de azida sódica utilizada debe ser apropiada para generar suficiente gas nitrógeno para inflar completamente la bolsa de aire y asegurar su correcto funcionamiento. Por ejemplo, una pequeña masa (~100 g) de NaN 3 generará aproximadamente 50 L de N 2.

Resumen
Se puede usar una ecuación química equilibrada para describir la estequiometría de una reacción (las relaciones entre las cantidades de reactivos y productos). Los coeficientes de la ecuación se utilizan para derivar factores estequiométricos que posteriormente se pueden usar para cálculos relacionados con las masas de reactivos y productos, cantidades molares y otras propiedades cuantitativas.
Glosario
- factor estequiométrico
- relación de coeficientes en una ecuación química equilibrada, utilizada en cálculos que relacionan cantidades de reactivos y productos
- estequiometría
- relaciones entre las cantidades de reactivos y productos de una reacción química


