4.4: Rendimientos de reacción
- Page ID
- 75861
- Explicar los conceptos de rendimiento teórico y limitantes de reactantes/reactivos.
- Derivar el rendimiento teórico para una reacción en condiciones especificadas.
- Calcular el porcentaje de rendimiento para una reacción.
Las cantidades relativas de reactivos y productos representados en una ecuación química equilibrada a menudo se denominan cantidades estequiométricas. Todos los ejercicios del módulo anterior involucraron cantidades estequiométricas de reactivos. Por ejemplo, al calcular la cantidad de producto generado a partir de una cantidad dada de reactivo, se asumió que cualquier otro reactivo requerido estaba disponible en cantidades estequiométricas (o mayores). En este módulo se consideran situaciones más realistas, en las que los reactivos no están presentes en cantidades estequiométricas.
Reactivo limitante
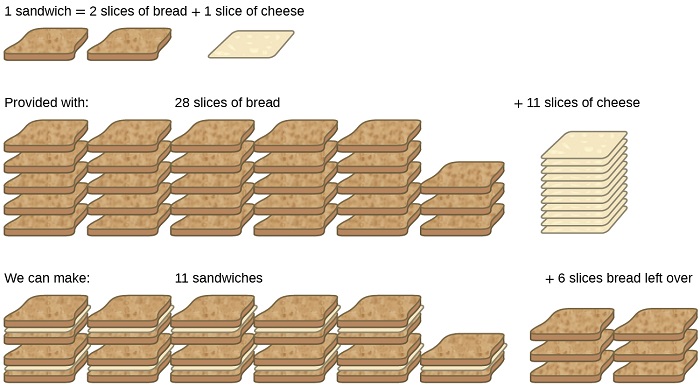
Considera otra analogía alimentaria, haciendo sándwiches de queso a la parrilla (Figura\(\PageIndex{1}\)):
\[\text{1 slice of cheese} + \text{2 slices of bread} \rightarrow \text{1 sandwich} \label{4.5.A} \]
Las cantidades estequiométricas de ingredientes para sándwich para esta receta son rebanadas de pan y queso en una proporción de 2:1. Con 28 rebanadas de pan y 11 rebanadas de queso, se pueden preparar 11 sándwiches por la receta proporcionada, utilizando todo el queso proporcionado y teniendo seis rebanadas de pan sobrantes. En este escenario, el número de sándwiches preparados se ha visto limitado por el número de rebanadas de queso, y las rebanadas de pan se han proporcionado en exceso.
Consideremos ahora este concepto con respecto a un proceso químico, la reacción del hidrógeno con el cloro para producir cloruro de hidrógeno:
\[\ce{H2}(g) + \ce{Cl2}(g)\rightarrow \ce{2HCl}(g) \nonumber \]
La ecuación equilibrada muestra que el hidrógeno y el cloro reaccionan en una relación estequiométrica 1:1. Si estos reactivos se proporcionan en cualquier otra cantidad, uno de los reactivos casi siempre se consumirá por completo, limitando así la cantidad de producto que se pueda generar. Esta sustancia es el reactivo limitante, y la otra sustancia es el reactivo en exceso. Identificar los reactivos limitantes y excesivos para una situación dada requiere calcular las cantidades molares de cada reactivo proporcionado y compararlas con las cantidades estequiométricas representadas en la ecuación química equilibrada.
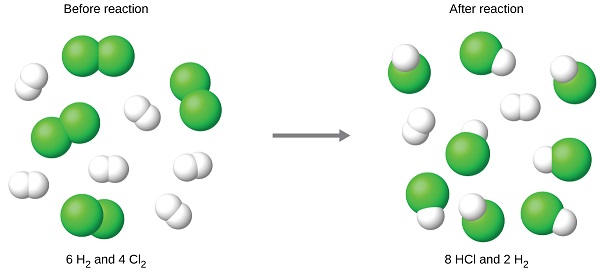
Por ejemplo, imagina combinar 6 moles de H 2 y 4 moles de Cl 2. Identificar el reactivo limitante implica comparar la cantidad de producto esperada para la reacción completa de cada reactivo. Cada cantidad de reactivo se usa para calcular por separado la cantidad de producto que se formaría según la estequiometría de la reacción. El reactivo que produce la menor cantidad de producto es el reactivo limitante.
Para el ejemplo del párrafo anterior, la reacción completa del hidrógeno produciría
\[\mathrm{mol\: HCl\: produced=6\: mol\:H_2\times \dfrac{2\: mol\: HCl}{1\: mol\:H_2}=12\: mol\: HCl} \nonumber \]
La reacción completa del cloro proporcionado produciría
\[\mathrm{mol\: HCl\: produced=4\: mol\:Cl_2\times \dfrac{2\: mol\: HCl}{1\: mol\:Cl_2}=8\: mol\: HCl} \nonumber \]
El cloro se consumirá completamente una vez que se hayan producido 8 moles de HCl. Dado que se proporcionó suficiente hidrógeno para producir 12 moles de HCl, quedará hidrógeno sin reaccionar una vez que se complete esta reacción. El cloro, por lo tanto, es el reactivo limitante y el hidrógeno es el reactivo en exceso (Figura\(\PageIndex{2}\)). Para determinar la cantidad de exceso de reactivo que queda, la cantidad de hidrógeno consumido en la reacción puede restarse de la cantidad inicial de hidrógeno.
La cantidad de hidrógeno consumido es
\[\mathrm{mol\: H_2\: produced=8\: mol\:HCl\times \dfrac{1\: mol\: H_2}{2\: mol\:HCl}=4\: mol\: H_2} \nonumber \]
Restar el hidrógeno consumido de la cantidad inicial
\[\mathrm{mole\: of\: excess\:H_{2}=6\:mol\:H_{2}\:starting\:-\:4\:mol\:H_{2}\:consumed\:=\:2\:mol\:H_{2}\; excess} \nonumber \]
El nitruro de silicio es una cerámica muy dura y resistente a altas temperaturas utilizada como componente de palas de turbina en motores a reacción. Se prepara de acuerdo con la siguiente ecuación:
\[\ce{3Si}(s)+\ce{2N2}(g)\rightarrow \ce{Si3N4}(s) \nonumber \]
¿Cuál es el reactivo limitante cuando reaccionan 2.00 g de Si y 1.50 g de N 2?
Solución
Calcule las cantidades molares proporcionadas de reactivos y luego compare estas cantidades con la ecuación equilibrada para identificar el reactivo limitante.
\[\mathrm{mol\: Si=2.00\:\cancel{g\: Si}\times \dfrac{1\: mol\: Si}{28.09\:\cancel{g\: Si}}=0.0712\: mol\: Si} \nonumber \]
\[\mathrm{mol\:N_2=1.50\:\cancel{g\:N_2}\times \dfrac{1\: mol\:N_2}{28.02\:\cancel{g\:N_2}}=0.0535\: mol\:N_2} \nonumber \]
La relación molar Si:N 2 proporcionada es:
\[\mathrm{\dfrac{0.0712\: mol\: Si}{0.0535\: mol\:N_2}=\dfrac{1.33\: mol\: Si}{1\: mol\:N_2}} \nonumber \]
La relación estequiométrica Si:N 2 es:
\[\mathrm{\dfrac{3\: mol\: Si}{2\: mol\:N_2}=\dfrac{1.5\: mol\: Si}{1\: mol\:N_2}} \nonumber \]
La comparación de estas proporciones muestra que el Si se proporciona en una cantidad menor que la estequiométrica, y así lo es el reactivo limitante.
Alternativamente, computar la cantidad de producto esperada para la reacción completa de cada uno de los reactivos proporcionados. Los 0.0712 moles de silicio producirían
\[\mathrm{mol\:Si_3N_4\:produced=0.0712\: mol\: Si\times \dfrac{1\:mol\:Si_3N_4}{3\: mol\: Si}=0.0237\: mol\:Si_3N_4} \nonumber \]
mientras que los 0.0535 moles de nitrógeno producirían
\[\mathrm{mol\:Si_3N_4\:produced=0.0535\: mol\:N_2\times \dfrac{1\: mol\:Si_3N_4}{2\: mol\:N_2}=0.0268\: mol\:Si_3N_4} \nonumber \]
Dado que el silicio produce la menor cantidad de producto, es el reactivo limitante.
¿Cuál es el reactivo limitante cuando 5.00 g de H 2 y 10.0 g de O 2 reaccionan y forman agua?
- Responder
-
O 2
Rendimiento porcentual
La cantidad de producto que se puede producir por una reacción en condiciones especificadas, según se calcula según la estequiometría de una ecuación química equilibrada apropiada, se denomina rendimiento teórico de la reacción. En la práctica, la cantidad de producto obtenido se denomina rendimiento real, y a menudo es menor que el rendimiento teórico por varias razones. Algunas reacciones son inherentemente ineficientes, estando acompañadas de reacciones secundarias que generan otros productos. Otros son, por naturaleza, incompletos (considere las reacciones parciales de ácidos débiles y bases discutidas anteriormente en este texto). Algunos productos son difíciles de recolectar sin alguna pérdida, por lo que una recuperación menos que perfecta reducirá el rendimiento real. El grado en que se alcanza el rendimiento teórico de una reacción se expresa comúnmente como su rendimiento porcentual:
\[\mathrm{percent\: yield=\dfrac{actual\: yield}{theoretical\: yield}\times 100\%} \nonumber \]
Los rendimientos reales y teóricos pueden expresarse como masas o cantidades molares (o cualquier otra propiedad apropiada; por ejemplo, volumen, si el producto es un gas). Siempre y cuando ambos rendimientos se expresen usando las mismas unidades, estas unidades se cancelarán cuando se calcule el rendimiento porcentual.
Al reaccionar 1.274 g de sulfato de cobre con exceso de zinc metálico, se obtuvieron 0.392 g de cobre metálico de acuerdo con la ecuación:
\[\ce{CuSO4}(aq)+\ce{Zn}(s)\rightarrow \ce{Cu}(s)+\ce{ZnSO4}(aq) \nonumber \]
¿Cuál es el porcentaje de rendimiento?
Solución
La información proporcionada identifica al sulfato de cobre como el reactivo limitante, por lo que el rendimiento teórico se encuentra mediante el enfoque ilustrado en el módulo anterior, como se muestra aquí:
\[\mathrm{1.274\:\cancel{g\:Cu_SO_4}\times \dfrac{1\:\cancel{mol\:CuSO_4}}{159.62\:\cancel{g\:CuSO_4}}\times \dfrac{1\:\cancel{mol\: Cu}}{1\:\cancel{mol\:CuSO_4}}\times \dfrac{63.55\:g\: Cu}{1\:\cancel{mol\: Cu}}=0.5072\: g\: Cu} \nonumber \]
Utilizando este rendimiento teórico y el valor proporcionado para el rendimiento real, se calcula que el rendimiento porcentual sea
\[\mathrm{percent\: yield=\left(\dfrac{actual\: yield}{theoretical\: yield}\right)\times 100} \nonumber \]
\ [\ begin {align*}
\ mathrm {por ciento\: rendimiento} &=\ mathrm {\ left (\ dfrac {0.392\: g\: Cu} {0.5072\: g\: Cu}\ derecha)\ times 100}\\
&=77,3\%
\ end {align*}\ nonumber\]
¿Cuál es el rendimiento porcentual de una reacción que produce 12.5 g del gas Freón CF 2 Cl 2 a partir de 32.9 g de CCl 4 y exceso de HF?
\[\ce{CCl4 + 2HF \rightarrow CF2Cl2 + 2HCl} \nonumber \]
- Responder
-
48.3%
El diseño intencionado de productos químicos y procesos que minimizan el uso de sustancias peligrosas para el medio ambiente y la generación de desechos se conoce como química verde. La química verde es un enfoque filosófico que se está aplicando a muchas áreas de la ciencia y la tecnología, y su práctica se resume mediante pautas conocidas como los “Doce Principios de la Química Verde”. Uno de los 12 principios está dirigido específicamente a maximizar la eficiencia de los procesos de síntesis de productos químicos. La economía atómico de un proceso es una medida de esta eficiencia, definida como el porcentaje en masa del producto final de una síntesis respecto a las masas de todos los reactivos utilizados:
\[\mathrm{atom\: economy=\dfrac{mass\: of\: product}{mass\: of\: reactants}\times 100\%} \nonumber \]
Aunque la definición de economía de átomos a primera vista parece muy similar a la del rendimiento porcentual, tenga en cuenta que esta propiedad representa una diferencia en las eficiencias teóricas de diferentes procesos químicos. El rendimiento porcentual de un proceso químico dado, por otro lado, evalúa la eficiencia de un proceso comparando el rendimiento de producto realmente obtenido con el rendimiento máximo predicho por estequiometría.
La síntesis del analgésico común de venta libre, ibuprofeno, ilustra muy bien el éxito de un enfoque de química verde (Figura\(\PageIndex{3}\)). Comercializado por primera vez a principios de la década de 1960, el ibuprofeno se produjo utilizando una síntesis de seis etapas que requirió 514 g de reactivos para generar cada mol (206 g) de ibuprofeno, una economía de átomos de 40%. En la década de 1990, la Compañía BHC (ahora BASF Corporation) desarrolló un proceso alternativo que solo requiere tres pasos y tiene una economía atómico de ~ 80%, casi el doble que el proceso original. El proceso BHC genera significativamente menos desechos químicos; utiliza materiales menos peligrosos y reciclables; y proporciona importantes ahorros de costos al fabricante (y, posteriormente, al consumidor). En reconocimiento al impacto ambiental positivo del proceso BHC, la compañía recibió el premio Greener Synthetic Pathways Award de la Agencia de Protección Ambiental en 1997.

Resumen
Cuando las reacciones se llevan a cabo usando cantidades menores que estequiométricas de reactivos, la cantidad de producto generado será determinada por el reactivo limitante. La cantidad de producto generado por una reacción química es su rendimiento real. Este rendimiento suele ser menor que la cantidad de producto predicha por la estequiometría de la ecuación química equilibrada que representa la reacción (su rendimiento teórico). El grado en que una reacción genera la cantidad teórica de producto se expresa como su rendimiento porcentual.
Ecuaciones Clave
- \(\mathrm{percent\: yield=\left(\dfrac{actual\: yield}{theoretical\: yield}\right)\times 100}\)
Glosario
- rendimiento real
- cantidad de producto formado en una reacción
- exceso de reactivo
- reactivo presente en una cantidad mayor que la requerida por la estequiometría de la reacción
- reactivo limitante
- reactivo presente en una cantidad inferior a la requerida por la estequiometría de reacción, limitando así la cantidad de producto generado
- porcentaje de rendimiento
- medida de la eficiencia de una reacción, expresada como porcentaje del rendimiento teórico
- rendimiento teórico
- cantidad de producto que se puede producir a partir de una cantidad dada de reactivo (s) de acuerdo con la estequiometría de la reacción


