8.1: Teoría de los Vínculos de Valencia
- Page ID
- 75178
- Describir la formación de enlaces covalentes en términos de superposición orbital atómica
- Definir y dar ejemplos de enlaces σ y π
Como sabemos, una teoría científica es una explicación fuertemente apoyada para las leyes naturales observadas o grandes cuerpos de datos experimentales. Para que una teoría sea aceptada, debe explicar datos experimentales y ser capaz de predecir el comportamiento. Por ejemplo, la teoría de VSEPR ha ganado una amplia aceptación porque predice formas moleculares tridimensionales que son consistentes con datos experimentales recopilados para miles de moléculas diferentes. Sin embargo, la teoría de VSEPR no proporciona una explicación de la unión química.
Existen teorías exitosas que describen la estructura electrónica de los átomos. Podemos usar la mecánica cuántica para predecir las regiones específicas alrededor de un átomo donde es probable que se localicen los electrones: una forma esférica para un orbital s, una forma de mancuerna para un orbital p, y así sucesivamente. Sin embargo, estas predicciones solo describen los orbitales alrededor de los átomos libres. Cuando los átomos se unen para formar moléculas, los orbitales atómicos no son suficientes para describir las regiones donde se ubicarán los electrones en la molécula. Una comprensión más completa de las distribuciones de electrones requiere un modelo que pueda dar cuenta de la estructura electrónica de las moléculas. Una teoría popular sostiene que un enlace covalente se forma cuando un par de electrones es compartido por dos átomos y es atraído simultáneamente por los núcleos de ambos átomos. En las siguientes secciones, discutiremos cómo se describen dichos enlaces mediante la teoría de enlaces de valencia y la hibridación.
La teoría del enlace de valencia describe un enlace covalente como la superposición de orbitales atómicos medio llenos (cada uno contiene un solo electrón) que producen un par de electrones compartidos entre los dos átomos unidos. Decimos que los orbitales en dos átomos diferentes se superponen cuando una porción de un orbital y una porción de un segundo orbital ocupan la misma región del espacio. De acuerdo con la teoría de enlaces de valencia, se produce un enlace covalente cuando se cumplen dos condiciones:
- un orbital en un átomo se solapa con un orbital en un segundo átomo y
- los electrones individuales en cada orbital se combinan para formar un par de electrones.
La atracción mutua entre este par de electrones cargados negativamente y los núcleos cargados positivamente de los dos átomos sirve para unir físicamente los dos átomos a través de una fuerza que definimos como un enlace covalente. La fuerza de un enlace covalente depende del grado de superposición de los orbitales involucrados. Los orbitales que se superponen ampliamente forman enlaces que son más fuertes que aquellos que tienen menos superposición.
La energía del sistema depende de cuánto se superpongan los orbitales. La figura\(\PageIndex{1}\) ilustra cómo la suma de las energías de dos átomos de hidrógeno (la curva coloreada) cambia a medida que se acercan entre sí. Cuando los átomos están muy separados no hay solapamiento, y por convención establecemos la suma de las energías en cero. A medida que los átomos se mueven juntos, sus orbitales comienzan a superponerse. Cada electrón comienza a sentir la atracción del núcleo en el otro átomo. Además, los electrones comienzan a repelerse entre sí, al igual que los núcleos. Si bien los átomos aún están ampliamente separados, las atracciones son ligeramente más fuertes que las repulsiones, y la energía del sistema disminuye. (Se empieza a formar un vínculo.) A medida que los átomos se acercan entre sí, el solapamiento aumenta, por lo que la atracción de los núcleos por los electrones continúa aumentando (al igual que las repulsiones entre electrones y entre los núcleos). A cierta distancia específica entre los átomos, que varía dependiendo de los átomos involucrados, la energía alcanza su valor más bajo (el más estable). Esta distancia óptima entre los dos núcleos unidos es la distancia de enlace entre los dos átomos. La unión es estable porque en este punto, las fuerzas atractivas y repulsivas se combinan para crear la configuración de energía más baja posible. Si la distancia entre los núcleos disminuyera aún más, las repulsiones entre núcleos y las repulsiones a medida que los electrones están confinados en una proximidad más cercana entre sí se volverían más fuertes que las fuerzas atractivas. La energía del sistema entonces se elevaría (haciendo que el sistema se desestabilizara), como se muestra en el extremo izquierdo de la Figura\(\PageIndex{1}\).
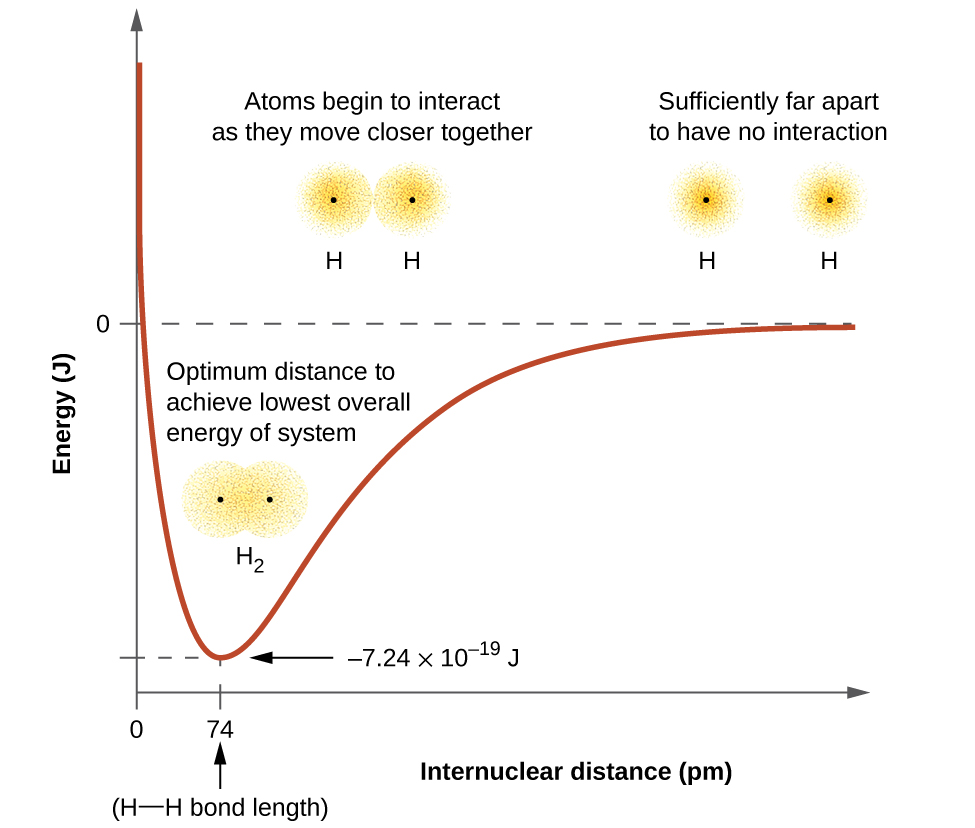
La energía de enlace es la diferencia entre el mínimo de energía (que ocurre a la distancia del enlace) y la energía de los dos átomos separados. Esta es la cantidad de energía liberada cuando se forma el enlace. Por el contrario, se requiere la misma cantidad de energía para romper el vínculo. Para la\(H_2\) molécula mostrada en la Figura\(\PageIndex{1}\), a la distancia de enlace de 74 pm el sistema es\(7.24 \times 10^{−19}\, J\) menor en energía que los dos átomos de hidrógeno separados. Esto puede parecer un número pequeño. Sin embargo, sabemos por nuestra descripción anterior de la termoquímica que las energías de enlace a menudo se discuten sobre una base por mol. Por ejemplo, requiere\(7.24 \times 10^{−19}\; J\) romper un enlace H-H, pero se necesita\(4.36 \times 10^5\; J\) romper 1 mol de enlaces H-H. Una comparación de algunas longitudes de enlace y energías se muestra en la Tabla\(\PageIndex{1}\). Podemos encontrar muchos de estos enlaces en una variedad de moléculas, y esta tabla proporciona valores promedio. Por ejemplo, romper el primer enlace C—H en CH4 requiere 439.3 kJ/mol, mientras que romper el primer enlace C—H en\(\ce{H–CH2C6H5}\) (un diluyente de pintura común) requiere 375.5 kJ/mol.
| Bond | Longitud (pm) | Energía (kJ/mol) | Bond | Longitud (pm) | Energía (kJ/mol) | |
|---|---|---|---|---|---|---|
| H—H | 74 | 436 | C—O | 140.1 | 358 | |
| H—C | 106.8 | 413 | \(\mathrm{C=O}\) | 119.7 | 745 | |
| H—N | 101.5 | 391 | \(\mathrm{C≡O}\) | 113.7 | 1072 | |
| H—O | 97.5 | 467 | H—Cl | 127.5 | 431 | |
| C—C | 150.6 | 347 | H—Br | 141.4 | 366 | |
| \(\mathrm{C=C}\) | 133.5 | 614 | H—I | 160.9 | 298 | |
| \(\mathrm{C≡C}\) | 120.8 | 839 | O—O | 148 | 146 | |
| C—N | 142.1 | 305 | \(\mathrm{O=O}\) | 120.8 | 498 | |
| \(\mathrm{C=N}\) | 130.0 | 615 | F—F | 141.2 | 159 | |
| \(\mathrm{C≡N}\) | 116.1 | 891 | Cl—Cl | 198.8 | 243 |
Además de la distancia entre dos orbitales, la orientación de los orbitales también afecta su superposición (que no sea para orbitales de dos s, que son esféricamente simétricos). Es posible una mayor superposición cuando los orbitales están orientados de tal manera que se superponen en una línea directa entre los dos núcleos. La figura\(\PageIndex{2}\) ilustra esto para dos orbitales p de diferentes átomos; el solapamiento es mayor cuando los orbitales se superponen de extremo a extremo en lugar de hacerlo en ángulo.
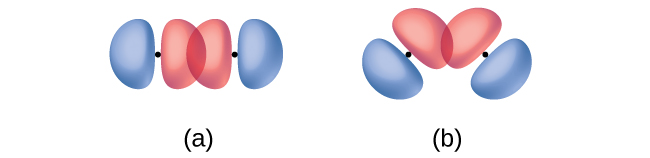
La superposición de dos orbitales s (como en H 2), la superposición de una órbita s y una orbital p (como en HCl), y la superposición de extremo a extremo de dos orbitales p (como en Cl 2) producen todos enlaces sigma (enlaces σ), como se ilustra en la Figura \(\PageIndex{3}\). Un enlace σ es un enlace covalente en el que la densidad de electrones se concentra en la región a lo largo del eje internuclear; es decir, una línea entre los núcleos pasaría por el centro de la región de superposición. Los enlaces simples en las estructuras de Lewis se describen como enlaces σ en la teoría de enlaces de valencia.
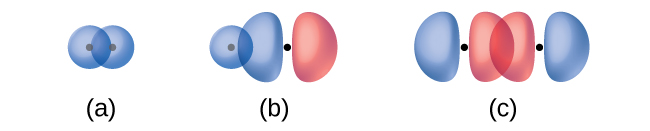
Un enlace pi (enlace π) es un tipo de enlace covalente que resulta del solapamiento lado a lado de dos orbitales p, como se ilustra en la Figura\(\PageIndex{4}\). En un enlace π, las regiones de superposición orbital se encuentran en lados opuestos del eje internuclear. A lo largo del eje mismo, hay un nodo, es decir, un plano sin probabilidad de encontrar un electrón.
 "style="ancho: 325px; alto: 115px;” width="325px” height="115px” src=”/@api /deki/files/56400/CNX_Chem_08_01_pi.jpg “>
"style="ancho: 325px; alto: 115px;” width="325px” height="115px” src=”/@api /deki/files/56400/CNX_Chem_08_01_pi.jpg “>
Mientras que todos los enlaces simples son enlaces σ, los enlaces múltiples consisten en enlaces σ y π. Como sugieren las estructuras de Lewis, O 2 contiene un doble enlace y N 2 contiene un triple enlace. El doble enlace consiste en un enlace σ y un enlace π, y el triple enlace consiste en un enlace σ y dos enlaces π. Entre dos átomos cualesquiera, el primer enlace formado siempre será un enlace σ, pero solo puede haber un enlace σ en cualquier ubicación. En cualquier enlace múltiple, habrá un enlace σ, y los restantes uno o dos enlaces serán enlaces π. Estos bonos se describen con más detalle más adelante en este capítulo.
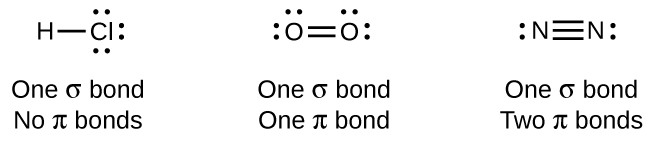
Como se ve en la Tabla\(\PageIndex{1}\), un enlace sencillo carbono-carbono promedio es 347 kJ/mol, mientras que en un doble enlace carbono-carbono, el enlace π aumenta la fuerza del enlace en 267 kJ/mol. Agregar un enlace π adicional provoca un aumento adicional de 225 kJ/mol. Podemos ver un patrón similar cuando comparamos otros enlaces σ y π. Así, cada enlace π individual es generalmente más débil que un enlace σ correspondiente entre los mismos dos átomos. En un enlace σ, hay un mayor grado de superposición orbital que en un enlace π.
El butadieno, C 4 H 6, se utiliza para fabricar caucho sintético. Identificar el número de enlaces σ y π contenidos en esta molécula.
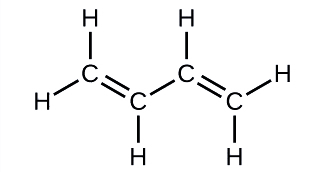
Solución
Hay seis enlaces σ C—H y un enlace σ C—C, para un total de siete de los enlaces sencillos. Hay dos dobles enlaces que tienen cada uno un enlace π además del enlace σ. Esto da un total de nueve enlaces σ y dos π en general.
Identificar cada ilustración como que representa un enlace σ o π:
- solapamiento lado a lado de una órbita de 4 p y 2 p
- superposición de extremo a extremo de una órbita de 4 p y 4 p
- superposición de extremo a extremo de una órbita de 4 p y una 2 p
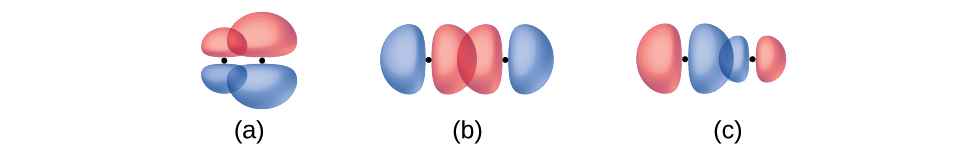
- Contestar
-
(a) es un enlace π con un nodo a lo largo del eje que conecta los núcleos mientras que (b) y (c) son enlaces σ que se superponen a lo largo del eje.
Resumen
La teoría del enlace de valencia describe la unión como consecuencia de la superposición de dos orbitales atómicos separados en diferentes átomos que crea una región con un par de electrones compartidos entre los dos átomos. Cuando los orbitales se superponen a lo largo de un eje que contiene los núcleos, forman un enlace σ. Cuando se superponen de una manera que crea un nodo a lo largo de este eje, forman un enlace π.
Glosario
- solapamiento
- coexistencia de orbitales de dos átomos diferentes que comparten la misma región del espacio, lo que lleva a la formación de un enlace covalente
- nodo
- plano que separa diferentes lóbulos de orbitales, donde la probabilidad de encontrar un electrón es cero
- enlace pi (enlace π)
- enlace covalente formado por solapamiento lado a lado de orbitales atómicos; la densidad electrónica se encuentra en lados opuestos del eje internuclear
- enlace sigma (enlace σ)
- enlace covalente formado por superposición de orbitales atómicos a lo largo del eje internuclear
- teoría de los bonos de valencia
- descripción de la unión que implica que los orbitales atómicos se superponen para formar enlaces σ o π, dentro de los cuales se comparten pares de electrones


