8.2: Orbitales Atómicos Híbridos
- Page ID
- 75188
- Explicar el concepto de hibridación orbital atómica
- Determinar los orbitales híbridos asociados con diversas geometrías moleculares
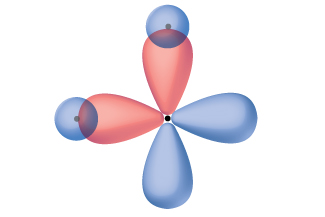
Pensar en términos de orbitales atómicos superpuestos es una forma de explicar cómo se forman los enlaces químicos en las moléculas diatómicas. Sin embargo, para entender cómo las moléculas con más de dos átomos forman enlaces estables, se requiere un modelo más detallado. Como ejemplo, consideremos la molécula de agua, en la que tenemos un átomo de oxígeno enlazando a dos átomos de hidrógeno. El oxígeno tiene la configuración electrónica 1 s 2 2 s 2 2 p 4, con dos electrones desapareados (uno en cada uno de los dos orbitales de 2 p). La teoría de los enlaces de valencia predeciría que los dos enlaces O-H se forman a partir de la superposición de estos dos orbitales de 2 p con los orbitales de 1 s de los átomos de hidrógeno. Si este fuera el caso, el ángulo de unión sería de 90°, como se muestra en la Figura\(\PageIndex{1}\), porque p orbitales son perpendiculares entre sí. La evidencia experimental muestra que el ángulo de unión es de 104.5°, no 90°. La predicción del modelo de teoría de enlaces de valencia no coincide con las observaciones del mundo real de una molécula de agua; se necesita un modelo diferente.
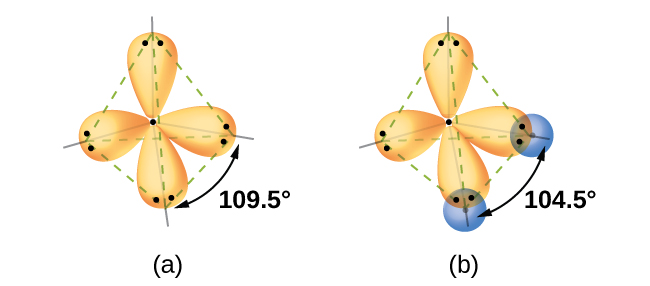
Los cálculos cuántico-mecánicos sugieren por qué los ángulos de enlace observados en H 2 O difieren de los predichos por la superposición de la órbita de 1 s de los átomos de hidrógeno con los orbitales 2 p del átomo de oxígeno. La expresión matemática conocida como la función de onda, ψ, contiene información sobre cada orbital y las propiedades ondulares de los electrones en un átomo aislado. Cuando los átomos están unidos en una molécula, las funciones de onda se combinan para producir nuevas descripciones matemáticas que tienen diferentes formas. Este proceso de combinación de las funciones de onda para orbitales atómicos se llama hibridación y se logra matemáticamente por la combinación lineal de orbitales atómicos, LCAO, (una técnica que volveremos a encontrar más adelante). Los nuevos orbitales que resultan se denominan orbitales híbridos. Los orbitales de valencia en un átomo de oxígeno aislado son orbitales de 2 s y tres orbitales de 2 p. Los orbitales de valencia en un átomo de oxígeno en una molécula de agua difieren; consisten en cuatro orbitales híbridos equivalentes que apuntan aproximadamente hacia las esquinas de un tetraedro (Figura\(\PageIndex{2}\)). En consecuencia, el solapamiento de los orbitales O y H debería dar como resultado un ángulo de enlace tetraédrico (109.5°). El ángulo observado de 104.5° es evidencia experimental para la cual los cálculos cuántico-mecánicos dan una explicación útil: la teoría del enlace de valencia debe incluir un componente de hibridación para dar predicciones precisas.
Las siguientes ideas son importantes para entender la hibridación:
- Los orbitales híbridos no existen en átomos aislados. Se forman únicamente en átomos unidos covalentemente.
- Los orbitales híbridos tienen formas y orientaciones muy diferentes a las de los orbitales atómicos en átomos aislados.
- Se genera un conjunto de orbitales híbridos combinando orbitales atómicos. El número de orbitales híbridos en un conjunto es igual al número de orbitales atómicos que se combinaron para producir el conjunto.
- Todos los orbitales en un conjunto de orbitales híbridos son equivalentes en forma y energía.
- El tipo de orbitales híbridos formados en un átomo unido depende de su geometría de pares de electrones según lo predicho por la teoría VSEPR.
- Los orbitales híbridos se superponen para formar enlaces σ. Los orbitales no hibridadas se superponen para formar enlaces π.
En las siguientes secciones, discutiremos los tipos comunes de orbitales híbridos.
sp Hibridación
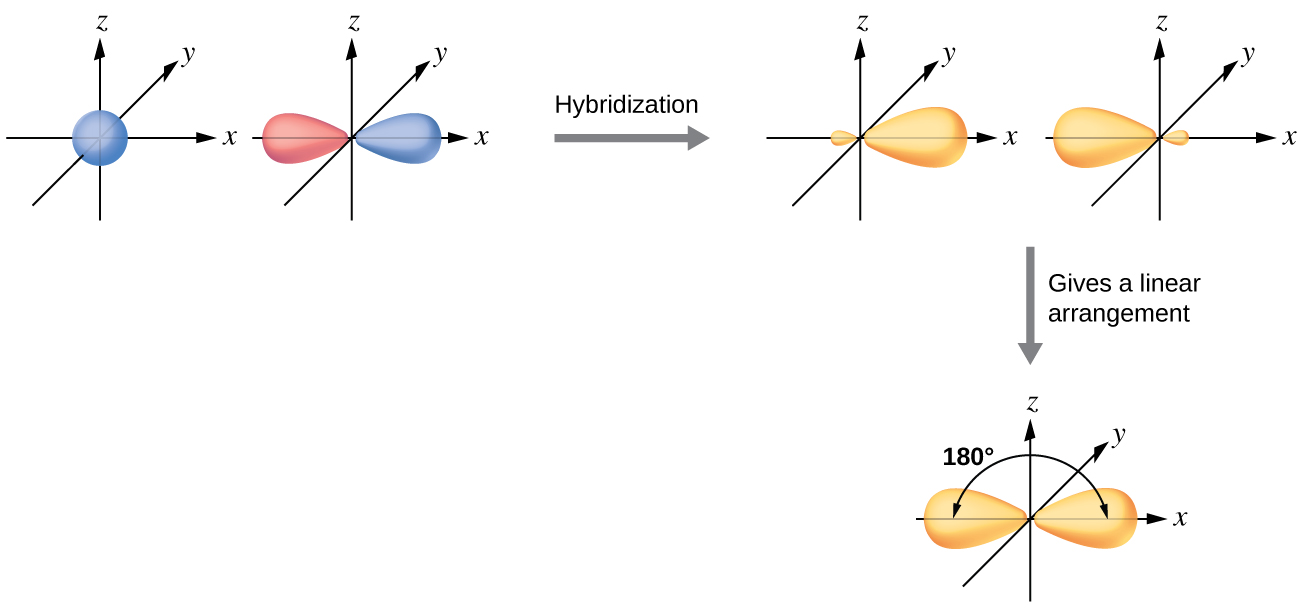
El átomo de berilio en una molécula BeCl 2 gaseosa es un ejemplo de un átomo central sin pares solitarios de electrones en una disposición lineal de tres átomos. Hay dos regiones de densidad electrónica de valencia en la molécula BeCl 2 que corresponden a los dos enlaces covalentes Be—Cl. Para acomodar estos dos dominios de electrones, dos de los cuatro orbitales de valencia del átomo Be se mezclarán para producir dos orbitales híbridos. Este proceso de hibridación implica la mezcla del orbital de valencia con uno de los orbitales de valencia p para producir dos orbitales híbridos sp equivalentes que están orientados en una geometría lineal (Figura\(\PageIndex{3}\)). En esta figura, el conjunto de orbitales sp parece similar en forma al orbital p original, pero hay una diferencia importante. El número de orbitales atómicos combinados siempre es igual al número de orbitales híbridos formados. El orbital p es uno orbital que puede contener hasta dos electrones. El conjunto sp es de dos orbitales equivalentes que apuntan 180° entre sí. Los dos electrones que originalmente estaban en el orbital s ahora se distribuyen a los dos orbitales sp, que están medio llenos. En BeCl 2 gaseoso, estos orbitales híbridos semillenos se superpondrán con orbitales de los átomos de cloro para formar dos enlaces σ idénticos.
Ilustramos las diferencias electrónicas en un átomo de Be aislado y en el átomo Be enlazado en el diagrama orbital de nivel de energía en la Figura\(\PageIndex{4}\). Estos diagramas representan cada orbital por una línea horizontal (indicando su energía) y cada electrón por una flecha. La energía aumenta hacia la parte superior del diagrama. Usamos una flecha hacia arriba para indicar un electrón en un orbital y dos flechas (arriba y abajo) para indicar dos electrones de espín opuesto.
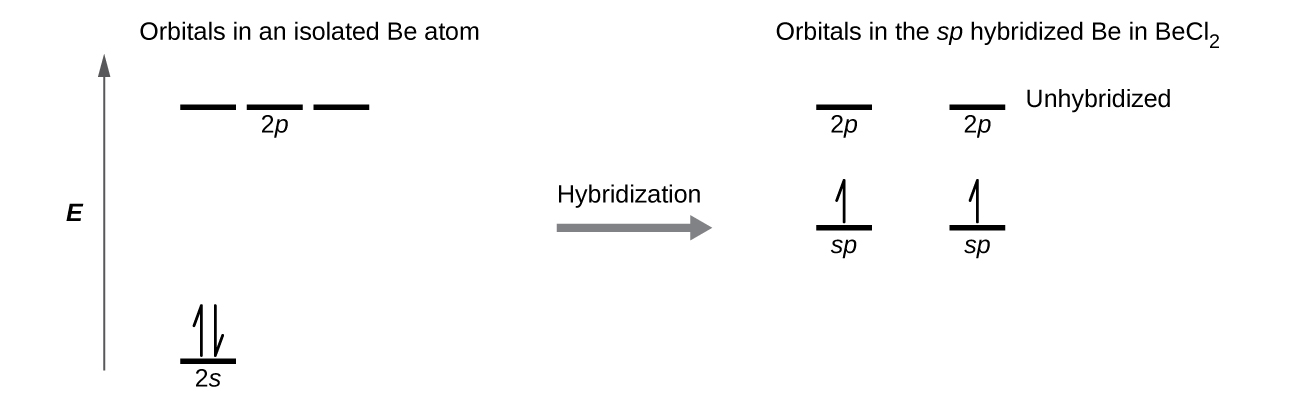
Cuando los orbitales atómicos se hibridan, los electrones de valencia ocupan los orbitales recién creados. El átomo Be tenía dos electrones de valencia, por lo que cada uno de los orbitales sp obtiene uno de estos electrones. Cada uno de estos electrones se empareja con el electrón desapareado en un átomo de cloro cuando un orbital híbrido y un orbital de cloro se superponen durante la formación de los enlaces Be-Cl. Cualquier átomo central rodeado por solo dos regiones de densidad electrónica de valencia en una molécula exhibirá hibridación sp. Otros ejemplos incluyen el átomo de mercurio en la molécula lineal de HgCl 2, el átomo de zinc en Zn (CH 3) 2, que contiene una disposición lineal C—Zn-C, y los átomos de carbono en HCCH y CO 2.
sp 2 Hibridación
Los orbitales de valencia de un átomo central rodeado por tres regiones de densidad electrónica consisten en un conjunto de tres orbitales híbridos sp 2 y un orbital p no hibridado. Esta disposición resulta de la hibridación sp 2, la mezcla de orbitales uno s y dos orbitales p para producir tres orbitales híbridos idénticos orientados en una geometría plana trigonal (Figura\(\PageIndex{5}\)).
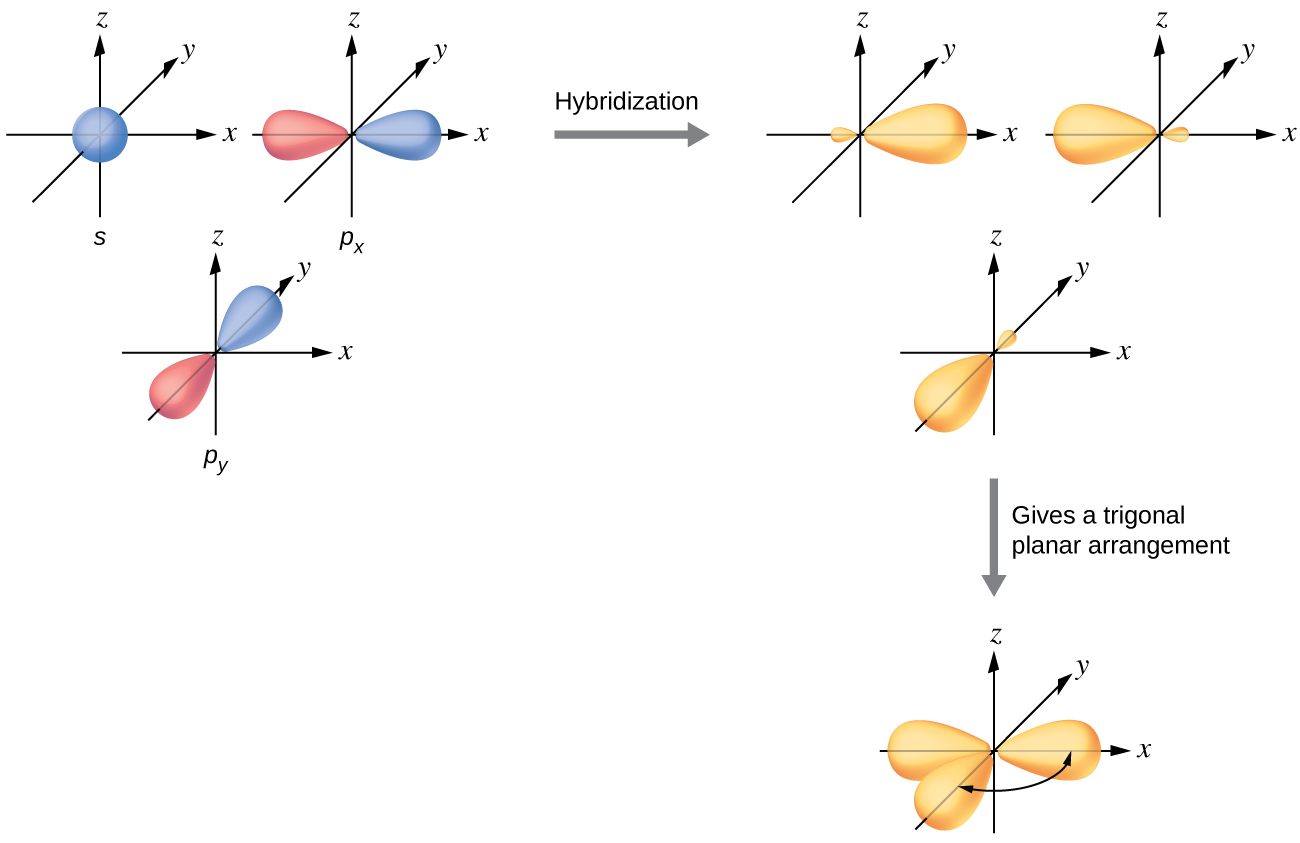
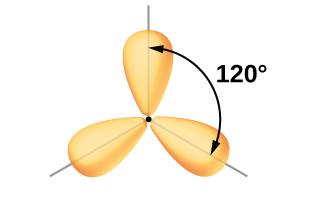
Aunque la mecánica cuántica produce los lóbulos orbitales “regordetes” como se representa en la Figura\(\PageIndex{5}\), a veces para mayor claridad estos orbitales se dibujan más delgados y sin los lóbulos menores\(\PageIndex{6}\), como en la Figura, para evitar oscurecer otras características de una ilustración dada. Utilizaremos estas representaciones “más delgadas” siempre que la vista verdadera esté demasiado abarrotada para visualizarla fácilmente.
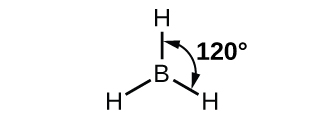
La estructura observada de la molécula de borano, BH 3, sugiere hibridación sp 2 para boro en este compuesto. La molécula es plana trigonal, y el átomo de boro está involucrado en tres enlaces a átomos de hidrógeno (Figura\(\PageIndex{7}\)).
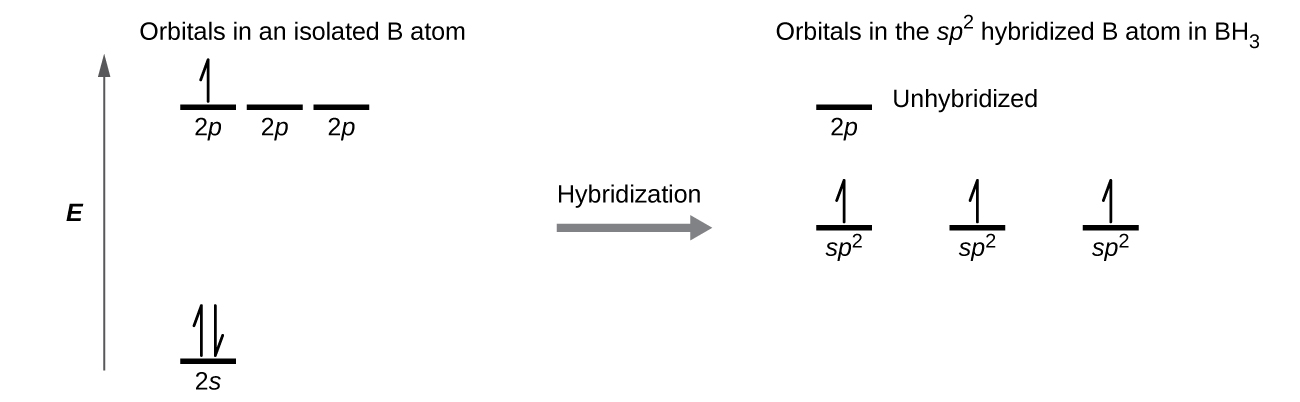
Podemos ilustrar la comparación de orbitales y distribución de electrones en un átomo de boro aislado y en el átomo unido en BH 3 como se muestra en el diagrama de nivel de energía orbital en la Figura\(\PageIndex{8}\). Redistribuimos los tres electrones de valencia del átomo de boro en los tres orbitales híbridos sp 2, y cada uno de los pares de electrones de boro con un electrón de hidrógeno cuando se forman enlaces B—H.
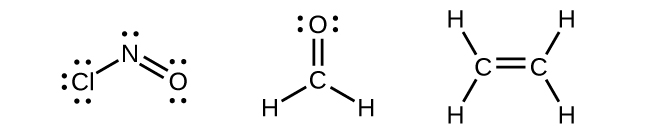
Cualquier átomo central rodeado por tres regiones de densidad electrónica exhibirá hibridación sp 2. Esto incluye moléculas con un par solitario en el átomo central, como ClnO (Figura\(\PageIndex{9}\)), o moléculas con dos enlaces simples y un doble enlace conectados al átomo central, como en formaldehído, CH 2 O, y eteno, H 2 CCH 2.
sp 3 Hibridación
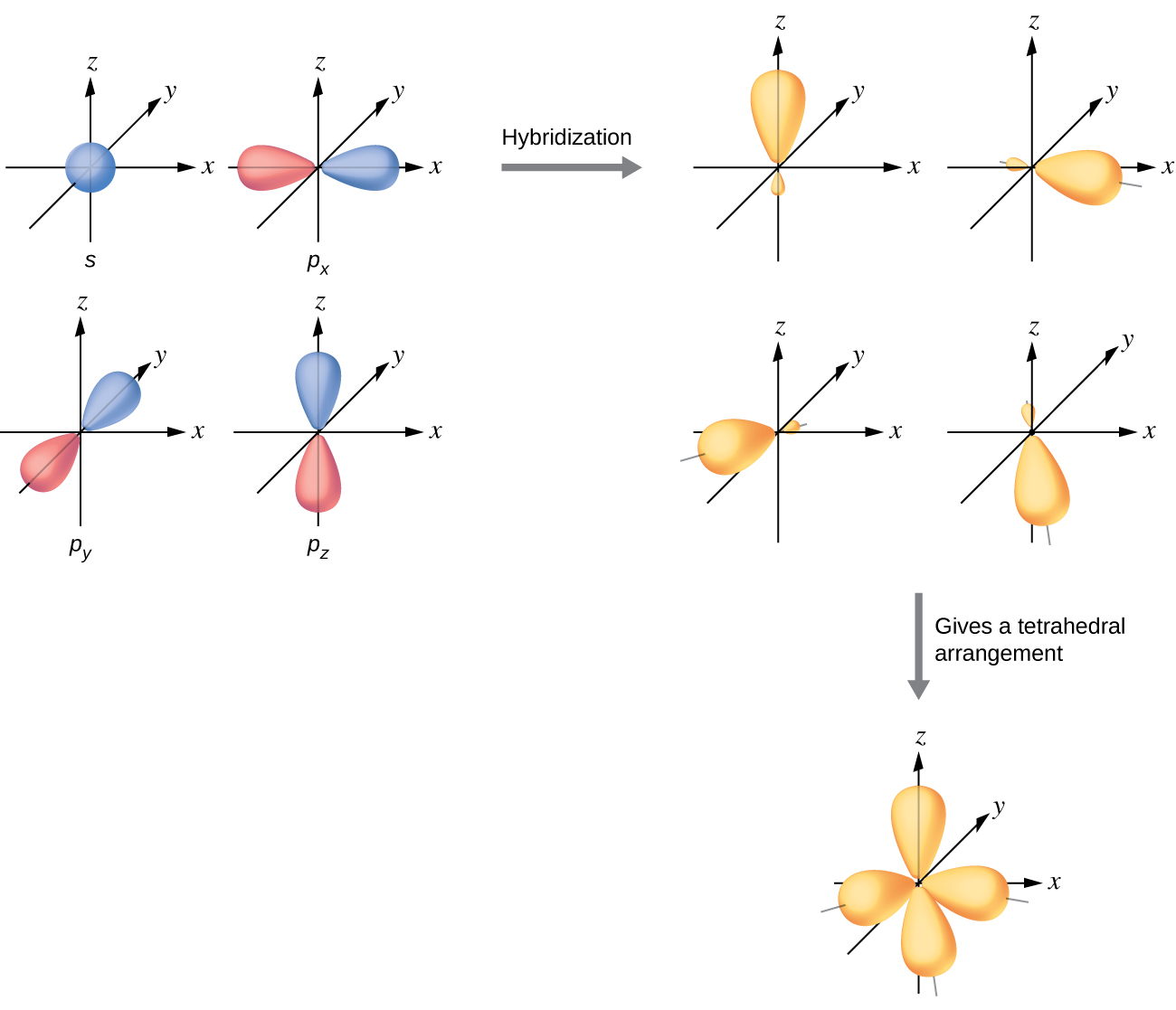
Los orbitales de valencia de un átomo rodeado por una disposición tetraédrica de pares de unión y pares solitarios consisten en un conjunto de cuatro orbitales híbridos sp 3. Los híbridos son el resultado de la mezcla de orbitales uno s y los tres orbitales p, lo que produce cuatro orbitales híbridos sp 3 idénticos (Figura\(\PageIndex{10}\)). Cada uno de estos orbitales híbridos apunta hacia una esquina diferente de un tetraedro.
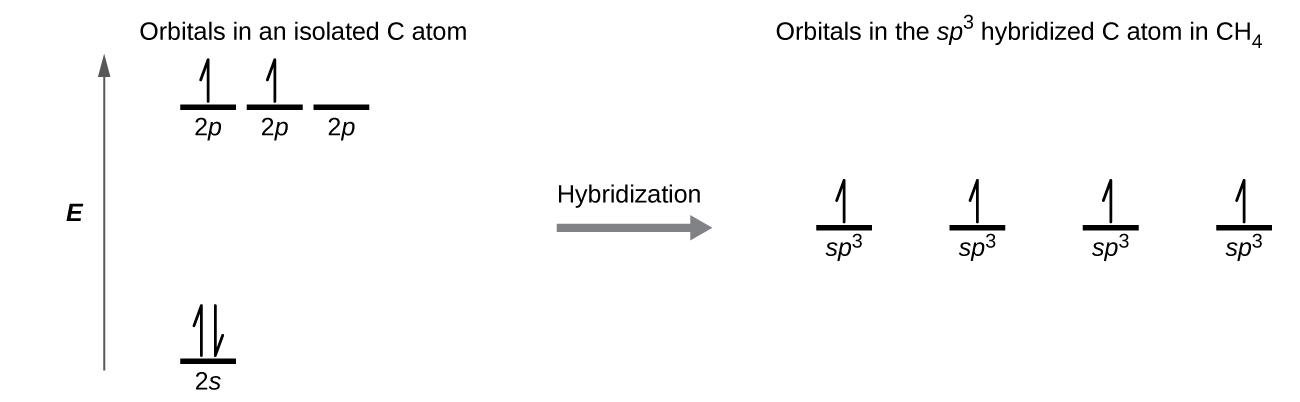
Una molécula de metano, CH 4, consiste en un átomo de carbono rodeado por cuatro átomos de hidrógeno en las esquinas de un tetraedro. El átomo de carbono en metano exhibe hibridación sp 3. Ilustramos los orbitales y la distribución de electrones en un átomo de carbono aislado y en el átomo unido en CH 4 en la Figura\(\PageIndex{11}\). Los cuatro electrones de valencia del átomo de carbono se distribuyen por igual en los orbitales híbridos, y cada electrón de carbono se empareja con un electrón de hidrógeno cuando se forman los enlaces C-H.
En una molécula de metano, el orbital de 1 s de cada uno de los cuatro átomos de hidrógeno se solapa con uno de los cuatro orbitales sp 3 del átomo de carbono para formar un enlace sigma (σ). Esto da como resultado la formación de cuatro enlaces covalentes fuertes y equivalentes entre el átomo de carbono y cada uno de los átomos de hidrógeno para producir la molécula de metano, CH 4.
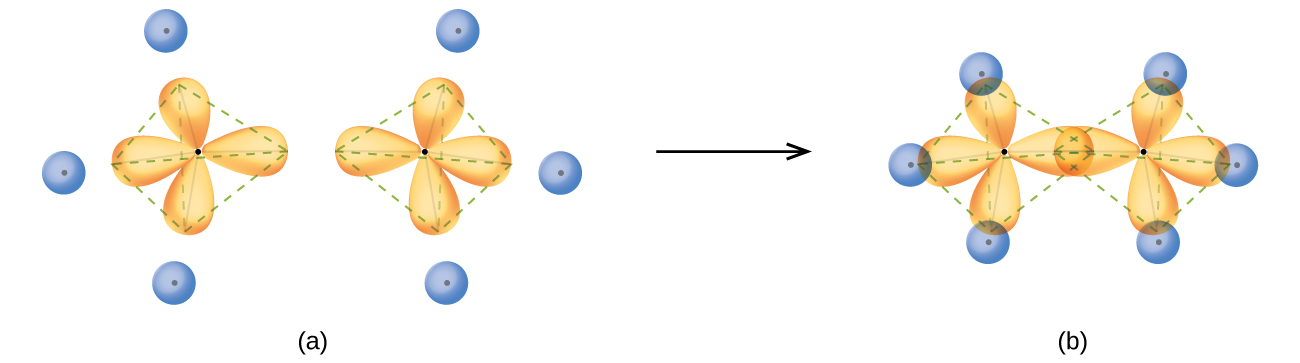
La estructura del etano, C 2 H 6, es similar a la del metano en que cada carbono del etano tiene cuatro átomos vecinos dispuestos en las esquinas de un tetraedro, tres átomos de hidrógeno y un átomo de carbono (Figura\(\PageIndex{10}\)). Sin embargo, en etano un orbital sp 3 de un átomo de carbono se solapa de extremo a extremo con un orbital sp 3 de un segundo átomo de carbono para formar un enlace σ entre los dos átomos de carbono. Cada uno de los orbitales híbridos sp 3 restantes se superpone con un orbital s de un átomo de hidrógeno para formar enlaces σ carbono-hidrógeno. La estructura y el esquema general de los orbitales de unión del etano se muestran en la Figura\(\PageIndex{12}\). La orientación de los dos grupos CH 3 no es fija entre sí. La evidencia experimental muestra que la rotación alrededor de los enlaces σ ocurre fácilmente.
Un orbital híbrido sp 3 también puede contener un par solitario de electrones. Por ejemplo, el átomo de nitrógeno en el amoníaco está rodeado por tres pares de enlace y un par solitario de electrones dirigidos a las cuatro esquinas de un tetraedro. El átomo de nitrógeno es sp 3 hibridado con un orbital híbrido ocupado por el par solitario.
La estructura molecular del agua es consistente con una disposición tetraédrica de dos pares solitarios y dos pares de electrones de unión. Así decimos que el átomo de oxígeno es sp 3 hibridado, con dos de los orbitales híbridos ocupados por pares solitarios y dos por pares de unión. Dado que los pares solitarios ocupan más espacio que los pares de unión, las estructuras que contienen pares solitarios tienen ángulos de unión ligeramente distorsionados con respecto al ideal. Los tetraedros perfectos tienen ángulos de 109.5°, pero los ángulos observados en amoníaco (107.3°) y agua (104.5°) son ligeramente menores. Otros ejemplos de hibridación sp 3 incluyen CCl 4, pCl 3 y NCl 3.
sp 3 d y sp 3 d 2 Hibridación
Para describir los cinco orbitales de unión en una disposición bipiramidal trigonal, debemos usar cinco de los orbitales atómicos de concha de valencia (el orbital s, los tres orbitales p y uno de los orbitales d), lo que da cinco sp 3 d orbitales híbridos. Con una disposición octaédrica de seis orbitales híbridos, debemos usar seis orbitales atómicos de concha de valencia (el orbital s, los tres orbitales p y dos de los orbitales d en su caparazón de valencia), lo que da seis sp 3 d 2 orbitales híbridos. Estas hibridaciones sólo son posibles para átomos que tienen d orbitales en sus subconchas de valencia (es decir, no las del primer o segundo periodo).

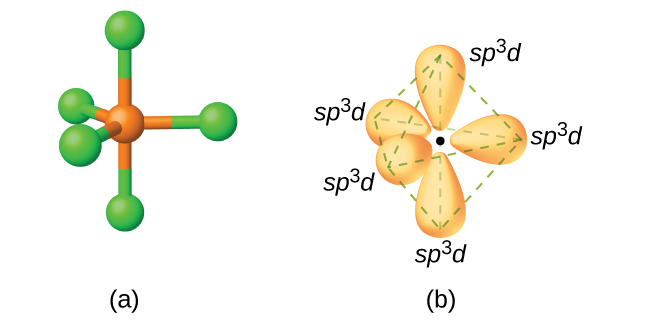
En una molécula de pentacloruro de fósforo, PCl 5, hay cinco enlaces P—Cl (así cinco pares de electrones de valencia alrededor del átomo de fósforo) dirigidos hacia las esquinas de una bipirámide trigonal. Utilizamos el orbital de 3 s, los tres orbitales de 3 p y uno de los orbitales de 3 d para formar el conjunto de cinco orbitales híbridos sp 3 d (Figura\(\PageIndex{13}\)) que están involucrados en los enlaces P—Cl. Otros átomos que exhiben hibridación sp 3 d incluyen el átomo de azufre en SF 4 y los átomos de cloro en ClF 3 y en\(\ce{ClF4+}\). (Los electrones en los átomos de flúor se omiten para mayor claridad).
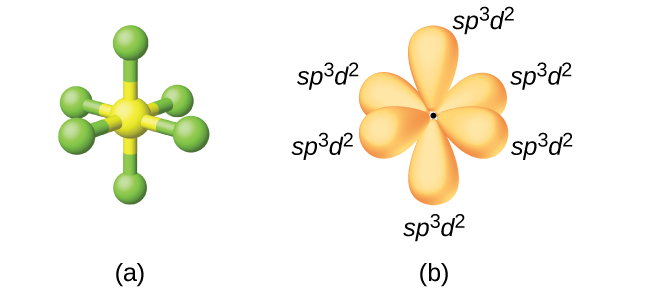
El átomo de azufre en hexafluoruro de azufre, SF 6, exhibe hibridación sp 3 d 2. Una molécula de hexafluoruro de azufre tiene seis pares de electrones que conectan seis átomos de flúor a un solo átomo de azufre. No hay pares solitarios de electrones en el átomo central. Para unir seis átomos de flúor, el orbital de 3 s, los tres orbitales de 3 p y dos de los orbitales de 3 d forman seis orbitales híbridos equivalentes sp 3 d 2, cada uno dirigido hacia una esquina diferente de un octaedro. Otros átomos que exhiben hibridación sp 3 d 2 incluyen el átomo de fósforo en\(\ce{PCl6-}\), el átomo de yodo en los interhalógenos\(\ce{IF6+}\), IF 5\(\ce{ICl4-}\),\(\ce{IF4-}\) y el átomo de xenón en xEF 4.
Asignación de orbitales híbridos a átomos centrales
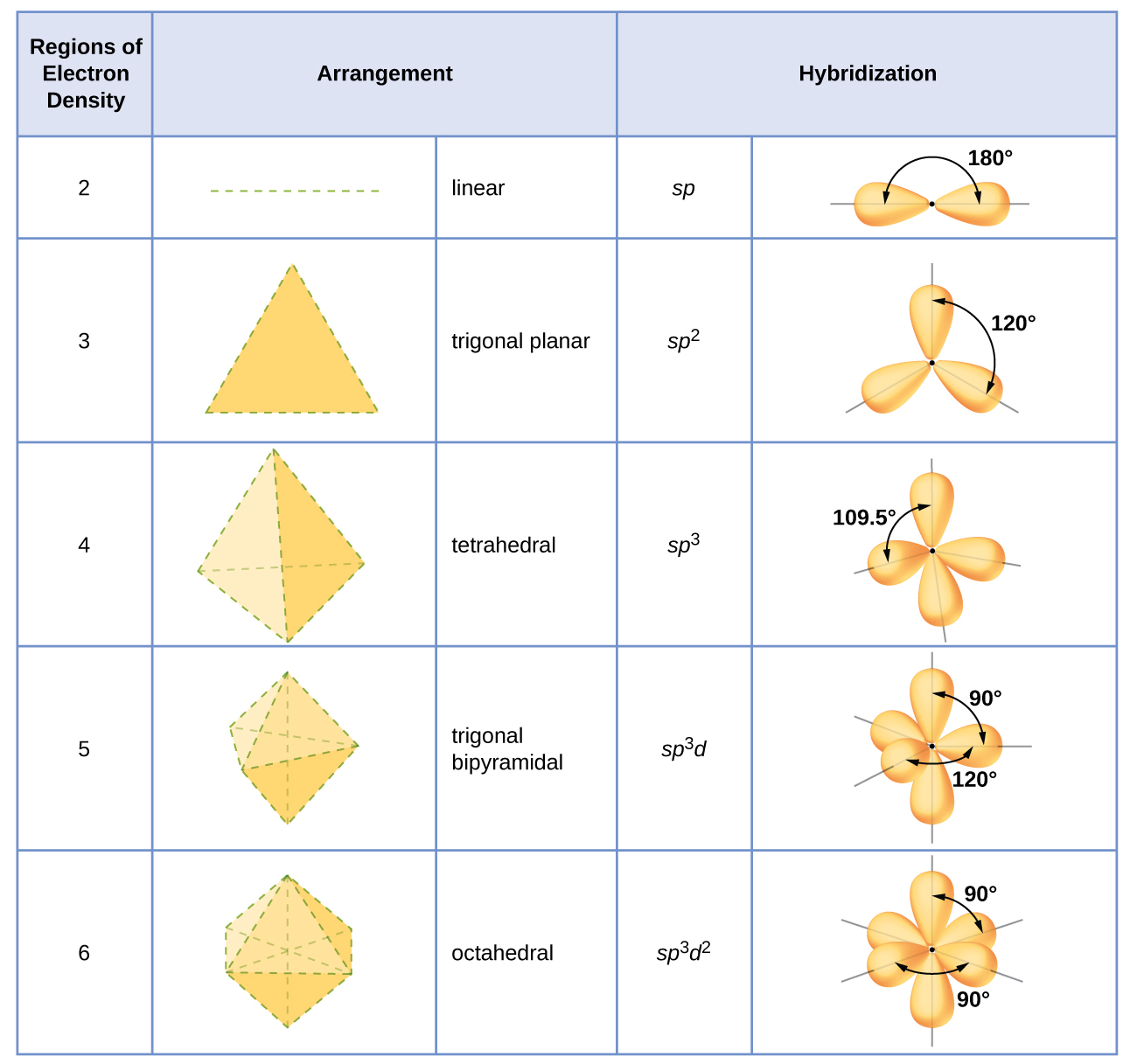
La hibridación de un átomo se determina con base en el número de regiones de densidad electrónica que lo rodean. Los arreglos geométricos característicos de los diversos conjuntos de orbitales híbridos se muestran en la Figura\(\PageIndex{16}\). Estas disposiciones son idénticas a las de las geometrías de pares de electrones predichas por la teoría VSEPR. La teoría VSEPR predice las formas de las moléculas, y la teoría orbital híbrida proporciona una explicación de cómo se forman esas formas. Para encontrar la hibridación de un átomo central, podemos usar las siguientes pautas:
- Determinar la estructura de Lewis de la molécula.
- Determinar el número de regiones de densidad electrónica alrededor de un átomo usando la teoría VSEPR, en la que los enlaces simples, enlaces múltiples, radicales y pares solitarios cuentan cada uno como una región.
- Asignar el conjunto de orbitales hibridados de la Figura\(\PageIndex{16}\) que corresponde a esta geometría.
Es importante recordar que la hibridación se ideó para racionalizar las geometrías moleculares observadas experimentalmente, no al revés.
El modelo funciona bien para moléculas que contienen pequeños átomos centrales, en las que los pares de electrones de valencia están muy cerca en el espacio. Sin embargo, para átomos centrales más grandes, los pares de electrones de valencia-cubierta están más lejos del núcleo, y hay menos repulsiones. Sus compuestos exhiben estructuras que a menudo no son consistentes con la teoría de VSEPR, y los orbitales hibridados no son necesarios para explicar los datos observados.
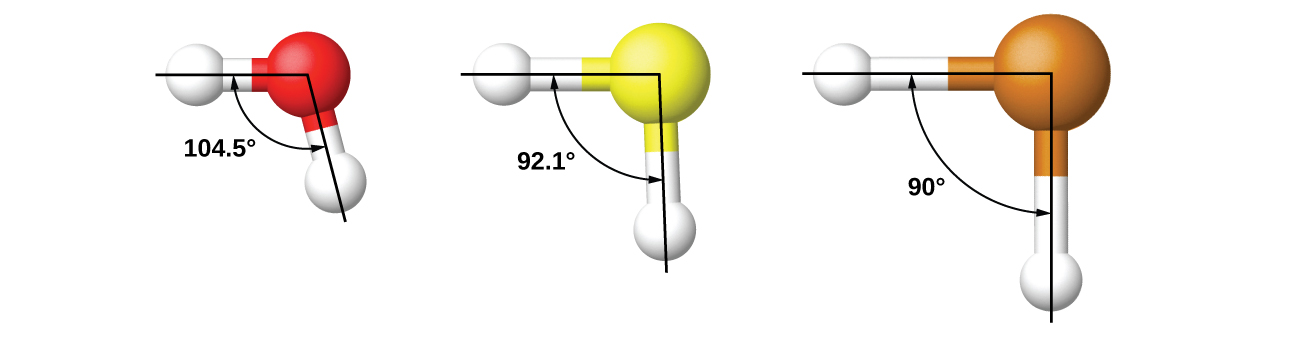
Por ejemplo, hemos discutido el ángulo de enlace H-O-H en H 2 O, 104.5°, el cual es más consistente con orbitales híbridos sp 3 (109.5°) en el átomo central que con orbitales 2 p (90°). El azufre está en el mismo grupo que el oxígeno, y H 2 S tiene una estructura similar de Lewis. Sin embargo, tiene un ángulo de enlace mucho menor (92.1°), lo que indica mucha menos hibridación en azufre que en oxígeno. Continuando abajo del grupo, el teluro es incluso mayor que el azufre, y para H 2 Te, el ángulo de enlace observado (90°) es consistente con el solapamiento de los orbitales de 5 p, sin invocar hibridación. Se invoca la hibridación donde es necesario explicar las estructuras observadas.
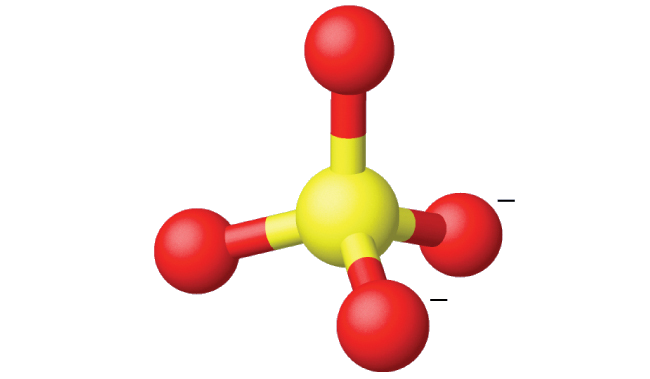
Ammonium sulfate is important as a fertilizer. What is the hybridization of the sulfur atom in the sulfate ion, \(\ce{SO4^2-}\)?
Solution
The Lewis structure of sulfate shows there are four regions of electron density.
What is the hybridization of the selenium atom in SeF4?
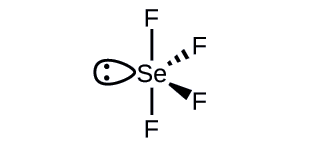
- Answer
-
The selenium atom is sp3d hybridized.
Urea, NH2C(O)NH2, is sometimes used as a source of nitrogen in fertilizers. What is the hybridization of each nitrogen and carbon atom in urea?
Solution
The Lewis structure of urea is
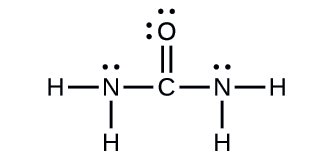
The carbon atom is surrounded by three regions of electron density, positioned in a trigonal planar arrangement. The hybridization in a trigonal planar electron pair geometry is sp2 (Figure \(\PageIndex{16}\)), which is the hybridization of the carbon atom in urea.
Acetic acid, H3CC(O)OH, is the molecule that gives vinegar its odor and sour taste. What is the hybridization of the two carbon atoms in acetic acid?
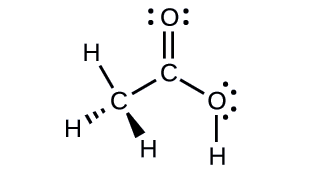
- Answer
-
H3C, sp3; C(O)OH, sp2
Summary
We can use hybrid orbitals, which are mathematical combinations of some or all of the valence atomic orbitals, to describe the electron density around covalently bonded atoms. These hybrid orbitals either form sigma (σ) bonds directed toward other atoms of the molecule or contain lone pairs of electrons. We can determine the type of hybridization around a central atom from the geometry of the regions of electron density about it. Two such regions imply sp hybridization; three, sp2 hybridization; four, sp3 hybridization; five, sp3d hybridization; and six, sp3d2 hybridization. Pi (π) bonds are formed from unhybridized atomic orbitals (p or d orbitals).
Footnotes
- Note that orbitals may sometimes be drawn in an elongated “balloon” shape rather than in a more realistic “plump” shape in order to make the geometry easier to visualize.
Glossary
- hybrid orbital
- orbital created by combining atomic orbitals on a central atom
- hybridization
- model that describes the changes in the atomic orbitals of an atom when it forms a covalent compound
- sp hybrid orbital
- one of a set of two orbitals with a linear arrangement that results from combining one s and one p orbital
- sp2 hybrid orbital
- one of a set of three orbitals with a trigonal planar arrangement that results from combining one s and two p orbitals
- sp3 hybrid orbital
- one of a set of four orbitals with a tetrahedral arrangement that results from combining one s and three p orbitals
- sp3d hybrid orbital
- one of a set of five orbitals with a trigonal bipyramidal arrangement that results from combining one s, three p, and one d orbital
- sp3d2 hybrid orbital
- one of a set of six orbitals with an octahedral arrangement that results from combining one s, three p, and two d orbitals


