9.5: La teoría cinético-molecular
- Page ID
- 75802
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)- Indicar los postulados de la teoría cinético-molecular
- Utilizar los postulados de esta teoría para explicar las leyes del gas
Las leyes de gas que hemos visto hasta este punto, así como la ecuación ideal del gas, son empíricas, es decir, se han derivado de observaciones experimentales. Las formas matemáticas de estas leyes describen de cerca el comportamiento macroscópico de la mayoría de los gases a presiones menores de aproximadamente 1 o 2 atm. Si bien las leyes de gas describen relaciones que han sido verificadas por muchos experimentos, no nos dicen por qué los gases siguen estas relaciones.
La teoría molecular cinética (KMT) es un modelo microscópico simple que explica efectivamente las leyes de gases descritas en módulos anteriores de este capítulo. Esta teoría se basa en los siguientes cinco postulados aquí descritos. (Nota: El término “molécula” se utilizará para referirse a las especies químicas individuales que componen el gas, aunque algunos gases están compuestos por especies atómicas, por ejemplo, los gases nobles.)
- Los gases están compuestos por moléculas que están en continuo movimiento, viajando en líneas rectas y cambiando de dirección solo cuando chocan con otras moléculas o con las paredes de un contenedor.
- Las moléculas que componen el gas son insignificantemente pequeñas en comparación con las distancias entre ellas.
- La presión ejercida por un gas en un contenedor es el resultado de colisiones entre las moléculas de gas y las paredes del contenedor.
- Las moléculas de gas no ejercen fuerzas atractivas ni repulsivas entre sí ni sobre las paredes del contenedor; por lo tanto, sus colisiones son elásticas (no implican pérdida de energía).
- La energía cinética promedio de las moléculas de gas es proporcional a la temperatura Kelvin del gas.
La prueba del KMT y sus postulados es su capacidad para explicar y describir el comportamiento de un gas. Las diversas leyes de gas pueden derivarse de los supuestos del KMT, que han llevado a los químicos a creer que los supuestos de la teoría representan con precisión las propiedades de las moléculas de gas. Primero veremos las leyes individuales de gas (las leyes de Boyle, Charles, Amontons, Avogadro y Dalton) conceptualmente para ver cómo las explica el KMT. Luego, consideraremos más cuidadosamente las relaciones entre las masas moleculares, las velocidades y las energías cinéticas con la temperatura, y explicaremos la ley de Graham.
La Teoría Cinético-Molecular Explica el Comportamiento de los Gases, Parte I
Recordando que la presión del gas es ejercida por moléculas de gas que se mueven rápidamente y depende directamente del número de moléculas que golpean una unidad de área de la pared por unidad de tiempo, vemos que el KMT explica conceptualmente el comportamiento de un gas de la siguiente manera:
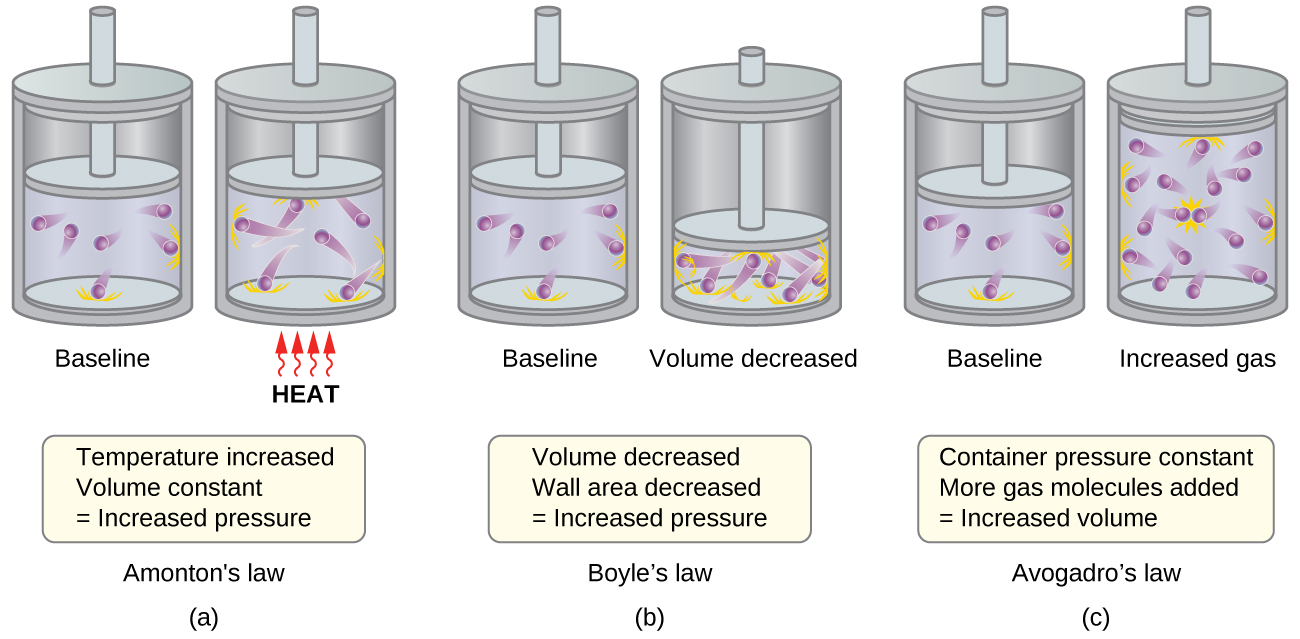
- Ley de Amontons. Si se incrementa la temperatura, la velocidad promedio y la energía cinética de las moléculas de gas aumentan. Si el volumen se mantiene constante, el aumento de la velocidad de las moléculas de gas resulta en colisiones más frecuentes y más contundentes con las paredes del contenedor, aumentando así la presión (Figura\(\PageIndex{1a}\)).
- La ley de Carlos. Si se aumenta la temperatura de un gas, se podrá mantener una presión constante solo si aumenta el volumen ocupado por el gas. Esto dará como resultado mayores distancias promedio recorridas por las moléculas para llegar a las paredes del contenedor, así como una mayor superficie de la pared. Estas condiciones disminuirán tanto la frecuencia de colisiones molécula-pared como el número de colisiones por unidad de área, cuyos efectos combinados equilibran el efecto del aumento de las fuerzas de colisión debido a la mayor energía cinética a la temperatura más alta.
- Ley de Boyle. Si se disminuye el volumen de gas, disminuye el área de la pared del contenedor y aumenta la frecuencia de colisión molécula-pared, ambas aumentan la presión ejercida por el gas (Figura\(\PageIndex{1b}\)).
- Ley de Avogadro. A presión y temperatura constantes, la frecuencia y la fuerza de las colisiones molécula-pared son constantes. En tales condiciones, aumentar el número de moléculas gaseosas requerirá un aumento proporcional en el volumen del contenedor para producir una disminución en el número de colisiones por unidad de área para compensar el aumento de la frecuencia de colisiones (Figura\(\PageIndex{1c}\)).
- Ley de Dalton. Debido a las grandes distancias entre ellos, las moléculas de un gas en una mezcla bombardean las paredes del contenedor con la misma frecuencia estén presentes o no otros gases, y la presión total de una mezcla de gases es igual a la suma de las presiones (parciales) de los gases individuales.
Velocidades Moleculares y Energía Cinética
La discusión anterior mostró que el KMT explica cualitativamente los comportamientos descritos por las diversas leyes de gas. Los postulados de esta teoría pueden ser aplicados de manera más cuantitativa para derivar estas leyes individuales. Para ello, primero debemos mirar las velocidades y energías cinéticas de las moléculas de gas, y la temperatura de una muestra de gas.
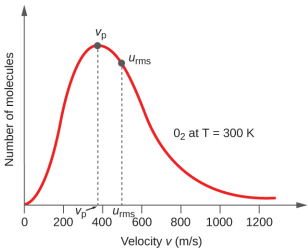
En una muestra de gas, las moléculas individuales tienen velocidades muy variables; sin embargo, debido a la gran cantidad de moléculas y colisiones involucradas, la distribución de la velocidad molecular y la velocidad promedio son constantes. Esta distribución de velocidad molecular se conoce como una distribución de Maxwell-Boltzmann, y representa el número relativo de moléculas en una muestra masiva de gas que posee una velocidad dada (Figura\(\PageIndex{2}\)).
La energía cinética (KE) de una partícula de masa (m) y velocidad (u) viene dada por:
\[\ce{KE}=\dfrac{1}{2}mu^2 \nonumber \]
Expresar masa en kilogramos y velocidad en metros por segundo producirá valores energéticos en unidades de julios (J = kg m 2 s —2). Para tratar un gran número de moléculas de gas, utilizamos promedios tanto para la velocidad como para la energía cinética. En el KMT, la velocidad media cuadrática de una partícula, u rms, se define como la raíz cuadrada del promedio de los cuadrados de las velocidades con n = el número de partículas:
\[u_\ce{rms}=\sqrt{\overline{u^2}}=\sqrt{\dfrac{u^2_1+u^2_2+u^2_3+u^2_4+…}{n}} \nonumber \]
La energía cinética promedio, KE avg, es entonces igual a:
\[\mathrm{KE_{avg}}=\dfrac{1}{2}mu^2_\ce{rms} \nonumber \]
El promedio KE de una colección de moléculas de gas también es directamente proporcional a la temperatura del gas y puede describirse mediante la ecuación:
\[\mathrm{KE_{avg}}=\dfrac{3}{2}RT \nonumber \]
donde R es la constante del gas y T es la temperatura Kelvin. Cuando se usa en esta ecuación, la forma apropiada de la constante de gas es 8.314 J mol -1 K -1 (8.314 kg m 2 s — 2 mol -1 K —1). Estas dos ecuaciones separadas para KE avg pueden combinarse y reorganizarse para producir una relación entre la velocidad molecular y la temperatura:
\[\dfrac{1}{2}mu^2_\ce{rms}=\dfrac{3}{2}RT \nonumber \]
\[u_\ce{rms}=\sqrt{\dfrac{3RT}{m}} \label{RMS} \]
Calcular la velocidad cuadrática media para una molécula de nitrógeno a 30 °C.
Solución
Convierte la temperatura en Kelvin:
\[30°C+273=303\: K \nonumber \]
Determinar la masa de una molécula de nitrógeno en kilogramos:
\[\mathrm{\dfrac{28.0\cancel{g}}{1\: mol}×\dfrac{1\: kg}{1000\cancel{g}}=0.028\:kg/mol} \nonumber \]
Reemplazar las variables y constantes en la fórmula de velocidad cuadrática media (Ecuación\ ref {RMS}), reemplazando Julios por el equivalente kg m 2 s —2:
\[ \begin{align*} u_\ce{rms} &= \sqrt{\dfrac{3RT}{m}} \\ u_\ce{rms} &=\sqrt{\dfrac{3(8.314\:J/mol\: K)(303\: K)}{(0.028\:kg/mol)}} \\ &=\sqrt{2.70 \times 10^5\:m^2s^{−2}} \\ &= 519\:m/s \end{align*} \nonumber \]
Calcular la velocidad cuadrática media para una molécula de oxígeno a —23 °C.
- Contestar
-
441 m/s
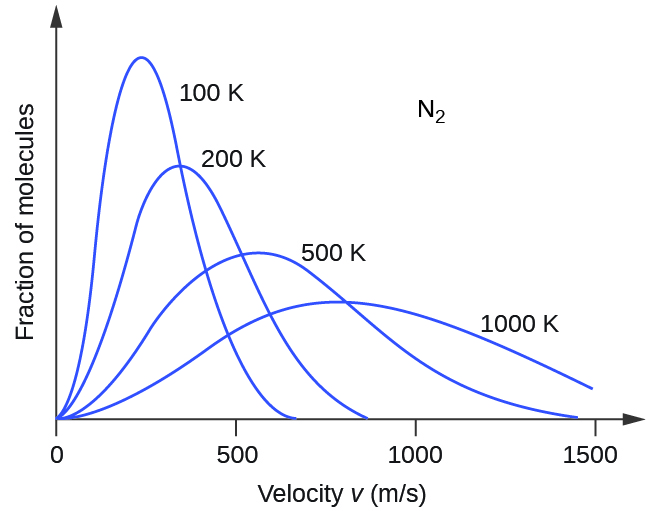
Si la temperatura de un gas aumenta, su promedio KE aumenta, más moléculas tienen velocidades más altas y menos moléculas tienen velocidades más bajas, y la distribución se desplaza hacia velocidades más altas en general, es decir, hacia la derecha. Si la temperatura disminuye, el promedio de KE disminuye, más moléculas tienen velocidades más bajas y menos moléculas tienen velocidades más altas, y la distribución se desplaza hacia velocidades más bajas en general, es decir, hacia la izquierda. Este comportamiento se ilustra para el gas nitrógeno en la Figura\(\PageIndex{3}\).
A una temperatura dada, todos los gases tienen el mismo promedio KE para sus moléculas. Los gases compuestos por moléculas más ligeras tienen partículas de mayor velocidad y una mayor u rms, con una distribución de velocidad que alcanza su punto máximo a velocidades relativamente más altas. Los gases que consisten en moléculas más pesadas tienen más partículas de baja velocidad, una u rms más baja y una distribución de velocidad que alcanza su punto máximo a velocidades relativamente más bajas. Esta tendencia se demuestra por los datos de una serie de gases nobles que se muestran en la Figura\(\PageIndex{4}\).

El simulador de gas puede ser utilizado para examinar el efecto de la temperatura sobre las velocidades moleculares. Examine los “histogramas de energía” del simulador (distribuciones de velocidad molecular) y la “información de especies” (que da valores de velocidad promedio) para moléculas de diferentes masas a diversas temperaturas.
La Teoría Cinético-Molecular Explica el Comportamiento de los Gases, Parte II
Según la ley de Graham, las moléculas de un gas están en rápido movimiento y las moléculas en sí son pequeñas. La distancia promedio entre las moléculas de un gas es grande en comparación con el tamaño de las moléculas. Como consecuencia, las moléculas de gas pueden pasar entre sí fácilmente y difundirse a velocidades relativamente rápidas.
La tasa de derrame de un gas depende directamente de la velocidad (promedio) de sus moléculas:
\[\textrm{effusion rate} ∝ u_\ce{rms} \nonumber \]
Usando esta relación, y la ecuación que relaciona la velocidad molecular con la masa, la ley de Graham puede derivarse fácilmente como se muestra aquí:
\[u_\ce{rms}=\sqrt{\dfrac{3RT}{m}} \nonumber \]
\[m=\dfrac{3RT}{u^2_\ce{rms}}=\dfrac{3RT}{\overline{u}^2} \nonumber \]
\[\mathrm{\dfrac{effusion\: rate\: A}{effusion\: rate\: B}}=\dfrac{u_\mathrm{rms\:A}}{u_\mathrm{rms\:B}}=\dfrac{\sqrt{\dfrac{3RT}{m_\ce{A}}}}{\sqrt{\dfrac{3RT}{m_\ce{B}}}}=\sqrt{\dfrac{m_\ce{B}}{m_\ce{A}}} \nonumber \]
La relación de las tasas de derrame se deriva así para ser inversamente proporcional a la relación de las raíces cuadradas de sus masas. Esta es la misma relación observada experimentalmente y expresada como la ley de Graham.
Resumen
La teoría molecular cinética es un modelo simple pero muy efectivo que explica de manera efectiva el comportamiento ideal del gas. La teoría asume que los gases consisten en moléculas ampliamente separadas de volumen insignificante que se encuentran en constante movimiento, colisionando elásticamente entre sí y las paredes de su contenedor con velocidades promedio determinadas por sus temperaturas absolutas. Las moléculas individuales de un gas exhiben un rango de velocidades, dependiendo la distribución de estas velocidades de la temperatura del gas y de la masa de sus moléculas.
Ecuaciones Clave
- \(u_\ce{rms}=\sqrt{\overline{u^2}}=\sqrt{\dfrac{u^2_1+u^2_2+u^2_3+u^2_4+…}{n}}\)
- \(\mathrm{KE_{avg}}=\dfrac{3}{2}RT\)
- \(u_\ce{rms}=\sqrt{\dfrac{3RT}{m}}\)
Resumen
- teoría molecular cinética
- teoría basada en principios y suposiciones simples que explican de manera efectiva el comportamiento ideal del gas
- velocidad media cuadrática de la raíz (u rms)
- medida de la velocidad promedio para un grupo de partículas calculada como la raíz cuadrada de la velocidad cuadrada promedio


