12.1: Tasas de reacción química
- Page ID
- 75457
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)- Definir velocidad de reacción química
- Derivar expresiones de velocidad a partir de la ecuación equilibrada para una reacción química dada
- Calcular velocidades de reacción a partir de datos experimentales
Una tarifa es una medida de cómo algunas propiedades varían con el tiempo. La velocidad es una tasa familiar que expresa la distancia recorrida por un objeto en una cantidad de tiempo determinada. El salario es una tasa que representa la cantidad de dinero que gana una persona que trabaja durante un tiempo determinado. Asimismo, la velocidad de una reacción química es una medida de cuánto reactivo se consume, o cuánto producto se produce, por la reacción en una cantidad de tiempo determinada.
La velocidad de reacción es el cambio en la cantidad de un reactivo o producto por unidad de tiempo. Por lo tanto, las velocidades de reacción se determinan midiendo la dependencia del tiempo de alguna propiedad que puede estar relacionada con las cantidades de reactivo o producto. Las tasas de reacciones que consumen o producen sustancias gaseosas, por ejemplo, se determinan convenientemente midiendo los cambios de volumen o presión. Para reacciones que involucran una o más sustancias coloreadas, las tasas pueden ser monitoreadas a través de mediciones de absorción de luz. Para reacciones que involucran electrolitos acuosos, las velocidades pueden medirse a través de cambios en la conductividad de una solución.
Para los reactivos y productos en solución, sus cantidades relativas (concentraciones) se utilizan convenientemente con el propósito de expresar las velocidades de reacción. Si medimos la concentración de peróxido de hidrógeno, H 2 O 2, en una solución acuosa, encontramos que cambia lentamente con el tiempo a medida que el H 2 O 2 se descompone, según la ecuación:
\[\ce{2H2O2}(aq)⟶\ce{2H2O}(l)+\ce{O2}(g) \nonumber \]
La velocidad a la que se descompone el peróxido de hidrógeno se puede expresar en términos de la velocidad de cambio de su concentración, como se muestra aquí:
\ [\ begin {align*}
\ ce {tasa\: de\: descomposición\: de\: H_2O_2}
&=\ mathrm {−\ dfrac {cambio\: in\: concentración\: de\: reactante} {tiempo\: intervalo}}\\ [4pt]
&=−\ dfrac {[\ ce {H2O2}] _ {t_2} − [\ ce {H2O2}] _ {t_1}} {t_2−t_1}\\ [4pt]
&=−\ dfrac {Δ [\ ce {H2O2}]} {Δt}
\ end {align*}\ nonumber\]
Esta representación matemática del cambio en la concentración de especies a lo largo del tiempo es la expresión de la velocidad para la reacción. Los corchetes indican concentraciones molares, y el símbolo delta (Δ) indica “cambio en”. Así,\([\ce{H2O2}]_{t_1}\) representa la concentración molar de peróxido de hidrógeno en algún tiempo t 1; asimismo,\([\ce{H2O2}]_{t_2}\) representa la concentración molar de peróxido de hidrógeno en un tiempo posterior t 2; y Δ [H 2 O 2] representa el cambio en concentración molar de peróxido de hidrógeno durante el intervalo de tiempo Δ t (es decir, t 2 − t 1). Dado que la concentración de reactivos disminuye a medida que avanza la reacción, Δ [H 2 O 2] es una cantidad negativa; colocamos un signo negativo frente a la expresión porque las velocidades de reacción son, por convención, cantidades positivas. La Figura\(\PageIndex{1}\) proporciona un ejemplo de datos recopilados durante la descomposición de H 2 O 2.
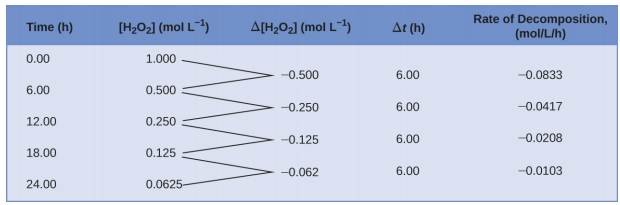
Para obtener los resultados tabulados para esta descomposición, se midió la concentración de peróxido de hidrógeno cada 6 horas en el transcurso de un día a una temperatura constante de 40 °C; se calcularon las velocidades de reacción para cada intervalo de tiempo dividiendo el cambio de concentración por el incremento de tiempo correspondiente, como mostrado aquí para el primer periodo de 6 horas:
\[\dfrac{−Δ[\ce{H2O2}]}{Δt}=\mathrm{\dfrac{−(0.500\: mol/L−1.000\: mol/L)}{(6.00\: h−0.00\: h)}=0.0833\: mol\:L^{−1}\:h^{−1}} \nonumber \]
Observe que las velocidades de reacción varían con el tiempo, disminuyendo a medida que avanza la reacción. Los resultados del último periodo de 6 horas arrojan una velocidad de reacción de:
\[\dfrac{−Δ[\ce{H2O2}]}{Δt}=\mathrm{\dfrac{−(0.0625\:mol/L−0.125\:mol/L)}{(24.00\:h−18.00\:h)}=0.0104\:mol\:L^{−1}\:h^{−1}} \nonumber \]
Este comportamiento indica que la reacción se ralentiza continuamente con el tiempo. El uso de las concentraciones al principio y al final de un período de tiempo durante el cual la velocidad de reacción está cambiando da como resultado el cálculo de una velocidad promedio para la reacción durante este intervalo de tiempo. En cualquier momento específico, la velocidad a la que avanza una reacción se conoce como su velocidad instantánea. La velocidad instantánea de una reacción en “tiempo cero”, cuando comienza la reacción, es su velocidad inicial. Considera la analogía de que un automóvil se ralentiza a medida que se acerca a una señal de alto. La velocidad inicial del vehículo, análoga al inicio de una reacción química, sería la lectura del velocímetro en el momento en que el conductor comienza a presionar los frenos (t 0). Unos momentos después, la velocidad instantánea en un momento específico —llamarlo t 1 — sería algo más lenta, como indica la lectura del velocímetro en ese momento. A medida que pasa el tiempo, la tasa instantánea seguirá bajando hasta llegar a cero, cuando el automóvil (o reacción) se detenga. A diferencia de la velocidad instantánea, la velocidad promedio del automóvil no es indicada por el velocímetro; pero puede calcularse como la relación entre la distancia recorrida y el tiempo requerido para llevar el vehículo a una parada completa (Δ t). Al igual que el auto que desacelera, la tasa promedio de una reacción química caerá en algún lugar entre sus velocidades inicial y final.
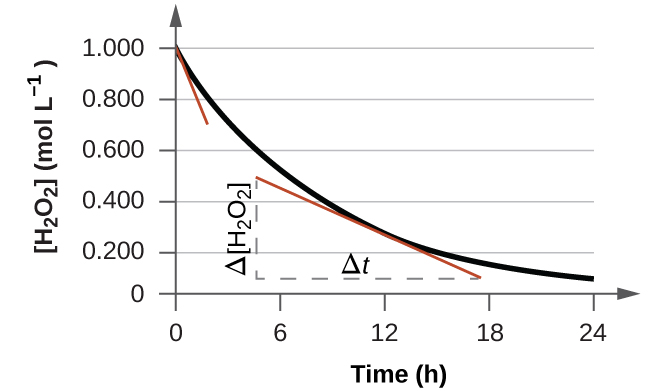
La velocidad instantánea de una reacción puede determinarse de dos maneras. Si las condiciones experimentales permiten la medición de los cambios de concentración en intervalos de tiempo muy cortos, entonces las tasas promedio calculadas como se describió anteriormente proporcionan aproximaciones razonablemente buenas de las tasas instantáneas. Alternativamente, se puede utilizar un procedimiento gráfico que, en efecto, arroje los resultados que se obtendrían si fueran posibles mediciones de intervalos de tiempo cortos. Si representamos la concentración de peróxido de hidrógeno frente al tiempo, la tasa instantánea de descomposición de H 2 O 2 en cualquier momento t viene dada por la pendiente de una línea recta que es tangente a la curva en ese momento (Figura\(\PageIndex{2}\)). Podemos utilizar el cálculo para evaluar las pendientes de tales líneas tangentes, pero el procedimiento para hacerlo está fuera del alcance de este capítulo.
Los médicos suelen utilizar tiras reactivas desechables para medir las cantidades de diversas sustancias en la orina de un paciente (Figura\(\PageIndex{2}\)). Estas tiras reactivas contienen diversos reactivos químicos, incrustados en pequeñas almohadillas en diversos lugares a lo largo de la tira, que experimentan cambios de color al exponerse a concentraciones suficientes de sustancias específicas. Las instrucciones de uso de las tiras reactivas a menudo enfatizan que el tiempo de lectura adecuado es crítico para obtener resultados óptimos. Este énfasis en el tiempo de lectura sugiere que los aspectos cinéticos de las reacciones químicas que ocurren en la tira reactiva son consideraciones importantes.
La prueba de glucosa urinaria se basa en un proceso de dos etapas representado por las ecuaciones químicas que se muestran aquí:
\[\ce{C6H12O6 + O2}\underset{\large\textrm{catalyst}}{\xrightarrow{\hspace{45px}}}\ce{C6H10O6 + H2O2} \label{eq1} \]
\[\ce{2H2O2 + 2I-}\underset{\large\textrm{catalyst}}{\xrightarrow{\hspace{45px}}}\ce{I2 + 2H2O + O2} \label{eq2} \]
\(\ref{eq1}\)La ecuación representa la oxidación de la glucosa en la orina para producir glucolactona y peróxido de hidrógeno. El peróxido de hidrógeno producido posteriormente oxida el ión yoduro incoloro para producir yodo marrón (Ecuación\(\ref{eq2}\)), el cual puede ser detectado visualmente. Algunas tiras incluyen una sustancia adicional que reacciona con el yodo para producir un cambio de color más distinto.
Las dos reacciones de prueba mostradas anteriormente son inherentemente muy lentas, pero sus tasas se incrementan por enzimas especiales incrustadas en la almohadilla de la tira reactiva. Este es un ejemplo de catálisis, tema tratado más adelante en este capítulo. Una tira reactiva de glucosa típica para su uso con orina requiere aproximadamente 30 segundos para completar las reacciones formadoras de color. Leer el resultado demasiado pronto podría llevar a concluir que la concentración de glucosa de la muestra de orina es menor de lo que realmente es (un resultado falso negativo). Esperar demasiado para evaluar el cambio de color puede llevar a un falso positivo debido a la oxidación más lenta (no catalizada) del ion yoduro por otras sustancias que se encuentran en la orina.

Tasas Relativas de Reacción
La velocidad de una reacción puede expresarse en términos del cambio en la cantidad de cualquier reactivo o producto, y puede derivarse simplemente de la estequiometría de la reacción. Considere la reacción representada por la siguiente ecuación:
\[\ce{2NH3}(g)⟶\ce{N2}(g)+\ce{3H2}(g) \nonumber \]
Los factores estequiométricos derivados de esta ecuación se pueden usar para relacionar las velocidades de reacción de la misma manera que se usan con las cantidades de reactivo y producto relacionadas. La relación entre las velocidades de reacción expresadas en términos de producción de nitrógeno y consumo de amoníaco, por ejemplo, es:
\[\mathrm{−\dfrac{Δmol\: NH_3}{Δ\mathit t}×\dfrac{1\: mol\: N_2}{2\: mol\: NH_3}=\dfrac{Δmol\:N_2}{Δ\mathit t}} \nonumber \]
Podemos expresarlo de manera más simple sin mostrar las unidades del factor estequiométrico:
\[−\dfrac{1}{2}\dfrac{\mathrm{Δmol\:NH_3}}{Δt}=\dfrac{\mathrm{Δmol\:N_2}}{Δt} \nonumber \]
Tenga en cuenta que se ha agregado un signo negativo para dar cuenta de los signos opuestos de los dos cambios de cantidad (la cantidad de reactivo disminuye mientras que la cantidad de producto está aumentando). Si los reactivos y productos están presentes en la misma solución, las cantidades molares pueden ser reemplazadas por concentraciones:
\[−\dfrac{1}{2}\dfrac{Δ[\ce{NH3}]}{Δt}=\dfrac{Δ[\ce{N2}]}{Δt} \nonumber \]
De igual manera, la tasa de formación de H 2 es tres veces la tasa de formación de N 2 porque se forman tres moles de H 2 durante el tiempo requerido para la formación de un mol de N 2:
\[\dfrac{1}{3}\dfrac{Δ[\ce{H2}]}{Δt}=\dfrac{Δ[\ce{N2}]}{Δt} \nonumber \]
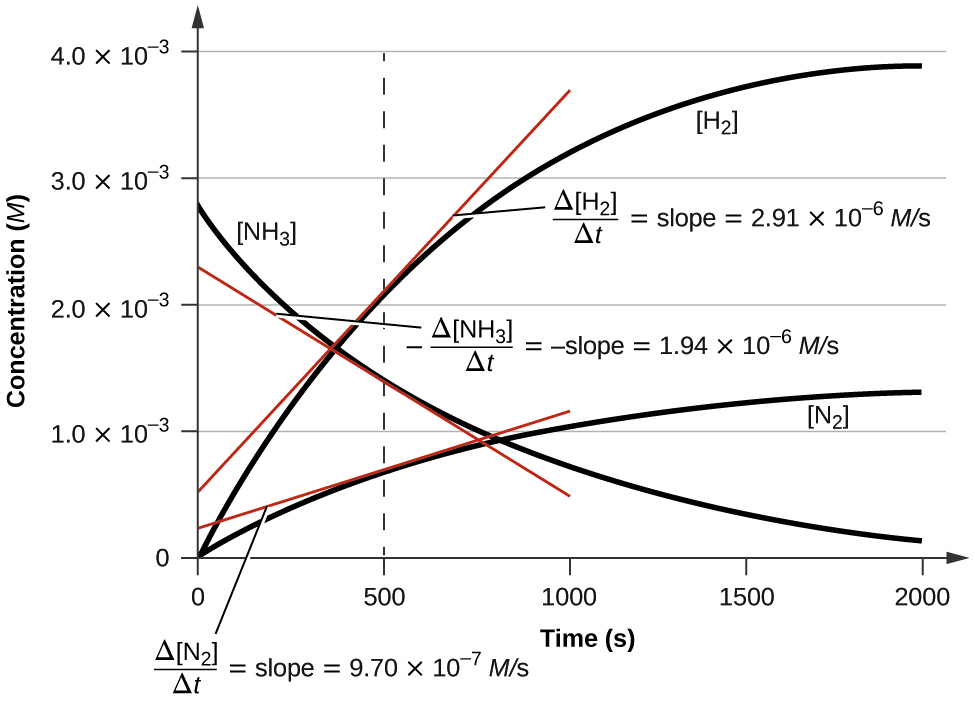
La figura\(\PageIndex{3}\) ilustra el cambio en las concentraciones a lo largo del tiempo para la descomposición de amoníaco en nitrógeno e hidrógeno a 1100 °C; podemos ver a partir de las pendientes de las tangentes dibujadas a t = 500 segundos que las velocidades instantáneas de cambio en las concentraciones de los reactivos y productos están relacionados por sus factores estequiométricos. Se observa que la tasa de producción de hidrógeno, por ejemplo, es tres veces mayor que la de la producción de nitrógeno:
\[\dfrac{2.91×10^{−6}\:M/\ce s}{9.71×10^{−6}\:M/\ce s}≈3 \nonumber \]
El primer paso en la producción de ácido nítrico es la combustión del amoníaco:
\[\ce{4NH3}(g)+\ce{5O2}(g)⟶\ce{4NO}(g)+\ce{6H2O}(g) \nonumber \]
Escribir las ecuaciones que relacionen las tasas de consumo de los reactivos y las tasas de formación de los productos.
Solución
Considerando la estequiometría de esta reacción homogénea, las velocidades para el consumo de reactivos y formación de productos son:
\[−\dfrac{1}{4}\dfrac{Δ[\ce{NH3}]}{Δt}=−\dfrac{1}{5}\dfrac{Δ[\ce{O2}]}{Δt}=\dfrac{1}{4}\dfrac{Δ[\ce{NO}]}{Δt}=\dfrac{1}{6}\dfrac{Δ[\ce{H2O}]}{Δt} \nonumber \]
La velocidad de formación de Br 2 es 6.0 × 10 −6 mol/l/s en una reacción descrita por la siguiente ecuación iónica neta:
\[\ce{5Br- + BrO3- + 6H+ ⟶ 3Br2 + 3H2O} \nonumber \]
Escribir las ecuaciones que relacionen las tasas de consumo de los reactivos y las tasas de formación de los productos.
- Responder
-
\[−\dfrac{1}{5}\dfrac{Δ[\ce{Br-}]}{Δt}=−\dfrac{Δ[\ce{BrO3-}]}{Δt}=−\dfrac{1}{6}\dfrac{Δ[\ce{H+}]}{Δt}=\dfrac{1}{3}\dfrac{Δ[\ce{Br2}]}{Δt}=\dfrac{1}{3}\dfrac{Δ[\ce{H2O}]}{Δt} \nonumber \]
El gráfico de la Figura\(\PageIndex{3}\) muestra la tasa de descomposición de H 2 O 2 a lo largo del tiempo:
\[\ce{2H2O2 ⟶ 2H2O + O2} \nonumber \]
Con base en estos datos, se determina que la tasa instantánea de descomposición de H 2 O 2 a t = 11.1 h es 3.20 × 10 −2 mol/L/h, es decir:
\[−\dfrac{Δ[\ce{H2O2}]}{Δt}=\mathrm{3.20×10^{−2}\:mol\: L^{−1}\:h^{−1}} \nonumber \]
¿Cuál es la tasa instantánea de producción de H 2 O y O 2?
Solución
Usando la estequiometría de la reacción, podemos determinar que:
\[−\dfrac{1}{2}\dfrac{Δ[\ce{H2O2}]}{Δt}=\dfrac{1}{2}\dfrac{Δ[\ce{H2O}]}{Δt}=\dfrac{Δ[\ce{O2}]}{Δt} \nonumber \]
Por lo tanto:
y
\[\dfrac{Δ[\ce{O2}]}{Δt}=\mathrm{1.60×10^{−2}\:mol\:L^{−1}\:h^{−1}} \nonumber \]
Si la tasa de descomposición del amoníaco, NH 3, a 1150 K es 2.10 × 10 −6 mol/l/s, ¿cuál es la tasa de producción de nitrógeno e hidrógeno?
- Responder
-
1.05 × 10 −6 mol/l/s, N 2 y 3.15 × 10 −6 mol/l/s, H 2.
Resumen
La velocidad de una reacción se puede expresar ya sea en términos de la disminución en la cantidad de un reactivo o el aumento en la cantidad de un producto por unidad de tiempo. Las relaciones entre diferentes expresiones de velocidad para una reacción dada se derivan directamente de los coeficientes estequiométricos de la ecuación que representa la reacción.
Glosario
- tasa promedio
- velocidad de una reacción química calculada como la relación de un cambio medido en la cantidad o concentración de sustancia al intervalo de tiempo durante el cual ocurrió el cambio
- tasa inicial
- velocidad instantánea de una reacción química a t = 0 s (inmediatamente después de que la reacción haya comenzado)
- tasa instantánea
- velocidad de una reacción química en cualquier instante en el tiempo, determinada por la pendiente de la línea tangencial a una gráfica de concentración en función del tiempo
- velocidad de reacción
- medida de la velocidad a la que se produce una reacción química
- expresión de tasa
- representación matemática que relaciona la velocidad de reacción con cambios en la cantidad, concentración o presión del reactivo o especie de producto por unidad de tiempo


