12.2: Factores que afectan las tasas de reacción
- Page ID
- 75476
- Describir los efectos de la naturaleza química, el estado físico, la temperatura, la concentración y la catálisis sobre las velocidades de reacción
Las velocidades a las que se consumen los reactivos y se forman los productos durante las reacciones químicas varían mucho. Podemos identificar cinco factores que afectan las tasas de reacciones químicas: la naturaleza química de las sustancias reaccionantes, el estado de subdivisión (un terrón grande versus muchas partículas pequeñas) de los reactivos, la temperatura de los reactivos, la concentración de los reactivos y la presencia de un catalizador.
La naturaleza química de las sustancias reaccionantes
La velocidad de una reacción depende de la naturaleza de las sustancias participantes. Las reacciones que parecen similares pueden tener diferentes velocidades en las mismas condiciones, dependiendo de la identidad de los reactivos. Por ejemplo, cuando pequeños trozos de los metales hierro y sodio se exponen al aire, el sodio reacciona completamente con el aire durante la noche, mientras que el hierro apenas se ve afectado. Los metales activos calcio y sodio reaccionan con el agua para formar hidrógeno gaseoso y una base. Sin embargo, el calcio reacciona a una velocidad moderada, mientras que el sodio reacciona tan rápidamente que la reacción es casi explosiva.
El Estado de Subdivisión de los Reactivos
Excepto las sustancias en estado gaseoso o en solución, las reacciones ocurren en el límite, o interfaz, entre dos fases. De ahí que la velocidad de una reacción entre dos fases depende en gran medida del contacto superficial entre ellas. Un sólido finamente dividido tiene más área de superficie disponible para la reacción que una pieza grande de la misma sustancia. Así, un líquido reaccionará más rápidamente con un sólido finamente dividido que con una pieza grande del mismo sólido. Por ejemplo, los trozos grandes de hierro reaccionan lentamente con los ácidos; el hierro finamente dividido reacciona mucho más rápidamente (Figura\(\PageIndex{1}\)). Los trozos grandes de madera arden, los trozos más pequeños se queman rápidamente y el polvo de sierra se quema explosivamente.

Video\(\PageIndex{1}\): La reacción del cesio con el agua en cámara lenta y una discusión sobre cómo el estado de los reactivos y el tamaño de partícula afectan las velocidades de reacción.
Temperatura de los Reactivos
Las reacciones químicas suelen ocurrir más rápido a temperaturas más altas. La comida puede estropearse rápidamente cuando se deja en la encimera de la cocina. Sin embargo, la menor temperatura dentro de un refrigerador ralentiza ese proceso para que el mismo alimento permanezca fresco durante días. Utilizamos un quemador o una placa caliente en el laboratorio para aumentar la velocidad de las reacciones que avanzan lentamente a temperaturas ordinarias. En muchos casos, un aumento de la temperatura de solo 10 °C duplicará aproximadamente la velocidad de una reacción en un sistema homogéneo.
Concentraciones de los Reactivos
Las velocidades de muchas reacciones dependen de las concentraciones de los reactivos. Las tasas suelen aumentar cuando aumenta la concentración de uno o más de los reactivos. Por ejemplo, el carbonato de calcio (\(\mathrm{CaCO_3}\)) se deteriora como resultado de su reacción con el contaminante dióxido de azufre. La velocidad de esta reacción depende de la cantidad de dióxido de azufre en el aire (Figura\(\PageIndex{2}\)). Como óxido ácido, el dióxido de azufre se combina con vapor de agua en el aire para producir ácido sulfuroso en la siguiente reacción:
\[\ce{SO}_{2(g)}+\ce{H_2O}_{(g)}⟶\ce{H_2SO}_{3(aq)} \label{12.3.1} \]
El carbonato de calcio reacciona con ácido sulfuroso de la siguiente manera:
\[\ce{CaCO}_{3(s)}+\ce{H_2SO}_{3(aq)}⟶\ce{CaSO}_{3(aq)}+\ce{CO}_{2(g)}+\ce{H_2O}_{(l)} \label{12.3.2} \]
En una atmósfera contaminada donde la concentración de dióxido de azufre es alta, el carbonato de calcio se deteriora más rápidamente que en el aire menos contaminado. De igual manera, el fósforo se quema mucho más rápidamente en una atmósfera de oxígeno puro que en el aire, que es sólo aproximadamente 20% de oxígeno.

Video\(\PageIndex{2}\): El fósforo se quema rápidamente en el aire, pero se quemará aún más rápidamente si la concentración de oxígeno en es mayor.
La presencia de un catalizador
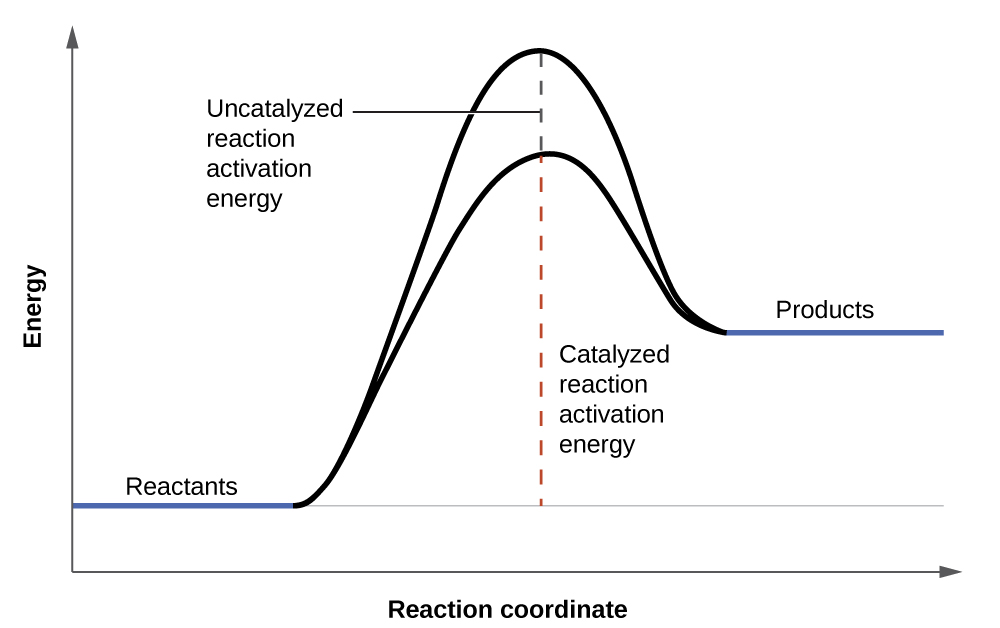
Las soluciones de peróxido de hidrógeno se espuman cuando se vierten sobre una herida abierta porque las sustancias en los tejidos expuestos actúan como catalizadores, aumentando la velocidad de descomposición del peróxido de hidrógeno. Sin embargo, en ausencia de estos catalizadores (por ejemplo, en el frasco en el botiquín) la descomposición completa puede llevar meses. Un catalizador es una sustancia que aumenta la velocidad de una reacción química al disminuir la energía de activación sin ser consumida por la reacción. La energía de activación es la cantidad mínima de energía requerida para que una reacción química continúe en la dirección hacia adelante. Un catalizador aumenta la velocidad de reacción al proporcionar una vía o mecanismo alternativo para la reacción a seguir (Figura\(\PageIndex{3}\)). La catálisis se discutirá con mayor detalle más adelante en este capítulo en lo que se refiere a los mecanismos de las reacciones.
Las reacciones químicas ocurren cuando las moléculas chocan entre sí y sufren una transformación química. Antes de realizar físicamente una reacción en un laboratorio, los científicos pueden usar simulaciones de modelado molecular para predecir cómo los parámetros discutidos anteriormente influirán en la velocidad de una reacción. Utilice el interactivo Reacciones y tasas de PhET para explorar cómo la temperatura, la concentración y la naturaleza de los reactivos afectan las velocidades de reacción.
Resumen
La velocidad de una reacción química se ve afectada por varios parámetros. Las reacciones que involucran dos fases avanzan más rápidamente cuando hay mayor contacto con la superficie. Si se aumenta la temperatura o la concentración del reactivo, la velocidad de una reacción dada generalmente también aumenta. Un catalizador puede aumentar la velocidad de una reacción proporcionando una vía alternativa que hace que la energía de activación de la reacción disminuya.
Glosario
- catalizador
- sustancia que aumenta la velocidad de una reacción sin ser consumida por la reacción


