12.6: Mecanismos de reacción
- Page ID
- 75514
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)
- Distinguir las reacciones netas de las reacciones elementales (etapas)
- Identificar la molecularidad de las reacciones elementales
- Escribir una ecuación química equilibrada para un proceso dado su mecanismo de reacción
- Derivar la ley de velocidad consistente con un mecanismo de reacción dado
Una ecuación equilibrada para una reacción química indica qué está reaccionando y qué se produce, pero no revela nada sobre cómo se produce realmente la reacción. El mecanismo de reacción (o ruta de reacción) es el proceso, o vía, por el cual se produce una reacción. Una reacción química a menudo ocurre en etapas, aunque puede que no siempre sea obvia para un observador. La descomposición del ozono, por ejemplo, parece seguir un mecanismo con dos pasos:
\ [\ ce {O3} (g) ⟶\ ce {O2} (g) +\ ce {O}\
\ ce {O} +\ ce {O3} (g) ⟶\ ce {2O2} (g)\ etiqueta {12.7.1}\]
Llamamos a cada paso en un mecanismo de reacción una reacción elemental. Las reacciones elementales ocurren exactamente como están escritas y no se pueden desglosar en pasos más simples. Las reacciones elementales se suman a la reacción general, que, para la descomposición, es:
\[\ce{2O3}(g)⟶\ce{3O2}(g) \label{12.7.2} \]
Observe que el átomo de oxígeno producido en la primera etapa de este mecanismo se consume en la segunda etapa y por lo tanto no aparece como producto en la reacción global. Las especies que se producen en un solo paso y se consumen en una etapa posterior se denominan intermedios.
Si bien la ecuación general de reacción para la descomposición del ozono indica que dos moléculas de ozono reaccionan para dar tres moléculas de oxígeno, el mecanismo de la reacción no implica la colisión y reacción de dos moléculas de ozono. Más bien, implica una molécula de ozono que se descompone en una molécula de oxígeno y un átomo de oxígeno intermedio; el átomo de oxígeno reacciona entonces con una segunda molécula de ozono para dar dos moléculas de oxígeno. Estas dos reacciones elementales ocurren exactamente como se muestran en el mecanismo de reacción.
Reacciones elementales unimoleculares
La molecularidad de una reacción elemental es el número de especies reaccionantes (átomos, moléculas o iones). Por ejemplo, una reacción unimolecular implica el reordenamiento de una sola especie reaccionante para producir una o más moléculas de producto:
\[A⟶\ce{products} \label{12.7.2b} \]
La ecuación de velocidad para una reacción unimolecular es:
\[\ce{rate}=k[A] \label{12.7.3} \]
Una reacción unimolecular puede ser una de varias reacciones elementales en un mecanismo complejo. Por ejemplo, la reacción:
\[\ce{O3 ⟶ O2 + O} \label{12.7.4} \]
ilustra una reacción elemental unimolecular que ocurre como una parte de un mecanismo de reacción en dos etapas. Sin embargo, algunas reacciones unimoleculares pueden tener solo una única reacción en el mecanismo de reacción. (En otras palabras, una reacción elemental también puede ser una reacción general en algunos casos). Por ejemplo, la descomposición en fase gaseosa del ciclobutano, C 4H 8, a etileno, C 2 H 4, se produce a través de un mecanismo unimolecular de un solo paso:
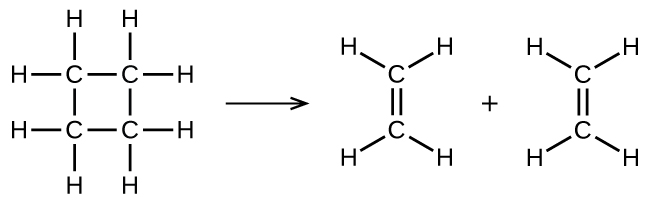
Para que ocurran estas reacciones unimoleculares, todo lo que se requiere es la separación de partes de moléculas de reactantes individuales en productos.
Los enlaces químicos no se desmoronan simplemente durante las reacciones químicas. Se requiere energía para romper los enlaces químicos. La energía de activación para la descomposición de C 4 H 8, por ejemplo, es de 261 kJ por mol. Esto significa que se requieren 261 kilojulios para distorsionar un mol de estas moléculas en complejos activados que se descomponen en productos:
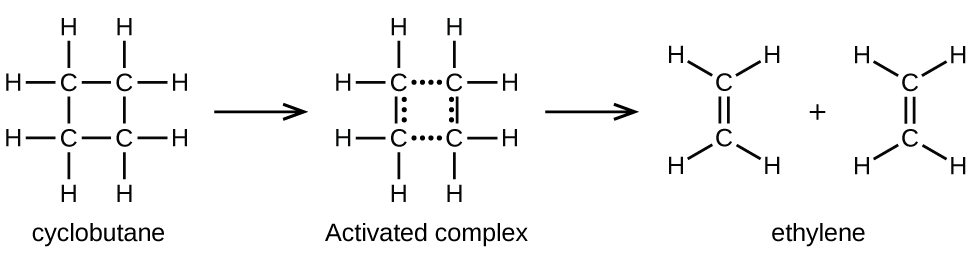
En una muestra de C 4 H 8, algunas de las moléculas de C 4 H 8 que se mueven rápidamente chocan con otras moléculas que se mueven rápidamente y captan energía adicional. Cuando las moléculas C 4 H 8 ganan suficiente energía, pueden transformarse en un complejo activado, y puede ocurrir la formación de moléculas de etileno. En efecto, una colisión particularmente energética golpea una molécula C 4 H 8 en la geometría del complejo activado. Sin embargo, solo una pequeña fracción de moléculas de gas viaja a velocidades suficientemente altas con energías cinéticas lo suficientemente grandes para lograr esto. De ahí que en un momento dado, solo unas pocas moléculas capten suficiente energía de las colisiones para reaccionar.
La tasa de descomposición de C 4 H 8 es directamente proporcional a su concentración. Duplicar la concentración de C 4 H 8 en una muestra da el doble de moléculas por litro. Si bien la fracción de moléculas con suficiente energía para reaccionar sigue siendo la misma, el número total de tales moléculas es el doble de grande. En consecuencia, hay el doble de C 4 H 8 por litro, y la velocidad de reacción es el doble de rápida:
\[\ce{rate}=−\dfrac{Δ[\ce{C4H8}]}{Δt}=k[\ce{C4H8}] \label{12.7.5} \]
Una relación similar se aplica a cualquier reacción elemental unimolecular; la velocidad de reacción es directamente proporcional a la concentración del reactivo, y la reacción presenta un comportamiento de primer orden. La constante de proporcionalidad es la constante de velocidad para la reacción unimolecular particular.
Reacciones elementales bimoleculares
La colisión y combinación de dos moléculas o átomos para formar un complejo activado en una reacción elemental se denomina reacción bimolecular. Hay dos tipos de reacciones elementales bimoleculares:
\[A+B⟶\ce{products} \label{12.7.6} \]
y
\[2A⟶\ce{products} \label{12.7.7} \]
Para el primer tipo, en el que las dos moléculas reaccionantes son diferentes, la ley de velocidad es de primer orden en A y de primer orden en B:
\[\ce{rate}=k[A][B] \label{12.7.8} \]
Para el segundo tipo, en el que dos moléculas idénticas chocan y reaccionan, la ley de velocidad es de segundo orden en A:
\[\ce{rate}=k[A][A]=k[A]^2 \label{12.7.9} \]
Algunas reacciones químicas tienen mecanismos que consisten en una única reacción elemental bimolecular. Un ejemplo es la reacción del dióxido de nitrógeno con monóxido de carbono:
\[\ce{NO2}(g)+\ce{CO}(g)⟶\ce{NO}(g)+\ce{CO2}(g) \label{12.7.10} \]
(ver Figura\(\PageIndex{1}\))

Las reacciones elementales bimoleculares también pueden estar involucradas como etapas en un mecanismo de reacción multietapa. La reacción del oxígeno atómico con el ozono es un ejemplo:
\[\ce{O}(g)+\ce{O3}(g)⟶\ce{2O2}(g) \label{12.7.12} \]
Reacciones Termoleculares Elementales
Una reacción termolecular elemental implica la colisión simultánea de tres átomos, moléculas o iones. Las reacciones elementales termoleculares son poco comunes porque la probabilidad de que tres partículas colisionen simultáneamente es menor que una milésima parte de la probabilidad de que dos partículas colisionen. Sin embargo, existen algunas reacciones elementales termoleculares establecidas. La reacción del óxido nítrico con oxígeno parece implicar etapas termoleculares:
\ [\ ce {2NO + O2 ⟶ 2NO2}\\
\ ce {tasa} =k [\ ce {NO}] ^2 [\ ce {O2}]\ etiqueta {12.7.13}\]
Asimismo, la reacción del óxido nítrico con cloro parece implicar etapas termoleculares:
\ [\ ce {2NO + Cl2 ⟶ 2NOCl}\\
\ ce {tasa} =k [\ ce {NO}] ^2 [\ ce {Cl2}]\ etiqueta {12.7.14}\]
Relacionar los mecanismos de reacción con leyes de tarifas
A menudo ocurre que un paso en un mecanismo de reacción multietapa es significativamente más lento que los otros. Debido a que una reacción no puede proceder más rápido que su etapa más lenta, esta etapa limitará la velocidad a la que se produce la reacción global. Por lo tanto, la etapa más lenta se denomina etapa limitante de velocidad (o etapa de determinación de velocidad) de la Figura de reacción\(\PageIndex{2}\).

Como se describió anteriormente, las leyes de velocidad pueden derivarse directamente de las ecuaciones químicas para reacciones elementales. Este no es el caso, sin embargo, de las reacciones químicas ordinarias. Las ecuaciones equilibradas que se encuentran con mayor frecuencia representan el cambio general para algún sistema químico, y muy a menudo esto es el resultado de algunos mecanismos de reacción multietapa. En todos los casos, debemos determinar la ley general de tasas a partir de datos experimentales y deducir el mecanismo a partir de la ley de tarifas (y a veces de otros datos). La reacción de NO 2 y CO proporciona un ejemplo ilustrativo:
\[\ce{NO2}(g)+\ce{CO}(g)⟶\ce{CO2}(g)+\ce{NO}(g) \nonumber \]
Para temperaturas superiores a 225 °C, se ha encontrado que la ley de tarifas es:
\[\ce{rate}=k[\ce{NO2}][\ce{CO}] \nonumber \]
La reacción es de primer orden con respecto al NO 2 y de primer orden con respecto al CO. Esto es consistente con un mecanismo bimolecular de una sola etapa y es posible que este sea el mecanismo para esta reacción a altas temperaturas.
A temperaturas inferiores a 225 °C, la reacción se describe mediante una ley de velocidad que es de segundo orden con respecto al NO 2:
\[\ce{rate}=k[\ce{NO2}]^2 \nonumber \]
Esto es consistente con un mecanismo que involucra las siguientes dos reacciones elementales, la primera de las cuales es más lenta y, por lo tanto, es el paso determinante de la velocidad:
\ [\ ce {NO2} (g) +\ ce {NO2} (g) ⟶\ ce {NO3} (g) +\ ce {NO} (g)\:\ ce {(lento)}\
\\ ce {NO3} (g) +\ ce {CO} (g) ⟶\ ce {NO2} (g) +\ ce {CO2} (g)\:\ ce {rápido)}\ nonumber\]
El paso de determinación de la velocidad da una ley de velocidad que muestra la dependencia de segundo orden de la concentración de NO 2, y la suma de las dos ecuaciones da la reacción global neta.
En general, cuando el paso determinante de velocidad (más lento) es el primer paso en un mecanismo, la ley de velocidad para la reacción general es la misma que la ley de velocidad para este paso. Sin embargo, cuando la etapa de determinación de la velocidad está precedida por una etapa que implica una reacción de equilibrio, la ley de velocidad para la reacción general puede ser más difícil de derivar.
Una reacción elemental está en equilibrio cuando procede tanto en la dirección hacia adelante como en la dirección inversa a tasas iguales. Considere la dimerización de NO a N 2 O 2, con k 1 usado para representar la constante de velocidad de la reacción directa y k -1 usado para representar la constante de velocidad de la reacción inversa:
\[\ce{NO + NO ⇌ N2O2} \nonumber \]
\[\ce{rate_{forward}=rate_{reverse}} \nonumber \]
\[k_1[\ce{NO}]^2=k_{−1}[\ce{N2O2}] \nonumber \]
Si N 2 O 2 fuera un intermedio en un mecanismo, esta expresión podría reorganizarse para representar la concentración de N 2 O 2 en la expresión general de la ley de velocidad usando manipulación algebraica:
\[\mathrm{\left(\dfrac{k_1[NO]^2}{k_{−1}}\right)=[N_2O_2]} \nonumber \]
Sin embargo, una vez más, los intermedios no pueden ser listados como parte de la expresión general de la ley de tasas, aunque pueden incluirse en una reacción elemental individual de un mecanismo. \(\PageIndex{1}\)El ejemplo ilustrará cómo derivar leyes generales de tasas a partir de mecanismos que implican pasos de equilibrio que preceden al paso de determinación de la tasa
Mecanismo El cloruro de nitrilo (NO 2 Cl) se descompone en dióxido de nitrógeno (NO 2) y gas cloro (Cl 2) de acuerdo con el siguiente mecanismo:
- \(\ce{2NO2Cl}(g)⇌\ce{ClO2}(g)+\ce{N2O}(g)+\ce{ClO}(g)\)(rápido, k1 representa la constante de velocidad para la reacción directa y k-1 la constante de velocidad para la reacción inversa)
- \(\ce{N2O}(g)+\ce{ClO2}(g)⇌\ce{NO2}(g)+\ce{NOCl}(g)\)(rápido, k 2 para la reacción directa, k -2 para la reacción inversa)
- \(\ce{NOCl + ClO ⟶ NO2 + Cl2}\)(lento, k 3 la constante de velocidad para la reacción directa)
Determine la reacción general, escriba la expresión de la ley de velocidad para cada reacción elemental, identifique cualquier intermedio y determine la expresión general de la ley de velocidad.
Solución
Para la reacción general, simplemente suma los tres pasos, cancela los intermedios y combina como fórmulas:
\[\ce{2NO2Cl}(g)⟶\ce{2NO2}(g)+\ce{Cl2}(g) \nonumber \]
A continuación, escriba la expresión de la ley de tasas para cada reacción elemental. Recuerde que para las reacciones elementales que forman parte de un mecanismo, la expresión de la ley de velocidad puede derivarse directamente de la estequiometría:
\ [\ begin {align*}
k_1\ ce {[NO2Cl] 2} &=k_ {−1}\ ce {[ClO2] [N2O] [ClO]}\\
k_2\ ce {[N2O] [ClO2]} &=k_ {−2}\ ce {[NO2] [NOCl]}\
\ ce {Tasa} &=k_3\ ce {[NoCl] [ClO]}
\ end {align*}\ nonumber\]
El tercer paso, que es el paso lento, es el paso determinante de la tasa. Por lo tanto, la expresión general de la ley de tasas podría escribirse como Rate = k 3 [NoCl] [ClO]. Sin embargo, tanto NOCl como ClO son intermedios. Las expresiones algebraicas deben usarse para representar [NoCl] y [ClO] de manera que no queden intermedios en la expresión general de la ley de tasa.
- Usando reacción elemental 1,\(\ce{[ClO]}=\dfrac{k_1\ce{[NO2Cl]^2}}{k_{−1}\ce{[ClO2][N2O]}}\).
- Usando reacción elemental 2,\(\ce{[NOCl]}=\dfrac{k_2\ce{[N2O][ClO2]}}{k_{−2}\ce{[NO2]}}\).
Ahora sustituya estas expresiones algebraicas en la expresión general de la ley de tasas y simplifique:
\ [\ begin {align*}
\ ce {rate} &=k_3\ left (\ dfrac {k_2\ ce {[N2O] [ClO2]}} {k_ {−2}\ ce {[NO2]}}\ derecha)\ izquierda (\ dfrac {k_1\ ce {[NO2Cl] ^2}} {k_ {−1}\ ce {ClO2] [N2O]}}\ derecha)\
\ ce {tasa} &=\ dfrac {k_3k_2k_1\ ce {[NO2Cl] ^2}} {k_ {−2} k_ {−1}\ ce {[NO2]}}
\ end {align*}\ nonumber\]
Observe que esta ley de tasas muestra una dependencia inversa de la concentración de una de las especies producto, consistente con la presencia de un paso de equilibrio en el mecanismo de reacción.
El cloro atómico en la atmósfera reacciona con el ozono en el siguiente par de reacciones elementales:
\(\ce{Cl}+\ce{O3}(g)⟶\ce{ClO}(g)+\ce{O2}(g)\hspace{20px}(\textrm{rate constant }k_1)\)
Determine la reacción general, escriba la expresión de la ley de velocidad para cada reacción elemental, identifique cualquier intermedio y determine la expresión general de la ley de velocidad.
- Responder
-
- reacción general:\(\ce{O3}(g)+\ce{O}⟶\ce{2O2}(g)\)
- tasa 1 = k 1 [O 3] [Cl]; tasa 2 = k 2 [ClO] [O]
- intermedio: ClO (g)
- tasa general = k 2 k 1 [O 3] [Cl] [O]
Resumen
La secuencia de etapas individuales, o reacciones elementales, mediante las cuales los reactivos se convierten en productos durante el transcurso de una reacción se denomina mecanismo de reacción. La velocidad general de una reacción está determinada por la velocidad de la etapa más lenta, llamada etapa de determinación de velocidad. Las reacciones elementales unimoleculares tienen leyes de tasa de primer orden, mientras que las reacciones elementales bimoleculares tienen leyes de segundo orden. Al comparar las leyes de velocidad derivadas de un mecanismo de reacción con las determinadas experimentalmente, el mecanismo puede considerarse incorrecto o plausible.
Notas al pie
- Esta pregunta es tomada del Examen de Colocación Avanzada de Química y se utiliza con el permiso del Servicio de Pruebas Educativas.
Glosario
- reacción bimolecular
- reacción elemental que implica la colisión y combinación de dos especies reaccionantes
- reacción elemental
- reacción que tiene lugar precisamente como se representa en su ecuación química
- intermedio
- molécula o ion producido en una etapa de un mecanismo de reacción y consumido en otro
- molecularidad
- número de especies reaccionantes (átomos, moléculas o iones) implicadas en una reacción elemental
- paso de determinación de la tasa
- (también, etapa limitante de velocidad) reacción elemental más lenta en un mecanismo de reacción; determina la velocidad de la reacción global
- mecanismo de reacción
- secuencia escalonada de reacciones elementales mediante las cuales se produce un cambio químico
- reacción termolecular
- reacción elemental que implica la colisión simultánea y combinación de tres especies reaccionantes
- reacción unimolecular
- reacción elemental que implica el reordenamiento de una sola especie reaccionante para producir una o más moléculas de producto


