12.5: Teoría de colisiones
- Page ID
- 75498
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)- Utilizar los postulados de la teoría de colisiones para explicar los efectos del estado físico, la temperatura y la concentración en las velocidades de reacción
- Definir los conceptos de energía de activación y estado de transición
- Utilizar la ecuación de Arrhenius en los cálculos que relacionan las constantes de velocidad con la temperatura
No debemos sorprendernos que los átomos, las moléculas o los iones deban colisionar antes de que puedan reaccionar entre sí. Los átomos deben estar muy juntos para formar enlaces químicos. Esta simple premisa es la base de una teoría muy poderosa que explica muchas observaciones respecto a la cinética química, incluyendo factores que afectan las velocidades de reacción. La teoría de colisiones se basa en los siguientes postulados:
- La velocidad de una reacción es proporcional a la velocidad de colisiones de reactivos:\[\mathrm{reaction\: rate ∝ \dfrac{\#\,collisions}{time}} \nonumber \]
- Las especies reaccionantes deben colisionar en una orientación que permita el contacto entre los átomos que se unirán en el producto.
- La colisión debe ocurrir con la energía adecuada para permitir la penetración mutua de las conchas de valencia de las especies reaccionantes para que los electrones puedan reorganizarse y formar nuevos enlaces (y nuevas especies químicas).
Podemos ver la importancia de los dos factores físicos señalados en los postulados 2 y 3, la orientación y energía de las colisiones, cuando consideramos la reacción del monóxido de carbono con el oxígeno:
\[\ce{2CO}(g)+\ce{O2}(g)⟶\ce{2CO2}(g) \nonumber \]
El monóxido de carbono es un contaminante producido por la combustión de combustibles hidrocarbonados. Para reducir este contaminante, los automóviles cuentan con convertidores catalíticos que utilizan un catalizador para llevar a cabo esta reacción. También es una reacción secundaria de la combustión de pólvora que resulta en destello de hocico para muchas armas de fuego. Si el monóxido de carbono y el oxígeno están presentes en cantidad suficiente, la reacción es espontánea a alta temperatura y presión.
El primer paso en la reacción en fase gaseosa entre el monóxido de carbono y el oxígeno es una colisión entre las dos moléculas:
\[\ce{CO}(g)+\ce{O2}(g)⟶\ce{CO2}(g)+\ce{O}(g) \nonumber \]
Aunque existen muchas orientaciones posibles diferentes que las dos moléculas pueden tener una respecto a la otra, considere las dos presentadas en la Figura\(\PageIndex{1}\). En el primer caso, el lado oxígeno de la molécula de monóxido de carbono choca con la molécula de oxígeno. En el segundo caso, el lado de carbono de la molécula de monóxido de carbono choca con la molécula de oxígeno. El segundo caso es claramente más probable que resulte en la formación de dióxido de carbono, que tiene un átomo de carbono central unido a dos átomos de oxígeno\(\ce{(O=C=O)}\). Este es un ejemplo bastante simple de lo importante que es la orientación de la colisión en términos de crear el producto deseado de la reacción.
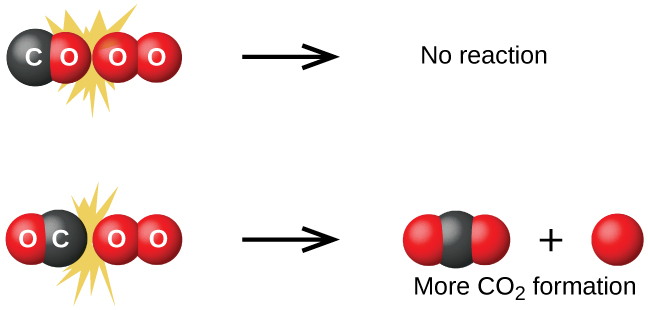
Si la colisión ocurre con la orientación correcta, aún no hay garantía de que la reacción proceda a formar dióxido de carbono. Toda reacción requiere una cierta cantidad de energía de activación para que continúe en la dirección hacia adelante, produciendo un complejo activado apropiado en el camino. Como\(\PageIndex{2}\) demuestra la Figura, incluso una colisión con la orientación correcta puede fallar en formar el producto de reacción. En el estudio de los mecanismos de reacción, cada una de estas tres disposiciones de átomos se denomina un complejo activado propuesto o estado de transición.
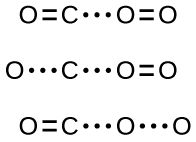
En la mayoría de las circunstancias, es imposible aislar o identificar un estado de transición o complejo activado. En la reacción entre monóxido de carbono y oxígeno para formar dióxido de carbono, los complejos activados solo se han observado espectroscópicamente en sistemas que utilizan un catalizador heterogéneo. La reacción en fase gaseosa se produce con demasiada rapidez para aislar cualquier compuesto químico de este tipo.
La teoría de colisiones explica por qué la mayoría de las velocidades de reacción aumentan a medida Con un incremento en la concentración de cualquier sustancia reaccionante, se incrementan las posibilidades de colisiones entre moléculas debido a que hay más moléculas por unidad de volumen. Más colisiones significan una velocidad de reacción más rápida, asumiendo que la energía de las colisiones es adecuada.
Energía de activación y la ecuación de Arrhenius
La energía mínima necesaria para formar un producto durante una colisión entre reactivos se denomina energ y (\(E_a\)) de activación. La energía cinética de las moléculas reaccionantes juega un papel importante en una reacción porque la energía necesaria para formar un producto es proporcionada por una colisión de una molécula reaccionante con otra molécula reaccionante. (En reacciones de un solo reactivo, la energía de activación puede ser proporcionada por una colisión de la molécula reaccionante con la pared del recipiente de reacción o con moléculas de un contaminante inerte). Si la energía de activación es mucho mayor que la energía cinética promedio de las moléculas, la reacción ocurrirá lentamente: Solo unas pocas moléculas que se mueven rápidamente tendrán suficiente energía para reaccionar. Si la energía de activación es mucho menor que la energía cinética promedio de las moléculas, la fracción de moléculas que posean la energía cinética necesaria será grande; la mayoría de las colisiones entre moléculas resultarán en reacción, y la reacción ocurrirá rápidamente.
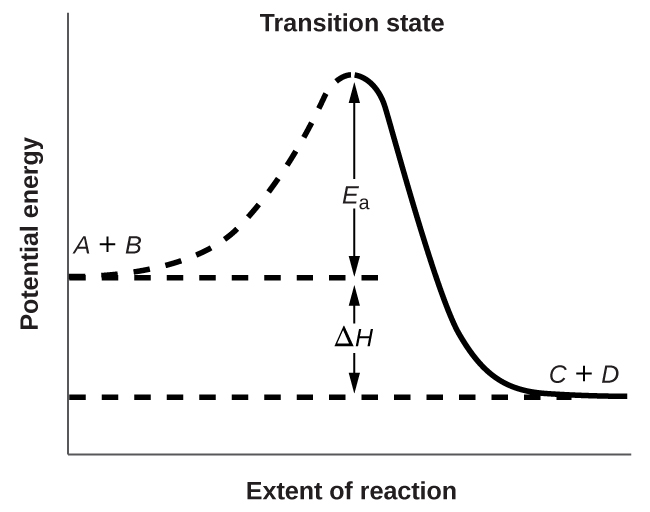
La figura\(\PageIndex{3}\) muestra las relaciones energéticas para la reacción general de una molécula de\(A\) con una molécula de\(B\) para formar moléculas de\(C\) y\(D\):
\[A+B⟶C+D \nonumber \]
La figura muestra que la energía del estado de transición es mayor que la de los reactivos\(A\) y\(B\) en una cantidad igual a\(E_a\), la energía de activación. Así, la suma de las energías cinéticas de\(A\) y\(B\) debe ser igual o mayor que E a para alcanzar el estado de transición. Después de que se ha alcanzado el estado de transición,\(C\) y a medida que y\(D\) comienza a formarse, el sistema pierde energía hasta que su energía total es inferior a la de la mezcla inicial. Esta energía perdida se transfiere a otras moléculas, dándoles suficiente energía para alcanzar el estado de transición. Por lo tanto, la reacción directa (que entre las moléculas\(A\) y\(B\)) tiende a tener lugar fácilmente una vez que la reacción ha comenzado. En la Figura\(\PageIndex{3}\),\(ΔH\) representa la diferencia en entalpía entre los reactivos (\(A\)y\(B\)) y los productos (\(C\)y\(D\)). La suma de\(E_a\) y\(ΔH\) representa la energía de activación para la reacción inversa:
\[C+D⟶A+B \nonumber \]
Podemos usar la ecuación de Arrhenius para relacionar la energía de activación y la constante de velocidad, k, de una reacción dada:
\[k=Ae^{−E_a/RT} \label{Arrhenius} \]
En esta ecuación,
- \(R\)es la constante de gas ideal, que tiene un valor de 8.314 J/mol/k,
- \(T\)es la temperatura en la escala Kelvin,
- \(E_a\)es la energía de activación en julios por mol,
- \(e\)es la constante 2.7183, y
- \(A\)es una constante llamada factor de frecuencia, que se relaciona con la frecuencia de colisiones y la orientación de las moléculas reaccionantes.
Ambos postulados de la teoría de colisión de las velocidades de reacción se acomodan en la ecuación de Arrhenius. El factor de frecuencia A está relacionado con la velocidad a la que ocurren las colisiones que tienen la orientación correcta. El término exponencial,\(e^{−E_a/RT}\), se relaciona con la fracción de colisiones proporcionando energía adecuada para superar la barrera de activación de la reacción.
En un extremo, el sistema no contiene suficiente energía para que las colisiones superen la barrera de activación. En tales casos, no se produce ninguna reacción. En el otro extremo, el sistema tiene tanta energía que cada colisión con la orientación correcta puede superar la barrera de activación, haciendo que la reacción continúe. En tales casos, la reacción es casi instantánea.
La ecuación de Arrhenius (Ecuación\ ref {Arrhenius}) describe cuantitativamente gran parte de lo que ya hemos discutido sobre las velocidades de reacción. Para dos reacciones a la misma temperatura, la reacción con la mayor energía de activación tiene la constante de velocidad más baja y la velocidad más lenta. El mayor valor\(E_a\) da como resultado un valor menor para\(e^{−E_a/RT}\), reflejando la fracción más pequeña de moléculas con suficiente energía para reaccionar. Alternativamente, la reacción con los más pequeños\(E_a\) tiene una mayor fracción de moléculas con suficiente energía para reaccionar. Esto se reflejará como un valor mayor de\(e^{−E_a/RT}\), una constante de velocidad mayor y una velocidad más rápida para la reacción.
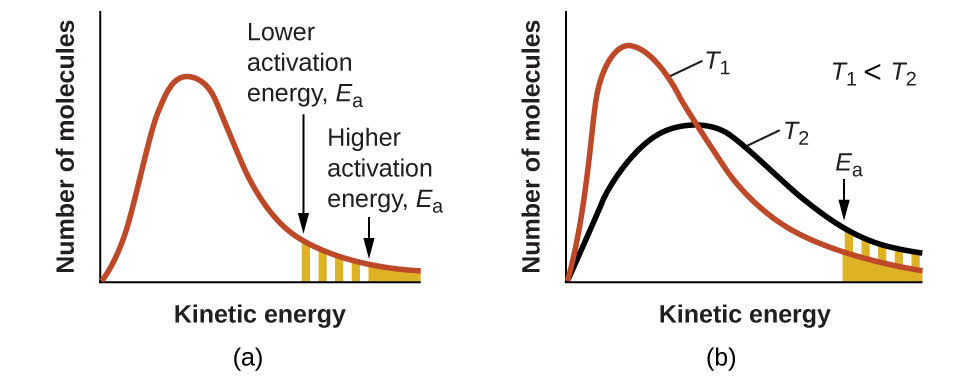
Figura\(\PageIndex{4}\): (a) A medida que disminuye la energía de activación de una reacción, aumenta el número de moléculas con al menos esta cantidad de energía, como lo demuestran las áreas sombreadas. (b) A mayor temperatura, T2, más moléculas tienen energías cinéticas mayores que Ea, como lo muestra el área sombreada amarilla.
Un aumento en la temperatura tiene el mismo efecto que una disminución en la energía de activación. Una fracción mayor de moléculas tiene la energía necesaria para reaccionar (Figura\(\PageIndex{4}\)), como lo indica un aumento en el valor de\(e^{−E_a/RT}\). La constante de velocidad también es directamente proporcional al factor de frecuencia,\(A\). De ahí que un cambio en las condiciones o reactivos que incremente el número de colisiones con una orientación favorable para la reacción da como resultado un incremento en\(A\) y, en consecuencia, un aumento de\(k\).
Un enfoque conveniente\(E_a\) para determinar una reacción implica la medición de\(k\) a diferentes temperaturas y el uso de una versión alternativa de la ecuación de Arrhenius que toma la forma de ecuación lineal:
\ [\ begin {align*}
\ ln k&=\ izquierda (\ dfrac {−e_a} {R}\ derecha)\ izquierda (\ dfrac {1} {T}\ derecha) +\ ln A\
y&=mx+b
\ end {align*}\ nonumber\]
Así, una gráfica de\(\ln k\) versus\(\dfrac{1}{T}\) da una línea recta con la pendiente\(\dfrac{-E_\ce{a}}{R}\), a partir de la cual se puede determinar Ea. La intercepción da el valor de\(\ln A\). Esto a veces se llama una trama de Arrhenius.
Determinación de E a Aquí se da la variación de la constante de velocidad con temperatura para la descomposición de HI (g) a H 2 (g) e I 2 (g). ¿Cuál es la energía de activación para la reacción?
\[\ce{2HI}(g)⟶\ce{H2}(g)+\ce{I2}(g) \nonumber \]
| T (K) | k (L/mol/s) |
|---|---|
| 555 | 3.52 × 10 −7 |
| 575 | 1.22 × 10 −6 |
| 645 | 8.59 × 10 −5 |
| 700 | 1.16 × 10 −3 |
| 781 | 3.95 × 10 −2 |
Solución
Los valores de\(\dfrac{1}{T}\) y ln k son:
| \(\mathrm{\dfrac{1}{T}\:(K^{−1})}\) | ln k |
|---|---|
| \ (\ mathrm {\ dfrac {1} {T}\: (K^ {−1})}\)” style="text-align:center; ">1.80 × 10 −3 | −14.860 |
| \ (\ mathrm {\ dfrac {1} {T}\: (K^ {−1})}\)” style="text-align:center; ">1.74 × 10 −3 | −13.617 |
| \ (\ mathrm {\ dfrac {1} {T}\: (K^ {−1})}\)” style="text-align:center; ">1.55 × 10 −3 | −9.362 |
| \ (\ mathrm {\ dfrac {1} {T}\: (K^ {−1})}\)” style="text-align:center; ">1.43 × 10 −3 | −6.759 |
| \ (\ mathrm {\ dfrac {1} {T}\: (K^ {−1})}\)” style="text-align:center; ">1.28 × 10 −3 | −3.231 |
La figura\(\PageIndex{5}\) es una gráfica de ln k versus\(\dfrac{1}{T}\). Para determinar la pendiente de la línea, necesitamos dos valores de ln k, los cuales se determinan a partir de la línea en dos valores de\(\dfrac{1}{T}\) (uno cerca de cada extremo de la línea es preferible). Por ejemplo, el valor de ln k determinado a partir de la línea cuando\(\dfrac{1}{T}=1.25×10^{−3}\) es −2.593; el valor cuando\(\dfrac{1}{T}=1.78×10^{−3}\) es −14.447.
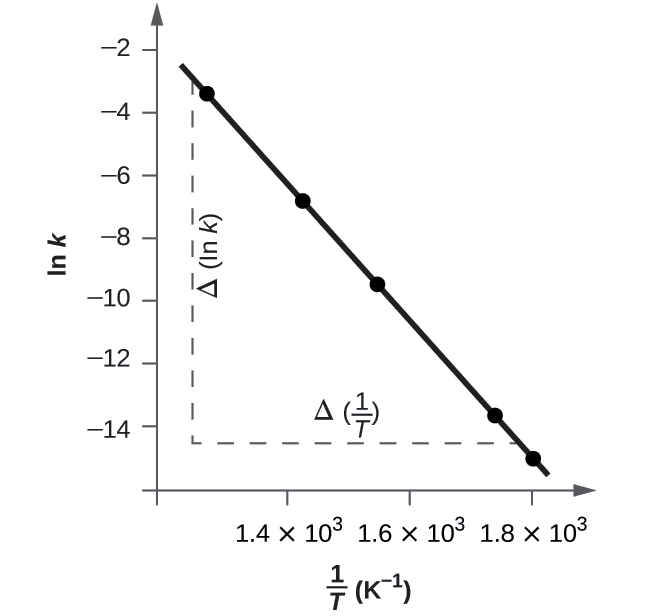
La pendiente de esta línea viene dada por la siguiente expresión:
\ [\ begin {alinear*}\ ce {Pendiente} &=\ dfrac {Δ (\ ln k)} {Δ\ izquierda (\ dfrac {1} {T}\ derecha)}\\
&=\ mathrm {\ dfrac {(−14.447) − (−2.593)} {(1.78×10^ {−3}\ :K^ {−1}) (− 1.78×10^ {−3}\ :K^ {−1}) (− 1.78×10^ {−3}\ :25×10^ {−3}\ :K^ {−1})}}\\
&=\ mathrm {\ dfrac {−11.854} {0.53×10^ {−3}\ :K^ {−1}} =2.2×10^4\ :K}\\
&=−\ dfrac {E_\ ce {a}} {R}
\ final {alinear*}\ nonumber\]
Así:
\[ \begin{align*} E_\ce{a} &=\mathrm{−slope×\mathit R=−(−2.2×10^4\:K×8.314\: J\: mol^{−1}\:K^{−1})} \\[4pt] &=\mathrm{1.8×10^5\:J\: mol^{−1}} \end{align*} \nonumber \]
En muchas situaciones, es posible obtener una estimación razonable de la energía de activación sin pasar por todo el proceso de construcción de la parcela de Arrhenius. La ecuación de Arrhenius:
\[\ln k=\left(\dfrac{−E_\ce{a}}{R}\right)\left(\dfrac{1}{T}\right)+\ln A \nonumber \]
se puede reorganizar como se muestra para dar:
\[\dfrac{Δ(\ln k)}{Δ\left(\dfrac{1}{T}\right)}=−\dfrac{E_\ce{a}}{R} \nonumber \]
o
\[\ln\dfrac{k_1}{k_2}=\dfrac{E_\ce{a}}{R}\left(\dfrac{1}{T_2}−\dfrac{1}{T_1}\right) \nonumber \]
Esta ecuación se puede reorganizar para dar un cálculo de un solo paso para obtener una estimación de la energía de activación:
\[E_\ce{a}=−R\left( \dfrac{\ln k_2−\ln k_1}{\left(\dfrac{1}{T_2}\right)−\left(\dfrac{1}{T_1}\right)}\right ) \nonumber \]
Utilizando los datos experimentales aquí presentados, podemos simplemente seleccionar dos entradas de datos. Para este ejemplo, seleccionamos la primera entrada y la última entrada:
| T (K) | k (L/mol/s) | \(\dfrac{1}{T}\:(K^{-1})\) | ln k |
|---|---|---|---|
| 555 | 3.52 × 10 −7 | \ (\ dfrac {1} {T}\: (K^ {-1})\)” style="text-align:center; ">1.80 × 10 −3 | −14.860 |
| 781 | 3.95 × 10 −2 | \ (\ dfrac {1} {T}\: (K^ {-1})\)” style="text-align:center; ">1.28 × 10 −3 | −3.231 |
Después de calcular\(\dfrac{1}{T}\) y ln k, podemos sustituir en la ecuación:
\[E_\ce{a}=\mathrm{−8.314\:J\:mol^{−1}\:K^{−1}\left(\dfrac{−3.231−(−14.860)}{1.28×10^{−3}\:K^{−1}−1.80×10^{−3}\:K^{−1}}\right)} \nonumber \]
y el resultado es E a = 185,900 J/mol.
Este método es muy efectivo, especialmente cuando se dispone de un número limitado de constantes de tasa dependientes de la temperatura para la reacción de interés.
La constante de velocidad para la velocidad de descomposición de N 2 O 5 a NO y O 2 en fase gaseosa es de 1.66 L/mol/s a 650 K y 7.39 L/mol/s a 700 K:
\[\ce{2N2O5}(g)⟶\ce{4NO}(g)+\ce{3O2}(g) \nonumber \]
Suponiendo que la cinética de esta reacción sea consistente con la ecuación de Arrhenius, se calcula la energía de activación para esta descomposición.
- Contestar
-
113,000 J/mol
Resumen
Las reacciones químicas requieren colisiones entre especies reaccionantes. Estas colisiones de reactivos deben ser de orientación adecuada y energía suficiente para dar como resultado la formación del producto. La teoría de colisiones proporciona una explicación simple pero efectiva del efecto de muchos parámetros experimentales sobre las velocidades de reacción. La ecuación de Arrhenius describe la relación entre la constante de velocidad de una reacción y su energía de activación, temperatura y dependencia de la orientación de colisión.
Ecuaciones Clave
- \(k=Ae^{−E_a/RT}\)
- \(\ln k=\left(\dfrac{−E_\ce{a}}{R}\right)\left(\dfrac{1}{T}\right)+\ln A\)
- \(\ln\dfrac{k_1}{k_2}=\dfrac{E_\ce{a}}{R}\left(\dfrac{1}{T_2}−\dfrac{1}{T_1}\right)\)
Glosario
- complejo activado
- (también, estado de transición) combinación inestable de especies reaccionantes que representan el estado energético más alto de un sistema de reacción
- energía de activación (E a)
- energía necesaria para que se produzca una reacción
- Ecuación de Arrhenius
- relación matemática entre la constante de velocidad y la energía de activación de una reacción
- teoría de colisiones
- modelo que enfatiza la energía y orientación de las colisiones moleculares para explicar y predecir la cinética de reacción
- factor de frecuencia (A)
- constante de proporcionalidad en la ecuación de Arrhenius, relacionada con el número relativo de colisiones que tienen una orientación capaz de conducir a la formación del producto


