4.1: Día 27- Termoquímica y Entalpía
- Page ID
- 78929
24
Día 27: Termoquímica y entalpía
D27.1 Energía, Temperatura y Calor
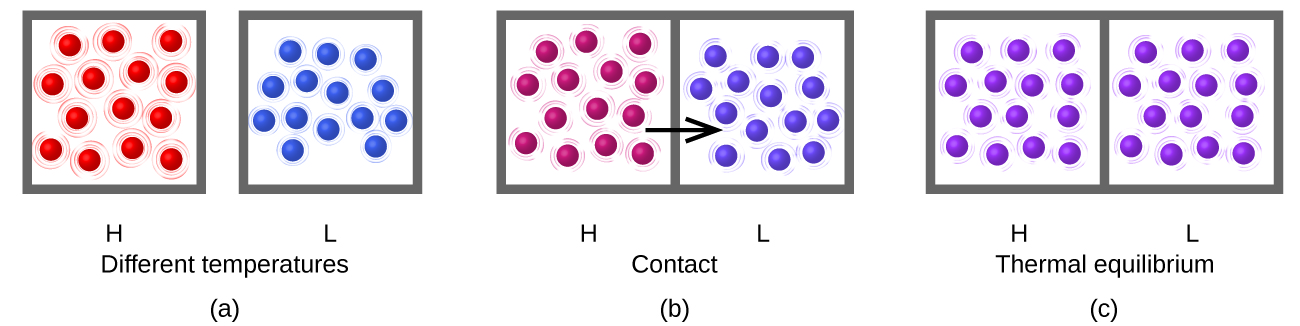
La energía térmica es la energía cinética asociada con el movimiento aleatorio de átomos y moléculas. Cuando la energía térmica se transfiere a un objeto, sus átomos y moléculas se mueven más rápido en promedio (mayor promedio KE), la temperatura del objeto aumenta, y decimos que el objeto está “más caliente”. Cuando la energía térmica se transfiere fuera de un objeto, sus átomos y moléculas se mueven más lentamente en promedio (menor promedio KE), la temperatura del objeto disminuye, y decimos que el objeto está “más frío”.
El calentamiento (o calor), representado por q, es la transferencia de energía térmica entre dos cuerpos a diferentes temperaturas (Figura 1).
La capacidad calorífica (C) de un objeto es el calentamiento requerido cuando la temperatura del objeto cambia 1 °C. (Debido a que 1 K tiene el mismo tamaño que 1 °C, Δ T tiene el mismo valor numérico ya sea expresado en K o °C.) Por lo general, tiene unidades de J/ °C. La capacidad calorífica depende tanto del tipo como de la cantidad de sustancia, y por lo tanto es una propiedad extensa, su valor es proporcional a la cantidad de la sustancia.
La capacidad calorífica específica (c) de una sustancia es el calentamiento requerido para elevar la temperatura de 1 g de una sustancia en 1 °C. Por lo general, tiene unidades de J/g·°C. La capacidad calorífica específica depende únicamente del tipo de sustancia y por lo tanto es una propiedad intensiva. La capacidad calorífica molar, también una propiedad intensiva, es la capacidad calorífica por mol de una sustancia en particular y típicamente tiene unidades de J/mol·°C.
Las capacidades caloríficas específicas de algunas sustancias comunes se enumeran en el Cuadro 1.
| Sustancia | Símbolo (estado) | Capacidad calorífica específica (J/g·°C) |
|---|---|---|
| helio | Él (g) | 5.193 |
| agua | H 2 O (l) | 4.184 |
| etanol | C 2 H 6 O (l) | 2.376 |
| hielo | H 2 O (s) | 2.093 (a −10 °C) |
| vapor de agua | H 2 O (g) | 1.864 |
| nitrógeno | N 2 (g) | 1.040 |
| oxígeno | O 2 (g) | 0.918 |
| aluminio | Al (s) | 0.897 |
| dióxido de carbono | CO 2 (g) | 0.853 |
| argón | Ar (g) | 0.522 |
| hierro | Fe (s) | 0.449 |
| cobre | Cu (s) | 0.385 |
| plomo | Pb (s) | 0.130 |
| oro | Au (s) | 0.129 |
| silicio | Si (s) | 0.712 |
| Cuadro 1. Capacidades Térmicas Específicas de Sustancias Comunes a 25 °C y 1 bar | ||
Si conocemos la masa, m, de una muestra y su capacidad calorífica específica, c, podemos calcular el calor transferido hacia o desde la muestra midiendo el cambio de temperatura durante el calentamiento o enfriamiento:
q = m·c· Δ T = m·c· (T final — T inicial)
El signo de Δ T nos indica si la sustancia se está calentando (valor positivo para q) o enfriada (q negativa).
D27.2 Calorimetría
La calorimetría es una técnica experimental utilizada para medir cuantitativamente la transferencia de calor de energía. La energía se intercambia con un calorímetro, un dispositivo con capacidad calorífica conocida que por lo tanto puede relacionar ΔT con q. Un calorímetro debe estar aislado térmicamente para que la energía no se transfiera más allá de sus límites físicos. En la calorimetría es útil definir un sistema, la (s) sustancia (s) que sufre el cambio químico o físico, y el entorno, todo lo demás que pueda intercambiar energía con el sistema.
Por ejemplo, si colocamos una pieza de metal caliente (M) en agua fría (W), la transferencia de calor de energía se produce del metal al agua hasta que las dos sustancias alcanzan la misma temperatura (Figura 2).
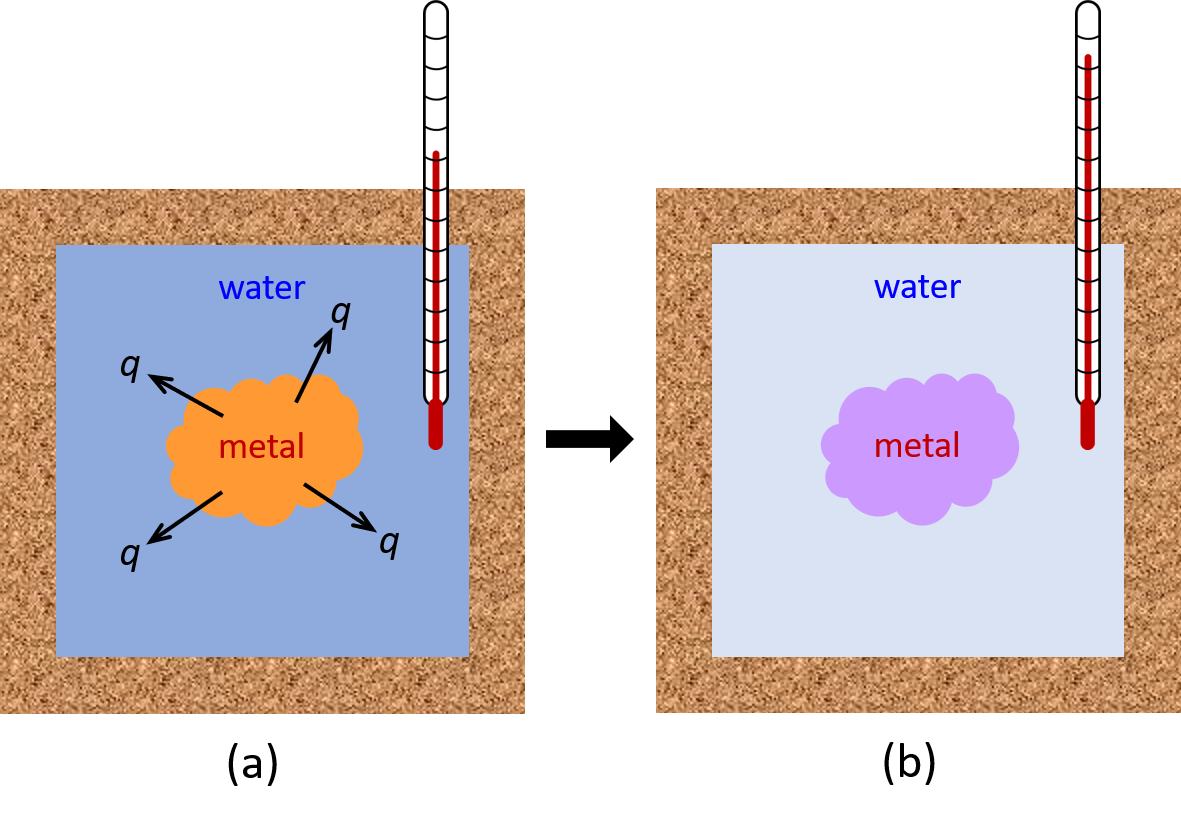
Si esto ocurre en un calorímetro bien aislado, esta transferencia de calor idealmente ocurriría solo entre las dos sustancias. Así, la magnitud de q es la misma para ambas sustancias.
q M + q W = 0
El signo aritmético de q está determinado por si la sustancia pierde o gana energía. En nuestro ejemplo, la energía se transfiere del metal (q M es negativo) al agua (q W es positivo).
Los mismos principios se aplican cuando aplicamos calorimetría para determinar la transferencia de calor de la energía involucrada en reacciones químicas:
q reacción + q alrededores = 0
Aquí, q reacción se define como el cambio en la energía de todos los átomos presentes en los reactivos y productos.
Una reacción en la que hay transferencia de calor de las sustancias reaccionantes a su entorno (una reacción que calienta el entorno) es una reacción exotérmica. Por ejemplo, la reacción de combustión que ocurre en la llama de una cerilla encendida es exotérmica. Una reacción en la que hay transferencia de calor del entorno al sistema (una reacción que enfría el entorno) es una reacción endotérmica. Por ejemplo, cuando se mezclan las sustancias en una bolsa fría (agua y una sal como el nitrato de amonio), el proceso resultante transfiere energía del entorno, haciendo que el entorno sea más frío.
Si la capacidad calorífica de un calorímetro es demasiado grande para descuidarla o si requerimos resultados más precisos, entonces debemos tomar en cuenta la energía transferida hacia o desde el calorímetro así como las transferencias de energía dentro del calorímetro. Por ejemplo, un tipo de calorímetro que opera a volumen constante, coloquialmente conocido como calorímetro de bomba porque involucra un contenedor fuerte, de acero que no explotará cuando se produzca una reacción exotérmica en su interior (la “bomba”). La calorimetría de bombas se utiliza para medir las transferencias de energía para reacciones como las reacciones de combustión. La reacción ocurre dentro de la bomba (Figura 3), la cual se sumerge en un baño de agua y se mide el cambio de temperatura del baño de agua. La energía tiene que ser transferida a la bomba para que la bomba pueda calentar el agua, por lo que es necesario tener en cuenta la capacidad calorífica de la bomba así como el agua. Es decir,
\[q_{\text{reaction}} = -[q_{\text{water}} + q_{\text{bomb}}] \nonumber \]

D27.3 Entalpía
La termodinámica química se ocupa de las relaciones entre el calor, el trabajo y otros medios de transferencia de energía en el contexto del proceso químico y físico s. El trabajo, representado por w, es un proceso que transfiere energía cinética a o a partir de un objeto macroscópico. Cuando un palo de golf golpea una pelota de golf, por ejemplo, el palo sí trabaja en la pelota, acelerando la pelota a una alta velocidad.
Las sustancias actúan como reservorios de energía. El total de todos los tipos posibles de energía presentes en una sustancia se llama la energía interna (U). (El símbolo U, en lugar de E, representa una suma sobre varios tipos diferentes de energía dentro de la sustancia.) La energía se transfiere a un sistema cuando es calentada (q) por el entorno o cuando el entorno funciona (w) en el sistema. Por ejemplo, la energía se puede transferir al alambre metálico a temperatura ambiente si se sumerge en agua caliente (el agua calienta el cable), o si dobla rápidamente el cable hacia adelante y hacia atrás (el cable se vuelve más cálido debido al trabajo realizado en él). Ambos procesos aumentan la energía interna del cable, lo que se refleja en un aumento en la temperatura del cable.
La relación entre la energía interna, el calor y el trabajo se puede representar por la ecuación:
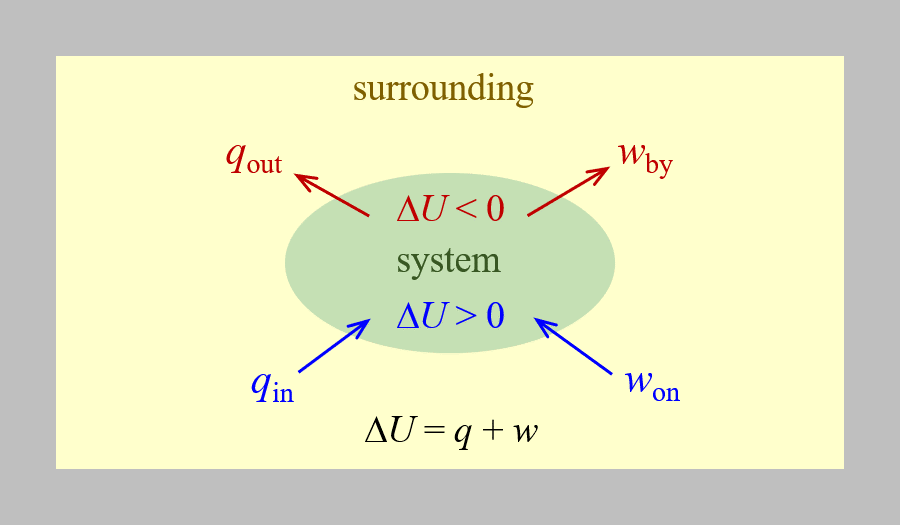
Δ U = q + w
asumiendo que no hay transferencias de energía que no sean calor y trabajo. Se trata de una versión de la primera ley de la termodinámica, la ley de conservación de la energía. La ecuación muestra que la energía interna de un sistema cambia a través de la transferencia de calor dentro o fuera del sistema (q positivo es transferencia de calor adentro; negativo q es transferencia de calor hacia fuera) o trabajo realizado en o por el sistema. El trabajo, w, es positivo si se realiza en el sistema (aumenta la energía interna del sistema) y negativo si es realizado por el sistema. Esto se resume en la siguiente figura.
Los químicos suelen utilizar una propiedad conocida como entalpía (H) para describir la termodinámica de los procesos químicos y físicos. La entalpía se define por esta ecuación:
H = U + PV
donde P es presión y V es volumen. La entalpía está estrechamente relacionada con la energía, diferenciándose por la cantidad PV.
Los valores de entalpía para sustancias específicas no se pueden medir directamente. Solo se pueden determinar los cambios de entalpía para procesos químicos o físicos. Para los procesos que tienen lugar a presión constante (una condición común para muchos cambios químicos y físicos que tienen lugar a presión atmosférica), el cambio de entalpía (Δ H) es:
Δ H = Δ U + Δ (PV) = Δ U + P Δ V
(donde P se factoriza de Δ (PV) porque P es constante). 
El producto matemático P Δ V representa el trabajo presión-volumen, también llamado trabajo de expansión. Por ejemplo, considere un gas (el sistema) confinado en un cilindro por un pistón, como se muestra en la figura. La presión ejercida por el gas resulta de muchas colisiones de moléculas de gas con el fondo del pistón y las paredes del cilindro. Si la presión del gas hace que el pistón se mueva hacia arriba, el gas sí funciona en el pistón (parte del entorno). Esta referencia muestra que el trabajo realizado por el sistema en los alrededores es igual a P Δ V. El trabajo realizado por el sistema es el negativo de w, que se define como el trabajo realizado en el sistema, por lo que
P Δ V = — w
Rendimientos sustitutivos:
| Δ H | = | Δ U + P Δ V |
| = | (q P + w) — w | |
| = | q P |
donde q p es el calor de reacción bajo presión constante. Por lo tanto, si se realiza un proceso químico o físico a presión constante con el único trabajo realizado causado por la expansión o contracción, entonces la transferencia de calor de energía (q p) equivale al cambio de entalpía (Δ H) para el proceso.
La transferencia de calor a los alrededores cuando se opera un quemador Bunsen es igual al cambio de entalpía de la reacción de combustión de metano que tiene lugar, debido a que la reacción ocurre a la presión esencialmente constante de la atmósfera. Los químicos suelen realizar experimentos en condiciones atmosféricas normales, a presión externa constante con q p = Δ H, lo que hace que la entalpía sea la opción más conveniente para determinar la transferencia de calor de energía como resultado de una reacción química. El cambio de entalpía para una reacción química se simboliza Δ r H, donde el subíndice r indica que el cambio es para una r eacción.
Por otro lado, la transferencia de calor de energía por una reacción medida en un calorímetro de bomba no es igual a Δ H porque el contenedor metálico cerrado de volumen constante evita que se produzcan trabajos de expansión. En un sistema de volumen constante w = 0 y Δ U = q v + w = q v, donde el subíndice v indica volumen constante.
D27.4 Cambio de entalpía de reacción en estado estándar, Δ r H°
Los efectos térmicos de una reacción química se resumen en expresiones termoquímicas, ecuaciones químicas balanceadas junto con valores de Δ r H°, el cambio de entalpía de reacción en estado estándar y una temperatura. El cambio de entalpía de reacción en estado estándar, Δ r H°, es la entalpía de estado estándar de productos puros sin mezclar menos la entalpía de estado estándar de los reactivos puros no mezclados; es decir, el cambio de entalpía para la reacción en condiciones de estado estándar.
Δ r H° = H° (productos) — H° (reactivos)
Un estado estándar es un conjunto de condiciones comúnmente aceptadas que se utilizan como punto de referencia. Para los químicos, el estado estándar se refiere a sustancias bajo una presión de 1 bar y soluciones a una concentración de 1 mol/L (1 M). (Tenga en cuenta que algunas tablas termoquímicas pueden enumerar valores con un estado estándar de 1 atm. Debido a que 1 bar = 0.987 atm, los valores termoquímicos son casi los mismos en ambos conjuntos de condiciones estándar; sin embargo, para un trabajo preciso se debe verificar el estado estándar).
El estado estándar no especifica una temperatura. Debido a que Δ r H° puede variar con la temperatura, la temperatura se especifica típicamente en una expresión termoquímica.
Incluiremos un superíndice “º” para designar estado estándar. Así, el símbolo Δ rH °288indica un cambio de entalpía para un proceso que ocurre en condiciones de estado estándar y a 298 K.
Por ejemplo, considere esta expresión termoquímica:
2 H 2 (g) + O 2 (g) ⟶ 2 H 2 O (g) Δ r H° = 8.031 × 10 −22 kJ = −483.6 kJ/mol (25 °C)
Esto se refiere a la reacción de dos moléculas de hidrógeno con 1 molécula de oxígeno para formar dos moléculas de agua, todas en fase gaseosa a 1 bar de presión. Si esta ecuación de reacción se realizara una vez, las dos moléculas de hidrógeno y una molécula de oxígeno reaccionarían para formar dos moléculas de agua y 8.031 × 10 −22 kJ serían transferidas a los alrededores. Debido a que estamos interesados en las reacciones a escala de laboratorio, donde están involucrados moles de reactivos, Δ r H° siempre se reporta por mol de reacción en lugar de por un solo evento de reacción. Un mol de reacción implica una ecuación de reacción química sucediendo 6.022 × 10 23 veces; en este caso es decir 2 mol H 2 (g) reaccionando con 1 mol O 2 (g) para dar 2 mol H 2 O (g). La transferencia de calor de energía al entorno es entonces 8.031 × 10 −22 kJ × 6.022 × 10 23 mol −1 = 483.6 kJ/mol. Debido a que la transferencia de energía es del sistema al entorno, el signo es negativo y Δ r H° = −483.6 kJ/mol.
Estas convenciones se aplican a las expresiones termoquímicas:
- En una expresión termoquímica, el valor listado Δ r H ° indica la transferencia de calor de energía para los coeficientes en la ecuación química. Si los coeficientes se multiplican por algún factor, Δ r H ° se debe multiplicar por ese mismo factor. En otras palabras, Δ r H° es una propiedad extensa. Por ejemplo:
2 H 2 (g) + O 2 (g) ⟶ 2 H 2 O (g) Δ r H° = −483,6 kJ/mol aumento de dos veces: 4 H 2 (g) + 2 O 2 (g) ⟶ 4 H 2 O (g) Δ r H° = 2 (−483,6 kJ/mol) = -967,2 kJ/mol disminución de dos veces: H 2 (g) + ½ O 2 (g) ⟶ H 2 O (g) Δ r H° = ½ (−483,6 kJ/mol) = -241,8 kJ/mol - Δ r H ° de una reacción depende del estado físico de los reactivos y productos (ya sea que tengamos gases, líquidos, sólidos o soluciones acuosas), por lo que se deben mostrar los estados físicos.
- Un negativo Δ r H ° indica una reacción exotérmica; un positivo Δ r H ° indica una reacción endotérmica. Si se invierte la dirección de una ecuación química, se cambia el signo aritmético de su Δ r H °. (Un proceso que es endotérmico cuando los reactivos se convierten en productos es exotérmico cuando los productos se convierten en reactivos).
Asegúrese de tener en cuenta tanto la estequiometría como los reactivos limitantes al determinar el Δ r H° para una reacción química.
D27.5 Entalpía de enlace y cambio de entalpía de reacción
El cambio de entalpía para una reacción química en fase gaseosa, Δ r H, equivale a la suma de la entalpía requerida para romper cada uno de los enlaces en las moléculas reaccionantes (energía en, signo positivo) más la suma de la entalpía liberada cuando cada uno de los enlaces en el producto formas de moléculas (salida de energía, signo negativo). Esto se puede expresar matemáticamente como:
Δ r H = E bonos rotos — E bonos formados
Debido a que los valores de entalpía de enlace proporcionados en el Apéndice se promedian sobre muchas moléculas diferentes para cada tipo de enlace, este cálculo no es exacto, pero proporciona una buena estimación para el cambio de entalpía de cualquier reacción específica. Además, los cálculos de entalpía de enlace asumen que todas las moléculas están lejos entre sí (lo que significa que los reactivos y productos deben estar en fase gaseosa). Los cambios de entalpía adicionales ocurren cuando un gas se condensa en líquido o sólido o se disuelve en una solución; estas transformaciones no son contabilizadas por entalpías de enlace.
Considera esta reacción equilibrada:
H 2 (g) + Cl 2 (g) → 2 HCl (g)
Se rompen un enlace H-H (436 kJ/mol) y un enlace Cl—Cl (242 kJ/mol); se forman dos enlaces H-Cl (431 kJ/mol cada uno). Representando entalpías de enlace por enlace D, tenemos:
Δ r H = E bonos rotos — E bonos formados = [D H-H + D Cl -Cl] — [D H-Cl + D H-Cl]
Δ r H = [436 kJ/mol + 242 kJ/mol] — 2 (431 kJ/mol) = -184 kJ/mol
Hay el mismo número de bonos formados que se rompieron. Debido a que los enlaces en los productos son más fuertes que los de los reactivos, la reacción tiene una liberación neta (signo negativo) de aproximadamente 184 kJ por cada mol de reacción tal como está escrito. La energía liberada aumenta la temperatura del entorno (la reacción es exo térmica).
Aquí hay dos reglas generales para predecir si una reacción química libera energía (es exotérmica):
- Si hay más enlaces en las moléculas del producto que en las moléculas reaccionantes y los enlaces tienen aproximadamente la misma fuerza, la reacción es exotérmica.
- Si hay enlaces más fuertes en las moléculas del producto que en las moléculas reaccionantes y el número de enlaces es el mismo en reactivos y productos, la reacción es exotérmica.
Comprueba tu aprendizaje
D27.6 Ley de Hess
El cambio de entalpía para una reacción en particular es el mismo independientemente de en qué etapas o en qué etapas se lleve a cabo la reacción. Esto nos permite calcular convenientemente la transferencia de calor para un cambio químico de otros cambios de entalpía determinados experimentalmente. Este tipo de cálculo suele implicar la ley de Hess: Si un proceso puede escribirse como la suma de varios procesos paso a paso, el cambio de entalpía del proceso total es igual a la suma de los cambios de entalpía de los distintos pasos.
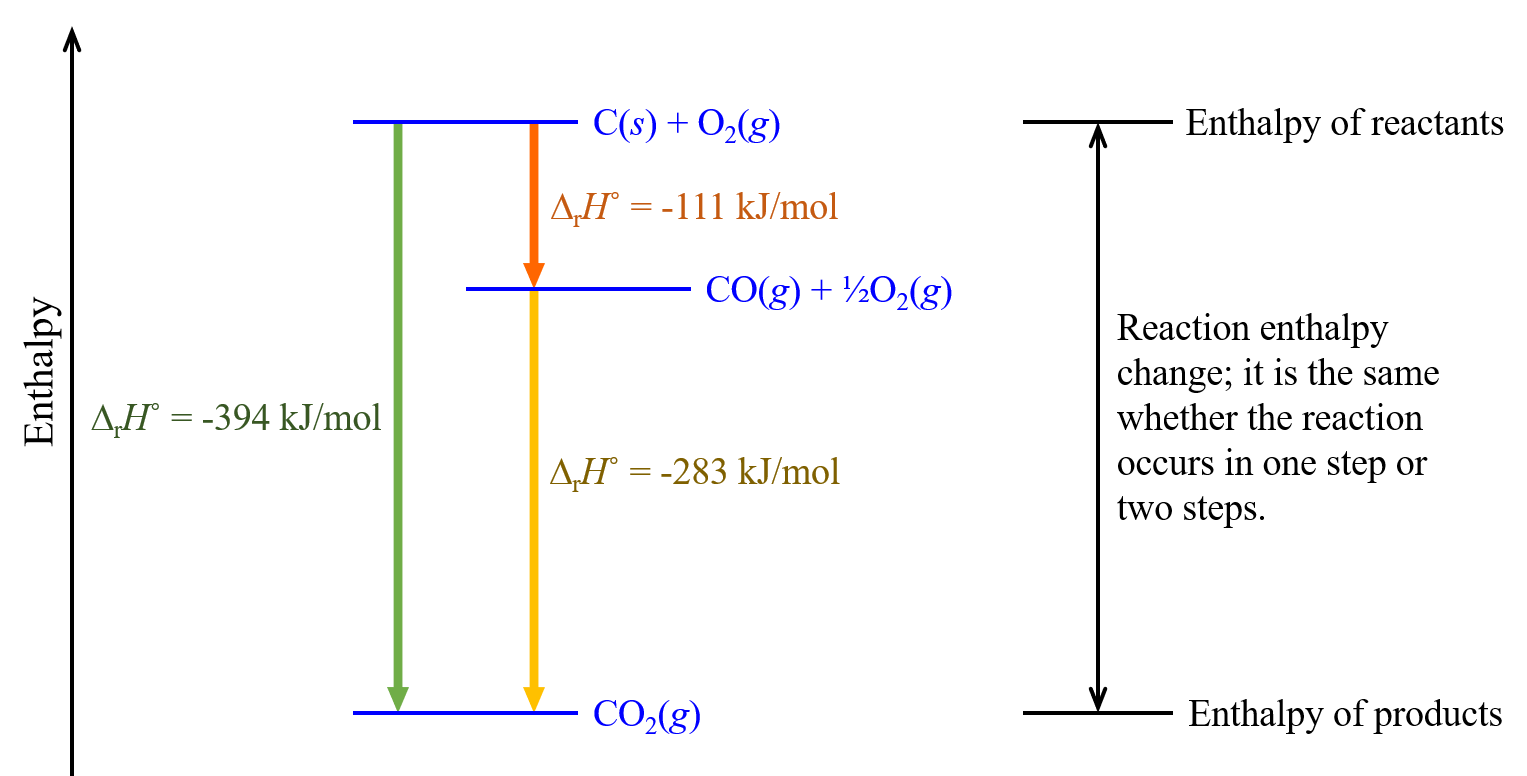
Por ejemplo, podemos pensar en esta reacción ocurriendo en un solo paso:
C (s) + O 2 (g) ⟶ CO 2 (g) Δ r H° = -394 kJ/mol
o en un proceso de dos pasos:
| paso 1: | C (s) + ½O 2 (g) | ⟶ | CO (g) | Δ r H° = -111 kJ/mol |
| paso 2: | CO (g) + ½O 2 (g) | ⟶ | CO 2 (g) | Δ r H° = -283 kJ/mol |
De acuerdo con la ley de Hess, el Δ r H° de la reacción de un solo paso equivale a la suma de la Δ r H° de las dos etapas en la reacción de dos etapas:
| paso 1: | C (s) + ½O 2 (g) | ⟶ | CO (g) | Δ r H° = -111 kJ/mol |
| paso 2: | CO (g) + ½O 2 (g) | ⟶ | CO 2 (g) | Δ r H° = -283 kJ/mol |
| Suma: | C (s) + O 2 (g) | ⟶ | CO 2 (g) | Δ r H° = -394 kJ/mol |
Este concepto se ilustra en la Figura 4.
D27.7 Entalpía Estándar de Formación
La entalpía estándar de formación, Δ f H°, es el cambio de entalpía para una reacción en la que exactamente un mol de una sustancia pura en un estado especificado (s, l o g) se forma a partir de elementos libres en sus estados más estables bajo condiciones de estado estándar . Δ f H° también se conoce como el calor estándar de formación.
Por ejemplo, Δ f H° de CO 2 (g) a 25 °C es −393.5 kJ/mol. Este es el cambio de entalpía para la reacción exotérmica:
C (s, grafito) + O 2 (g) ⟶ CO 2 (g) Δ f H° = -393.5 kJ/mol (25 °C)
El reactivo gaseoso y el producto están a una presión de 1 bar, el carbono está presente como grafito, que es la forma de carbono más estable bajo condiciones estándar.
Para el dióxido de nitrógeno, NO 2 (g), Δ f H° es 33.2 kJ/mol a 25 °C:
½N 2 (g) + O 2 (g) ⟶ NO 2 (g) Δ f H° = +33.2 kJ/mol (25 °C)
Una ecuación de reacción con ½ mol de N 2 y 1 mol O 2 es apropiada en este caso porque la entalpía estándar de formación siempre se refiere a la formación de 1 mol NO 2 (g).
Por definición, la entalpía estándar de formación de un elemento en su forma más estable es de 0 kJ/mol en condiciones estándar. En el Apéndice se puede encontrar una tabla de valores δ f H° para muchas sustancias comunes.
La ley de Hess se puede utilizar para determinar el Δ r H° de cualquier reacción si el Δ f H° de los reactivos y productos están disponibles. En otras palabras, podemos pensar que cualquier reacción ocurre a través de la descomposición escalonada de los reactivos en sus elementos componentes seguida de la recombinación de los elementos para dar los productos. (Casi ninguna reacción ocurriría realmente a través de tal mecanismo porque algunas de las reacciones tendrían grandes barreras activación-energía y consecuentemente tasas muy pequeñas, pero podemos imaginar tal camino con el único propósito de usar la ley de Hess para calcular Δ r H°. )
Por lo tanto, el Δ r H° de la reacción global es igual a:
Δ r H° = Δ f H° (productos) — Δ f H° (reactivos)
Actividad 1: Aplicación de la Ley de Hess a las entalpías de formación estándar
Pregunta Podia
El monofluoruro de cloro puede reaccionar con flúor para formar trifluoruro de cloro:
\[(i)\;\text{ClF}(g) + \text{F}_2(g) \longrightarrow \text{ClF}_3(g) \;\;\;\;\; \Delta _\text{r}H\text{°}= \;? \nonumber \]
Utilice las reacciones aquí para determinar el Δ r H ° para la reacción (i):
\[(ii)\;2\text{OF}_2(g) \longrightarrow \text{O}_2(g) + 2\text{F}_2(g) \;\;\;\;\; \Delta _\text{r}H\text{°}_{(ii)} = -49.4 \;\text{kJ/mol} \nonumber \]
\[(iii)\;2\text{ClF}(g) + \text{O}_2(g) \longrightarrow \text{Cl}_2 \text{O}(g) + \text{OF}_2(g) \;\;\;\;\; \Delta _\text{r}H\text{°}_{(iii)} = +205.6 \;\text{kJ/mol} \nonumber \]
\[(iv)\;\text{ClF}_3(g) + \text{O}_2(g) \longrightarrow \dfrac{1}{2}\text{Cl}_2 \text{O}(g) + \dfrac{3}{2} \text{OF}_2(g) \;\;\;\;\; \Delta_\text{r}H\text{°}_{(iv)} = +266.7 \;\text{kJ/mol} \nonumber \]
Dos días antes de la próxima sesión de toda la clase, esta pregunta de Podia se pondrá en vivo en Podia, donde podrás enviar tu respuesta.


