2.1: Introducción a la Espectroscopia UV
- Page ID
- 79118
Para comenzar una historia sobre espectroscopia, probablemente sea más fácil comenzar con longitudes de onda de luz que la gente pueda ver. Hay todo tipo de radiación electromagnética a nuestro alrededor, en su mayoría proveniente del sol, y solo una delgada porción de las longitudes de onda en el medio son visibles para el ojo.
Probablemente ya sepas que si miras una luz blanca, lo que estás viendo es realmente un compuesto, una mezcla de todos los diferentes colores de luz. Si haces brillar esa luz a través de un prisma (realmente, cualquier objeto de vidrio que varíe en grosor, que tenga un borde más grueso y un borde más delgado), puedes separar la luz blanca en estos diferentes colores.
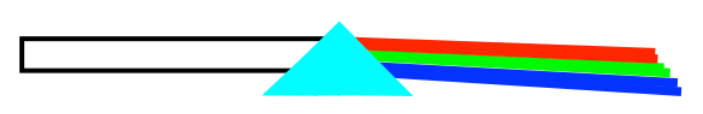
Entonces, ¿qué pasa cuando ves un objeto coloreado? ¿Quizás una camioneta azul cobalto o un granero rojo? El objeto está absorbiendo algunos de esos fotones, esos pequeños paquetes de luz. Pero el objeto es muy selectivo; tomará estos fotones, pero no esos, y tampoco esos otros.
El color que ves está hecho solo de los fotones sobrantes, los que no se absorbieron. A veces usamos la rueda de colores para hacer un seguimiento de este fenómeno. En parte por cómo nuestros ojos procesan la luz, cuando algo absorbe un color en un lado de la rueda de colores, vemos el color en el lado opuesto.
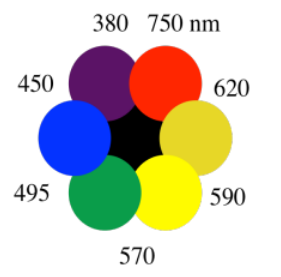
Cuando algo absorbe fotones anaranjados, por ejemplo, vemos el color complementario, el del lado opuesto de la rueda de colores. Vemos azul. Por lo que la camioneta se ve azul porque absorbe la luz naranja. El granero se ve rojo porque absorbe la luz verde.
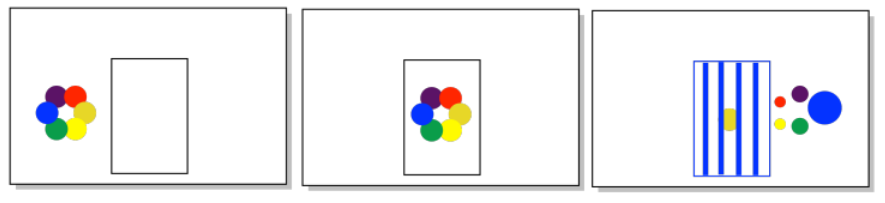
Se observa un objeto coloreado. Estimar la longitud de onda de la luz que fue absorbida por el objeto.
a) una manzana verde b) un plátano amarillo c) una cereza roja d) una uva de color púrpura intenso
- Contestar
-
a) 700 nm (solo una estimación, pero tal vez en algún lugar entre 620 y 750 nm)
b) 425 nm c) 540 nm d) 580 nm
Entonces, ¿qué hace que diferentes cosas absorban diferentes colores de luz visible? Existen diferentes factores con diferentes tipos de materiales. Lo que todos tienen en común, sin embargo, es que involucran transiciones electrónicas. En realidad, lo mismo ocurre con la luz ultravioleta, aunque no podemos ver tan lejos en el espectro. Cuando se absorbe la luz ultravioleta o visible, en general los fotones están interactuando con electrones en el material.
Y ¿qué pasa con los electrones cuando interactúan con la luz? Bueno, los fotones tienen energía, así que cuando los fotones interactúan con los electrones, transfieren su energía a los electrones. Nosotros decimos que los electrones se excitan, o que son promovidos a un nivel superior. Si nos fijamos en un modelo simple de Bohr del átomo, de principios del siglo XX, pensamos en los electrones orbitando el núcleo en conchas. Cada caparazón está un poco más lejos del núcleo, y a una energía mayor que la que está debajo de ella. Si un átomo absorbe un fotón, uno de los electrones es promovido a un nivel superior.
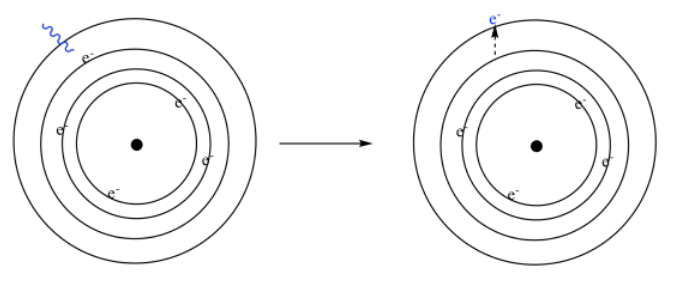
Estos niveles de energía electrónica ocurren a intervalos muy específicos. Es por eso que un átomo específico podría absorber solo fotones específicos. La energía del fotón tiene que coincidir, más o menos exactamente, con la cantidad de energía que un electrón necesitaría para saltar de un nivel a otro.
Ahora bien, podría parecer que cualquier átomo tendría muchos niveles de energía electrónica posibles diferentes dando lugar a muchas transiciones posibles entre un nivel y otro. En ese caso, cualquier átomo debería absorber o desprender todo tipo de fotones, y no deberíamos ver ningún color específico en absoluto. Sin embargo, realmente existen algunas limitaciones sobre las posibles transiciones en un átomo dado. Es más, casi todas estas transiciones corresponden a la energía ultravioleta, que de todos modos no podemos ver, y entonces lo que sí observamos son las pocas transiciones que realmente involucran luz visible.
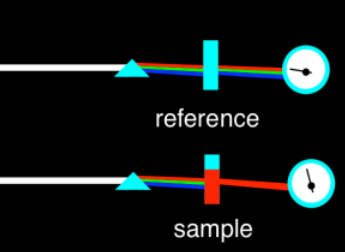
Podemos medir las longitudes de onda de la luz que son absorbidas por un material usando un espectrómetro UV. El espectrómetro produce una gráfica de absorbancia versus longitud de onda. La longitud de onda, en el eje x, generalmente se mide en nanómetros. La absorbancia, en el eje y, suele ser adimensional; eso es porque es una fracción. Es la relación de cuánta luz es absorbida por la muestra en comparación con cuánta fue absorbida por alguna referencia, algo con lo que comparamos la muestra. En la mayoría de los casos, la muestra se disuelve en un solvente como agua de etanol, por lo que la referencia es solo solvente simple. Esa solución se sostiene en una vasija transparente llamada cubeta, a menudo hecha de cuarzo o de un tipo de plástico que no absorbe mucha luz en las longitudes de onda que queremos mirar.
La gráfica típica que obtenemos parece una colina ancha y redondeada, o tal vez un par de colinas. Podría parecer que tal vez solo debería haber una longitud de onda que se absorba, dado lo que tenemos permitidas estas transiciones electrónicas muy específicas. Eso puede ser cierto con los átomos en fase gaseosa, pero en la fase condensada —en sólidos o líquidos o en soluciones— las cosas se vuelven mucho más desordenados. Hay muchas razones para ello, la mayoría de las cuales parecen completamente ajenas a la absorción de luz, como colisiones y otras interacciones entre moléculas que están chaleando en la cubeta.
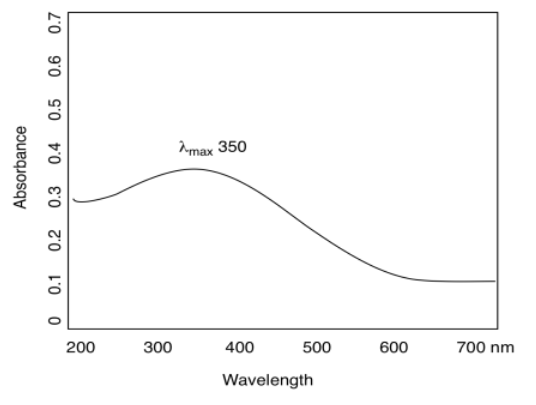
En cualquier caso, el punto más alto de esa colina se elige como una especie de índice diagnóstico, llamado el máximo de absorción o λ máx. Esta es la longitud de onda a la que el compuesto absorbe más luz. En el espectro aquí mostrado, ese punto ocurre alrededor de 350 nm, justo fuera del rango visible.
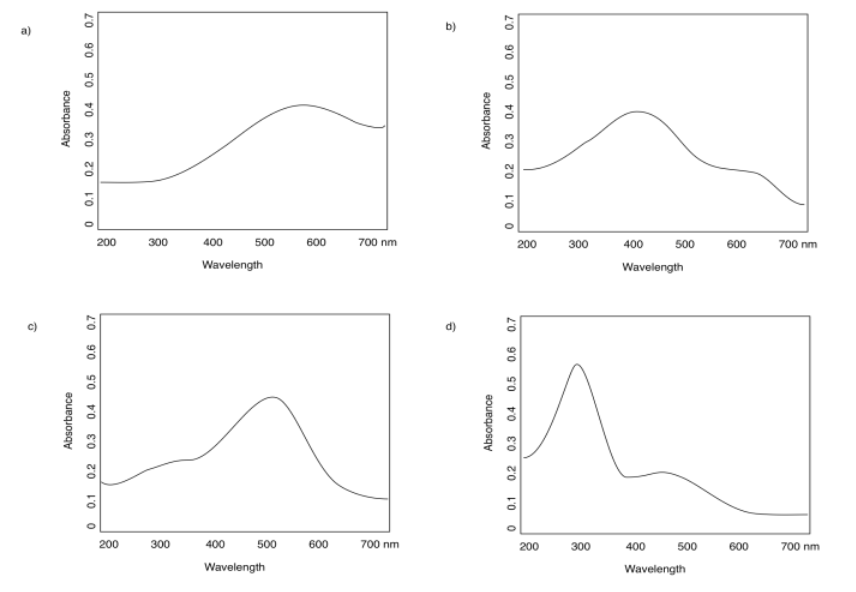
- Contestar
-
a) 590 nm b) 400 nm c) 500 nm d) 300 nm
Algunos de los espectros de la pregunta anterior tienen dos absorbancias diferentes: una fuerte y otra débil. Estimar los máximos de absorción de cada uno.
- Contestar
-
a) 590 nm (fuerte); eso es todo b) 400 nm (fuerte); 600 nm (débil)
c) 500 nm (fuerte); 350 nm (débil) d) 300 nm (fuerte); 450 nm (débil)
Quizás te preguntes qué pasa después de que el electrón se excita. ¿Cómo vuelve a bajar? En realidad hay algunas formas diferentes para que eso suceda, pero probablemente la forma más común es a través de procesos llamados relajación sin radiación, en los que la energía absorbida por el fotón finalmente se pierde en los alrededores. A menudo termina en forma de calor.
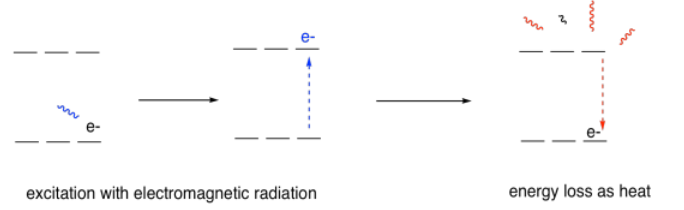
Por otro lado, si un electrón excitado se excitara de alguna otra manera, como por el gran calor, para luego caer de su nivel promovido de nuevo hacia abajo a uno por debajo, la energía que perdió podría ser desprendida por un fotón. Este fenómeno se denomina emisión o fluorescencia, dependiendo de las circunstancias. Nuevamente, sólo se desprenderían ciertos fotones, dependiendo del átomo involucrado.
Esa especificidad permite a los analistas estudiar la composición de ciertos materiales, como los minerales minerales, o buscar iones metálicos en las aguas subterráneas. También abastece algo de la diversión de los fuegos artificiales; la gente sabe desde hace algún tiempo que las sales de litio y estroncio son buenas para los fuegos artificiales rojos, cobre para los azules, calcio para naranja, bario para verde, sodio para amarillo.
Clasifica estos fuegos artificiales desde el fotón más energético emitido hasta el menos energético.
- Contestar
-
Recuerde, aquí estamos observando los fotones directamente, en lugar de los onew complementarios a los fotones absorbidos.
cobre > bario > sodio > calcio > litio

