2.2: Espectroscopia UV-Visible - Iones Metálicos
- Page ID
- 79117
Los metales de transición a menudo se asocian con compuestos de colores brillantes. Debido a su electronegatividad relativamente baja, los metales de transición se encuentran frecuentemente como iones cargados positivamente, o cationes. En solución, los iones metálicos no nadarían por sí mismos, sino que atraerían otras moléculas hacia ellos. Estas moléculas se unen a los iones metálicos, formando complejos de coordinación.
Estos complejos de metales de transición o complejos de coordinación tienen muchos electrones, y a menudo pueden interactuar con muchos fotones diferentes. Cuando lo hacen, hay una serie de posibles transiciones electrónicas que pueden resultar. Estas transiciones podrían involucrar al ion metálico en sí mismo, o los ligandos, aquellas moléculas o iones que se unen al ion metálico.
Una transición muy común se llama transición de transferencia de carga. Implica la excitación de un electrón del ligando al metal, o viceversa. A veces, el primer caso se denomina transferencia de carga de ligando a metal, o LMCT; el último caso sería una transferencia de carga de metal a ligando, o MLCT. Sin embargo, estos dos acrónimos a veces se utilizan interchageablemente para sugerir algún tipo de transición que involucra tanto al ligando como al metal, sin preocuparse demasiado por la dirección.
Además, a veces los electrones pueden excitarse de un nivel a otro, solo en el ion metálico. Para los metales de transición, estas excitaciones electrónicas se denominan transiciones d-d. Para los metales de transición, los electrones de valencia están en la subcapa d, y en una transición d-d, el electrón se excita de un nivel d a otro. Eso suena como que podría ser bastante fácil —el electrón no va muy lejos, después de todo— pero las transiciones d-d son en realidad bastante ineficientes. Las transiciones electrónicas involucradas simplemente no son muy buenas para capturar fotones.
En comparación, puede parecer que sería difícil mover un electrón desde el metal hasta el ligando, pero en realidad es bastante fácil. Estas transiciones electrónicas interactúan con los fotones de manera muy eficiente.
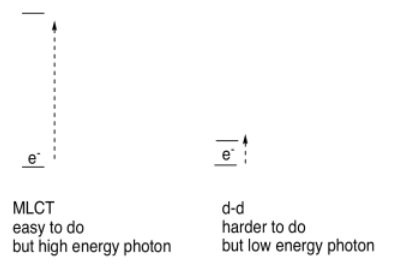
Como resultado, existe una especie de relación contraintuitiva en los espectros UV-Visible de los complejos de metales de transición: las transiciones d-d requieren muy poca energía pero ocurren con relativa poca frecuencia, lo que significa que dan absorbancias muy débiles en el espectro. Las transiciones MLCT requieren mucha más energía pero ocurren con frecuencia, lo que lleva a absorbancias más fuertes en el espectro.
No nos vamos a preocupar por qué ocurren diferentes transiciones electrónicas con mayor o menor eficiencia; eso tiene que ver con la simetría y la teoría de grupos, y algunas matemáticas que no estamos equipados para manejar en este momento. Solo necesitamos entender que estas distinciones pueden influir en el aspecto de los espectros UV.
Proponer una fórmula para una inosita simple y monocatenaria que contenga únicamente contraiones de sodio.
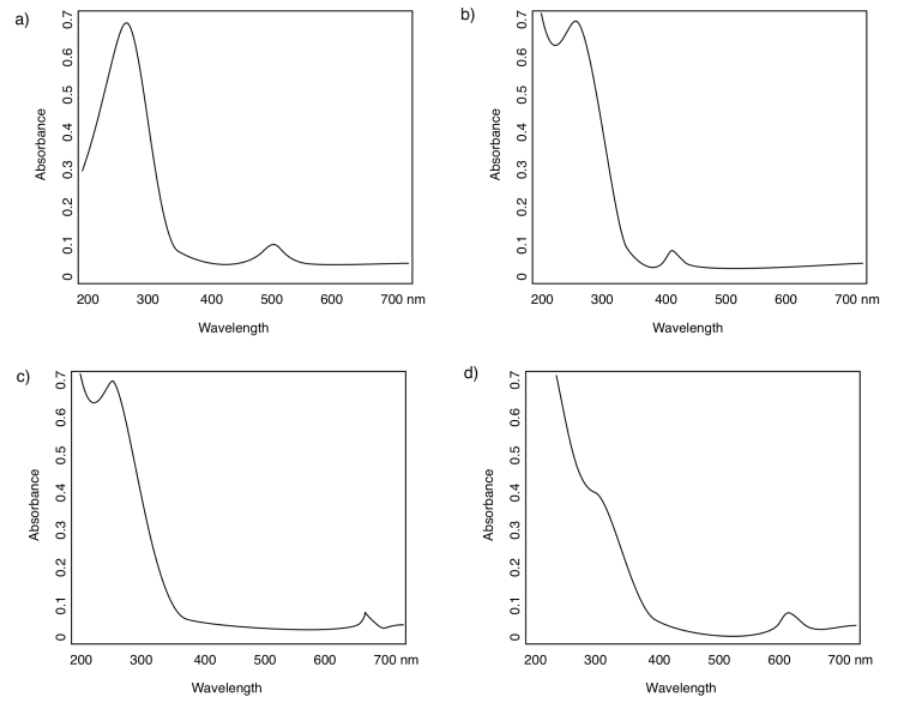
En los siguientes espectros, asigne los “picos” o bandas de absorbancia observados a las transiciones MLCT o d-d.
- Contestar
-
a) 270 nm (fuerte, MLCT); 500 nm (débil, d-d)
b) < 200 nm* (muy fuerte, MLCT); 275 nm (fuerte, MLCT); 400 nm (débil, d-d) *no puedo ver exactamente dónde porque el pico es tan alto que no podemos ver la parte superior
c) < 200 nm* (muy fuerte, MLCT); 275 nm (fuerte, MLCT); 660 nm (débil, d-d)
d) < 250 nm (fuerte, MLCT); 300 nm (fuerte, MLCT); 620 nm (débil, d-d)
En los espectros anteriores, predecir el color observado de cada uno de los complejos.
- Contestar
-
a) absorbe azul-verde; vemos naranja-rojo
b) absorbe violeta; vemos amarillo
c) absorbe rojo; vemos verde
d) absorbe naranja; vemos azul
La idea de la espectroscopia UV es que diferentes compuestos puedan absorber fotones de diferentes longitudes de onda en función de sus estructuras electrónicas. Podríamos ver el espectro UV de un compuesto y decir su identidad o estructura; esa tarea sería especialmente sencilla si tuviéramos algunas opciones diferentes para elegir.
Ahora vemos que el eje y también importa en cierta medida. Un compuesto específico podría absorber a 250 nm y a 450 nm; sin embargo, una característica adicional de ese compuesto podría ser que absorbe muy fuertemente a 250 nm y solo débilmente a 450 nm. Saber esa información podría ayudarnos a distinguir el espectro de ese compuesto del espectro de otro que tiene longitudes de onda de absorción similares, pero que muestra picos en el espectro UV de tamaños muy diferentes.
Cuán fuertemente un compuesto absorbe fotones a una longitud de onda particular se describe por una cantidad llamada coeficiente de extinción (o alternativamente, en diferentes variaciones, el coeficiente de absorción o el coeficiente de absortividad molar).
Por ejemplo, se puede demostrar que el permanganato potásico acuoso, KMnO 4, a su máxima absorción de 530 nm, tiene un coeficiente de extinción ε = 14 L g -1 cm -1. La cantidad de luz que absorbe una muestra de permanganato de potasio a esa longitud de onda depende de un par de factores adicionales, sin embargo. En primer lugar, ¿qué tan concentrada está la muestra? Cuanto más permanganato de potasio haya disuelto en la muestra, más luz puede absorber. Además, cuanto más tiempo viaje la luz a través de la cubeta, más permanganato encontrará, y así más luz absorberá.
Por lo tanto, la absorbancia se puede describir como
\[A= \varepsilon c l\]
en el cual\(ε\) = coeficiente de extinción,\(l\) = longitud de ruta,\(c\) = concentración.
La mayoría de las cubetas son de 1 cm de ancho; si el coeficiente de extinción contiene una unidad de cm -1, solo podemos usar b = 1 cm y esa parte está cuidada. A partir de ahí, la absorbancia solo dependerá de la concentración del permanganato.
Calcular la absorbancia a 530 nm para las siguientes concentraciones de permanganato de potasio en una cubeta de 1 cm.
a) 0.025 g/L b) 0.011 g/L
- Contestar
-
a) A = ε c l = 14 L g -1 cm -1 x 0.025 g L -1 x 1 cm = 0.35
a) A = ε c l = 14 L g -1 cm -1 x 0.011 g L -1 x 1 cm = 0.15
Calcular la concentración de permanganato de potasio (en g/L) dadas las siguientes lecturas de absorbancia a 530 nm en una cubeta de 1 cm.
a) A = 0.75 b) A = 0.21
- Contestar
-
a) A = ε c l o c = A/(ε l) = 0.75/(14 L g -1 cm -1 x 1 cm) = 0.054 g L -1
b) A = ε c l o c = A/(ε l) = 0.21/(14 L g -1 cm -1 cm -1 x 1 cm) = 0.015 g L -1
Aunque la absorción máxima es de alrededor de 530 nm, la banda de absorción visible en permanganato de potasio en realidad se extiende de 500 a 600 nm. ¿De qué color es el permanganato de potasio?
- Contestar
-
Basado en nuestra rueda de colores absorbe tanto amarillo como verde; vemos una mezcla de violeta y rojo. (KMnO 4 es realmente un morado profundo.)
Frecuentemente, los coeficientes de extinción tienen unidades de L mol -1 cm -1 o M -1 cm -1. En estos casos, la concentración se mide en mol L-1 en lugar de g L-1. El peso molecular (masa molar) del compuesto, en g mol -1, es el factor de conversión entre una unidad y la otra. Por ejemplo, el coeficiente de extinción para el pico de 530 nm de permanganato de potasio es aproximadamente de 2 200 L mol -1 cm -1.
Confirmar que los dos coeficientes de extinción para el permanganato de potasio, dados con diferentes unidades, son en realidad equivalentes.
- Contestar
-
KMnO 4 tiene MW = 158 g mol -1
14 L g -1 cm -1 x 158 g mol -1 = 2212 L mol -1 cm -1
Calcular la absorbancia a 530 nm para las siguientes concentraciones de permanganato de potasio en una cubeta de 1 cm.
a) 1.5 x 10 -4 mol /L b) 9.0 x 10 -5 mol/L
- Contestar
-
a)\(A = \varepsilon c l = 2200 \frac{L}{mol \: cm} \times 0.00015 \frac{mol}{L} \times 1 cm = 0.33\)
b)\(A = \varepsilon c l = 2200 \frac{L}{mol \: cm} \times 0.00009 \frac{mol}{L} \times 1cm = 0.20\)
Calcular la concentración de permanganato de potasio (en mol/L) dadas las siguientes lecturas de absorbancia a 530 nm en una cubeta de 1 cm.
a) A = 0.47 b) A = 0.89
- Contestar
-
a)\(A = \varepsilon c l \: or \: c = \frac{A}{\varepsilon l} = \frac{0.47}{2200 \frac{L}{mol \: cm} \times 1cm} = 2.1 \times 10^{-4} \frac {mol}{L}\)
b)\(A = \varepsilon c l \: or \: c \frac{A}{\varepsilon l} = \frac{0.89}{2200 \frac{L}{mol \: cm} \times 1cm} = 4.1 \times 10^{-4} \frac{mol}{L}\)
Ver discusión adicional de los complejos de coordinación.

