4.13: RMN en Laboratorio- Impurezas Solventes
- Page ID
- 79104
Uno de los problemas más complicados en laboratorio es lidiar con el análisis de una mezcla. Esta situación no es infrecuente cuando los estudiantes realizan experimentos en laboratorio y analizan los datos. Por ejemplo, un estudiante puede haber agregado un disolvente como parte de un procedimiento de purificación. Tal vez la muestra se recristalizó a partir de metanol. Tal vez la muestra se purificó por extracción con solvente, y aún contiene un poco de humedad de cuando se expuso al agua. En estos casos, el disolvente se mostrará en el espectro de RMN.
- A veces los solventes aparecen en el espectro.
- En este caso, probablemente deberías hacer dos conjuntos completamente separados de tablas de datos para tu análisis, una para cada compuesto, o bien una para el compuesto principal y otra para las impurezas.
A medida que avanza por un espectro, debe pensar en cualquier solvente con el que la muestra pueda haber contactado. Busque evidencia de esas cosas en el espectro, también.
Aquí hay algunos ejemplos de solventes que podrían usarse en el laboratorio. Probablemente también puedas pensar en otros.
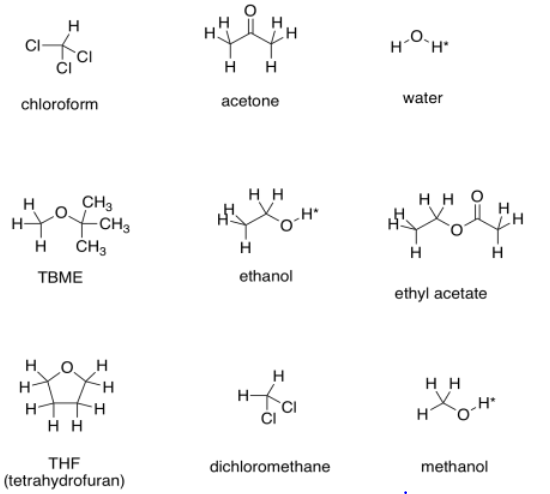
Los asteriscos por los protones OH en estos disolventes indican que estas son “posiciones intercambiables”. En solventes próticos, o solventes capaces de formar enlaces de hidrógeno (cualquier compuesto que contenga enlaces O-H o N-H), el protón unido al oxígeno o nitrógeno tiene algún comportamiento inusual en el espectro de RMN. No solemos observar multiplicidad en picos correspondientes a estos protones. A menudo los picos son muy amplios, y a veces faltan por completo (especialmente si hay humedad en la muestra).
A ver si puedes predecir cómo sería la espectra de RMN de estos disolventes.
a) TBME b) acetona c) acetato de etilo d) THF e) diclorometano f) cloroformo
g) metanol h) etanol i) agua
- Responder
-
a) TBME b) acetona c) THF d) metanol e) acetato de etilo
Veamos un ejemplo. A lo mejor trabajaste con una muestra de p-clorbenzaldehído en el laboratorio.
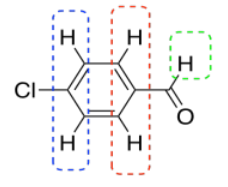
Crees que sabes cómo se vería eso en la RMN. Todos los hidrógenos están unidos a sp 2 o carbonos planos trigonales. Todos deberían estar en algún lugar de la mitad izquierda del espectro, tal vez entre 5 y 10 ppm. Algunos de los hidrógenos son simétricamente equivalentes. Hay un par de hidrógenos en el anillo de benceno que se ven iguales entre sí; están más cerca del cloro. Otro par está más cerca del carbonilo, la unidad C=O. Esperamos ver dos picos en el espectro de RMN para estos hidrógenos, a pesar de que hay un total de cuatro de ellos, porque solo se encuentran en dos grupos. Debido a que todos están en un benceno, podríamos incluso mirar más cerca de 7 ppm en el espectro. Además, ambos conjuntos de hidrógenos tienen un solo vecino que es diferente de ellos mismos. Estos hidrógenos deben aparecer ambos como dobletes.
Eso no son todos los hidrógenos que hay en la molécula. También hay un hidrógeno en el carbonilo. Debido al doble enlace al oxígeno electronegativo, esta posición será fuertemente deshield. Deberíamos buscarlo más cerca de 10 ppm. Sin embargo, no tiene vecinos de hidrógeno. Esperamos ver una singlete.
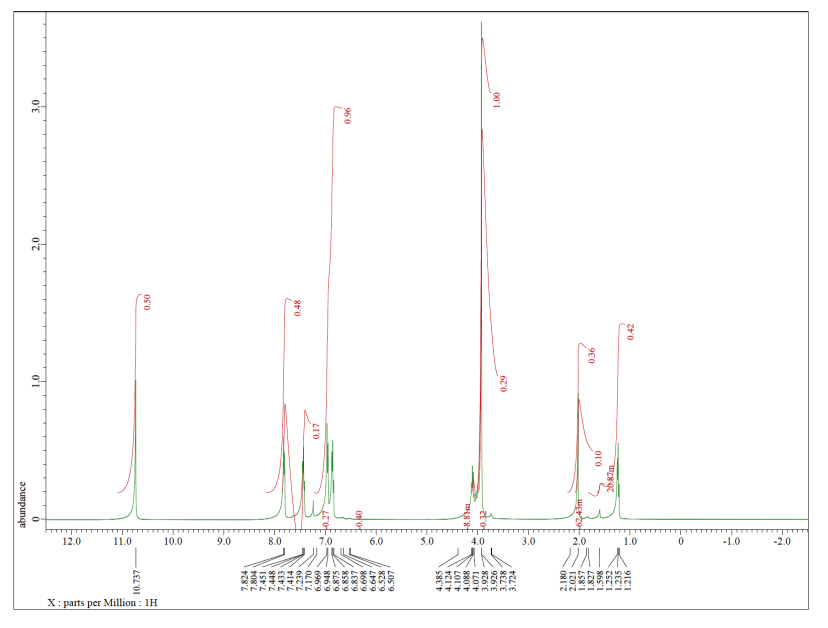
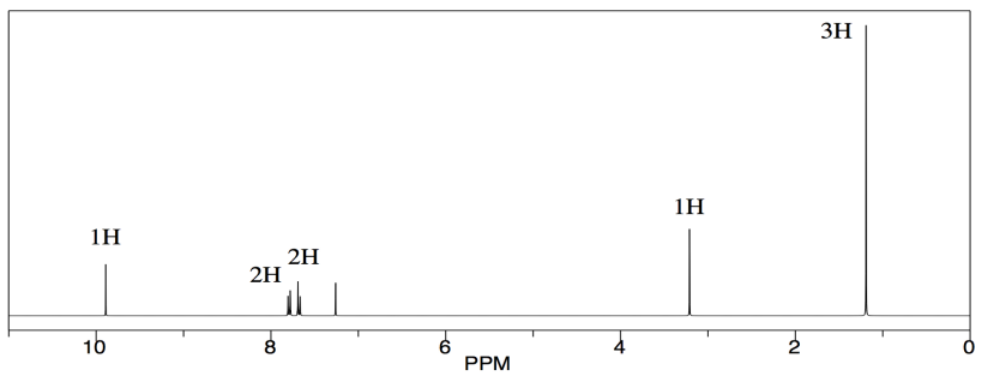
El espectro que vemos tiene todas esas características. Obsérvese que este espectro está integrado (se ha medido el área de cada pico), y muestra el pico a 10 ppm corresponde a 1H, mientras que los más cercanos a 7 ppm corresponden a 2H cada uno. Esa información corresponde a lo que vemos en la estructura.
Pero vemos otras cosas, también. A lo mejor sabemos que el compuesto una vez se disolvió en TBME, (CH 3) 3 COCH 3. Todo el TBME probablemente se evaporó, pero nunca se puede estar muy seguro.
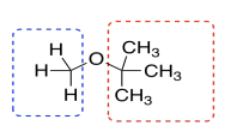
TBME tiene solo dos tipos de hidrógeno, y ambos están en carbonos tetraédricos o sp 3. Probablemente aparecerían en el lado derecho del espectro, por debajo de 5 ppm. Los que están en el carbono junto al otro carbono se mostrarían más cerca de 1 ppm. Los que están en el carbono junto al oxígeno aparecerían a 3 o 4 ppm. Nosotros sí vemos esos picos en este espectro.
Además, solo hay 3 hidrógenos en el carbono junto al oxígeno en TBME. Hay 9 hidrógenos en los grupos metilo unidos al carbono. Están en una relación 1:3, por lo que deberíamos ver esa relación reflejada en la integración en la RMN.
Hay un pico más en el espectro, y es una impureza de algún tipo, pero no forma parte de la muestra original. El singlete alrededor de 7 ppm es solo cloroformo, CHCl 3.

Ahora bien, el disolvente de RMN utilizado aquí es en realidad deuterocloroformo, CdCl 3. El isótopo pesado de hidrógeno, deuterio o 2 H, se utiliza en este disolvente. Eso es porque no queremos que los protones en el solvente se interpongan en el camino. 2 H aparece en un área del espectro completamente diferente a 1 H, por lo que es invisible en un espectro de RMN de 1H regular. Hay una gran cantidad de solvente en el tubo de RMN, y una pequeña cantidad de la muestra real, y tiene que ser así para que el experimento funcione. Sin embargo, si solo usáramos CHCl 3 como disolvente, solo veríamos un pico en el espectro de RMN: el hidrógeno de CHCl 3. La muestra que nos interesa aparecería, tal vez, como picos diminutos, diminutos. Entonces, en cambio, usamos CdCl 3, que es invisible en el espectro de hidrógeno.
Bueno, los solventes deuterados son muy, muy caros, y el costo para asegurarse de que todos los átomos de hidrógeno en cloroformo sean reemplazados por deuterio sería prohibitivo. Así que siempre hay un poco de ChCl 3 todavía en el CdCl 3, y aparece en el espectro 1H.
Es útil tener a mano una lista de impurezas solventes comunes cuando miras tu espectro. En la siguiente tabla se proporcionan algunos ejemplos, en los que se muestran los datos que verías de disolventes comunes en un espectro de RMN tomado en cloroformo.
| solvente | número de picos | turno | multiplicidad | relación integral | asignación |
| agua | 1 | 1.56 | br. s | - | O- H |
| acetona | 1 | 2.17 | s | - | (C=O) C H 3 |
| cloroformo | 1 | 7.26 | s | - | Cl 3 C- H |
| t-butil metil éter | 2 | 1.19 | s | 3 | C (C H 3) 3 |
| 3.22 | s | 1 | O-C H 3 | ||
| acetato de etilo | 3 | 1.26 | t | 3 | CH 2 C H 3 |
| 2.05 | s | 3 | (C=O) C H 3 | ||
| 4.12 | q | 2 | OC H 2 CH 3 | ||
| tetrahidrofurano | 2 | 1.85 | m | 1 | CH 2 -C H 2 -CH 2 |
| 3.76 | m | 1 | CH 2 -C H 2 -O | ||
| metanol | 2 (generalmente) | 1.09 | br s (puede estar ausente) | 1 | O- H |
| 3.49 | s | 3 | O-C H 3 | ||
| etanol | 3 (generalmente) | 1.25 | t | 1 | CH 2 C H 3 |
| 1.32 | br s (puede estar ausente) | 2 | O- H | ||
| 3.72 | q | 3 | OC H 2 CH 3 | ||
| diclorometano | 1 | 5.32 | s | - | Cl 2 C H 2 |
| grasa o alcanos | 2 | 0.86 | m | varía; más pequeño | CH 2 C H 3 |
| 1.26 | m | varía; más grande | CH 2 C H 2 CH 2/CH 2 C H 2 CH 3 |
Una excelente tabla, incluyendo desplazamientos de una variedad de impurezas en diferentes disolventes de RMN, se puede encontrar en el siguiente artículo: Gottlieb, H. E.; Kotlyar, V.; Nudelman, A. J. Org. Chem. 1997, 62, 7512-7515.
Tenga en cuenta que estos compuestos aparecerían en lugares ligeramente diferentes si se disolvieran en algo que no fuera cloroformo. La tabla de Gottlieb también enumera dónde se verían en otros solventes de RMN comunes.
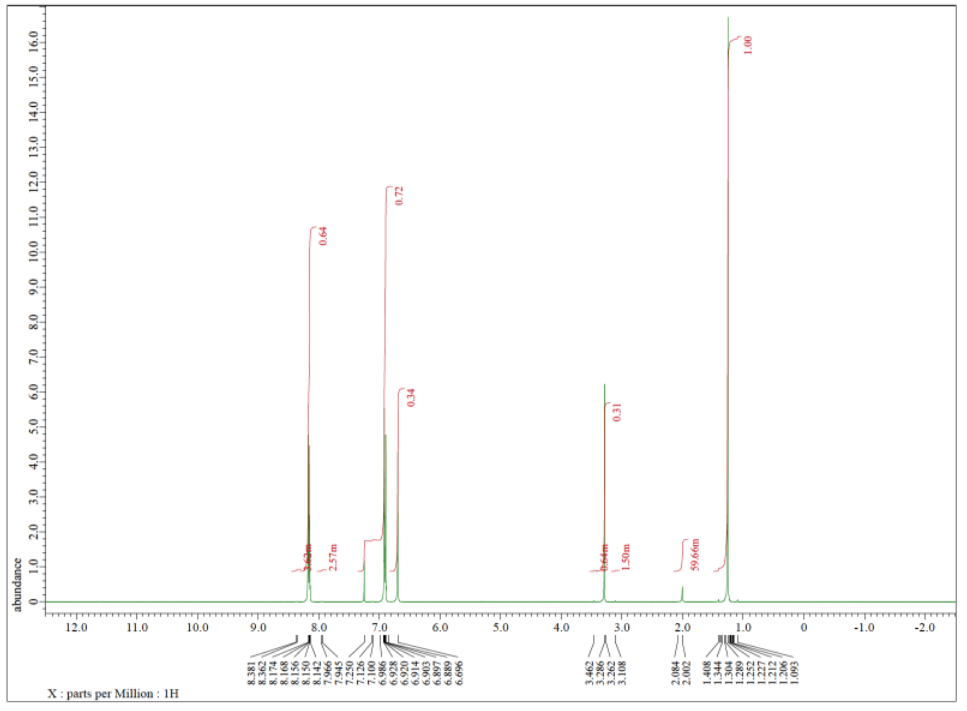
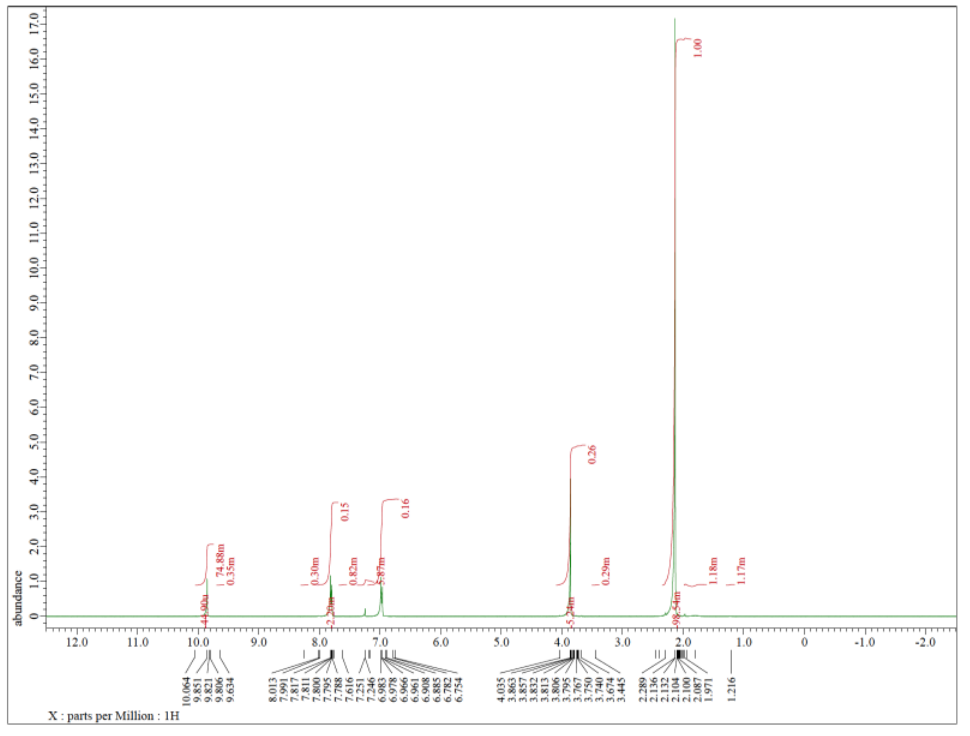
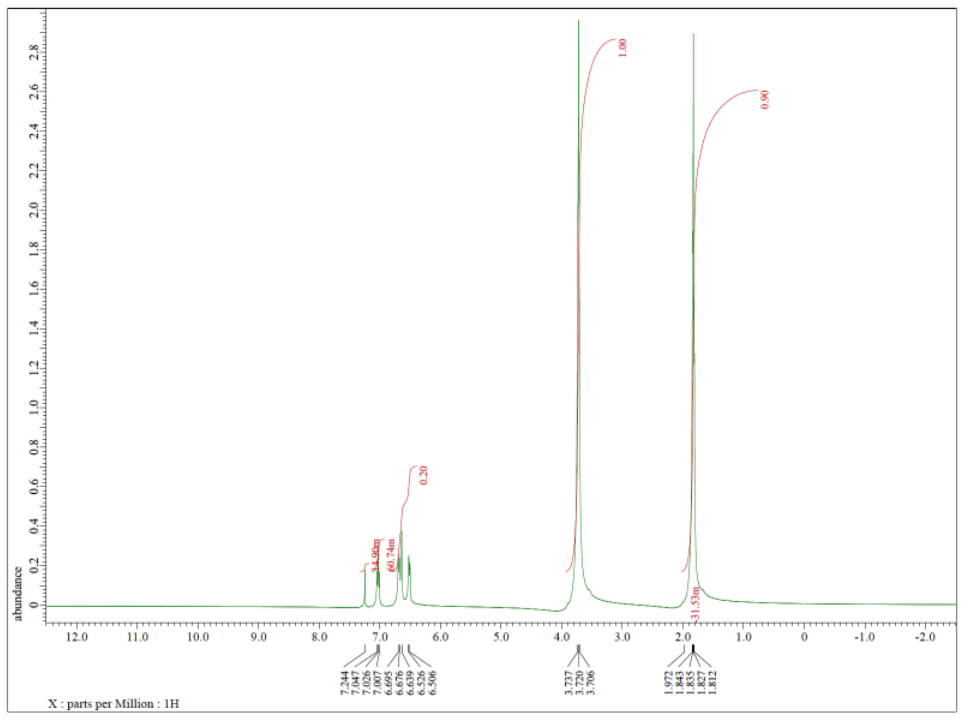
Cada uno de los siguientes espectros contiene una impureza de disolvente: acetona, acetato de etilo, metanol, TBME o THF. Hacer coincidir el espectro con la impureza.
a)
b)
c)
d)
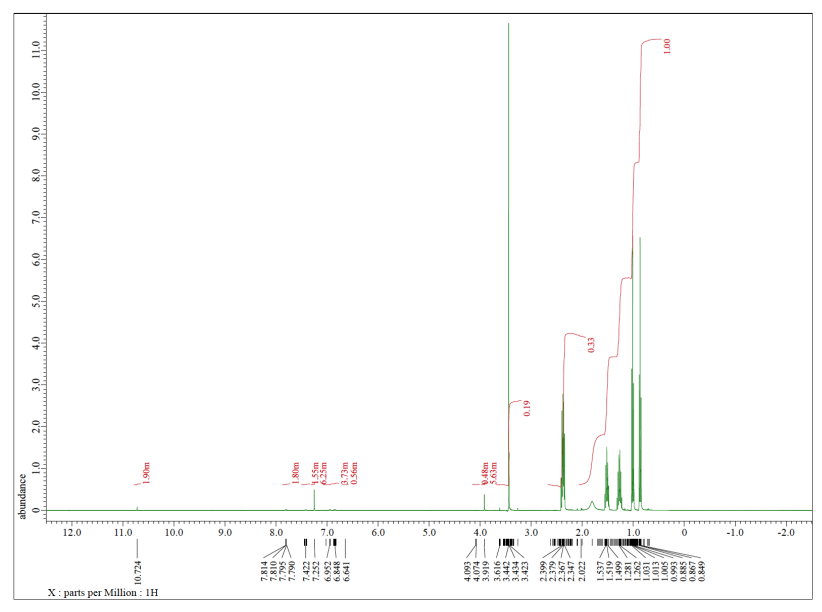
e)