4.14: RMN en Laboratorio- Monitoreo del Progreso de las Reacciones
- Page ID
- 79116
Si estás corriendo una reacción, lo más probable es que sepas con qué empezaste. También puedes tener una idea bastante buena de lo que vas a hacer. La gran pregunta es si la reacción funcionó (o, tal vez, no pasó nada en absoluto). Si funcionaba, ¿obtuviste el producto que pensabas que harías, o obtuviste algo inesperado?
En estos casos:
- Debe llamar la atención sobre los datos que apoyan más fuertemente su estructura esperada. Este enfoque demostrará la comprensión evaluativa de los datos; eso significa que puede mirar los datos y decidir qué partes son más cruciales que otras.
- También debes llamar la atención sobre los resultados negativos: es decir, picos que podrían estar ahí si este espectro coincidiera con otra, posible estructura, pero que de hecho faltan.
Uno de los problemas más complicados de tratar es el análisis de una mezcla. Esta situación no es infrecuente cuando los estudiantes realizan reacciones en laboratorio y analizan los datos.
- A veces los espectros muestran un poco de material de partida mezclado con el producto.
- A veces los espectros muestran solo un poco de producto y mucho material de partida.
- En estos casos, probablemente deberías hacer dos conjuntos completamente separados de tablas de datos para tu análisis, uno para cada compuesto, o bien uno para el compuesto principal y otro para las impurezas.
Veamos un ejemplo de una reacción. Un estudiante está ejecutando un tipo de reacción llamada oxidación. Ella está comenzando con el alcohol 3-metoxibencílico y tratando de convertirlo en 3-metoxibenzaldehído. Ella sigue las indicaciones cuidadosamente, pero ¿cómo sabrá si tiene éxito?
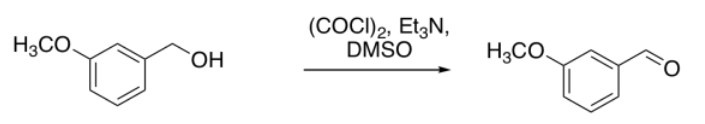
Ella mira el espectro, y ve un grupo de hidrógenos aromáticos, y un singlete grande cerca de 4 ppm, que podrían ser los hidrógenos en el grupo metoxi. Esos son tranquilizadores, pero no le interesan tanto, porque aparecerían en su espectro haya procedido o no la reacción. Esos picos serían todos más o menos los mismos en su material de partida.
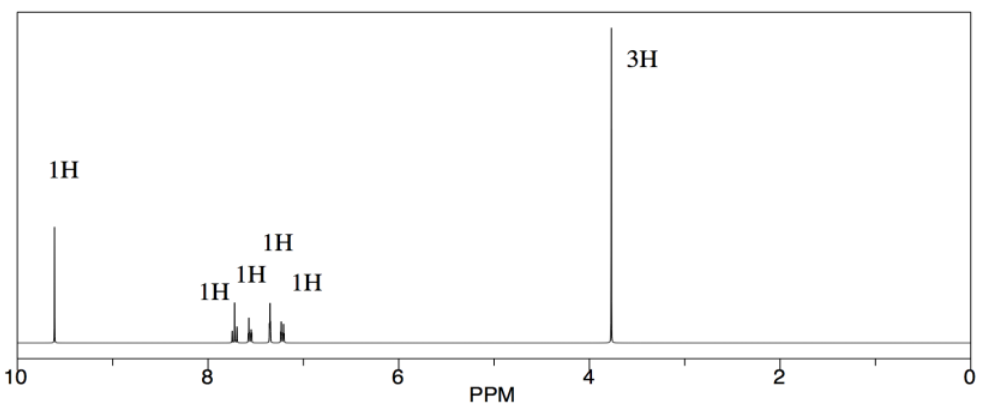
En cambio, ella nota el pico cerca de 10 ppm. Eso es significativo. Su producto tendría un protón aldehído, y eso mostraría alrededor de 10 ppm. A lo mejor la reacción funcionó.
Ella también echa un vistazo alrededor de 5 ppm. Ahí no hay nada, y ella piensa que eso también es interesante. En su alcohol inicial, tenía protones sobre un carbono que estaba entre un areno y un oxígeno, Ar-Ch 2-OH. Ella sabe que los efectos de cambio son aditivos en RMN: si un CH 2 en general aparece alrededor de 1 ppm, pero junto a un oxígeno se desplaza a 4 ppm y junto a un aromático se desplaza a 2 ppm, entonces si está al lado de ambos se desplazará a 5 ppm. Ahí no hay nada. Ella ya no tiene alcohol.
Ella argumenta en su reporte que la reacción procedió a formar un aldehído. Ella no tiene la arrogante para llamar “exitosa” a la reacción o decir que salió “como se esperaba”. Ella solo señala la presencia de un protón aldehído y la ausencia de los protones junto al alcohol. Ella recibe una A en el reporte. Tres años después, cursa la escuela de medicina en Harvard.
A veces, las cosas son más sutiles. Veamos otra reacción. Un estudiante está realizando una reacción de esterificación. Trata el 1-octanol con ácido benzoico y una gota de ácido sulfúrico. Es una esterificación de Fischer. No se da cuenta de que las esterificaciones de Fischer son cuagmires de equilibrio que nunca lo hacen realmente en una dirección u otra.
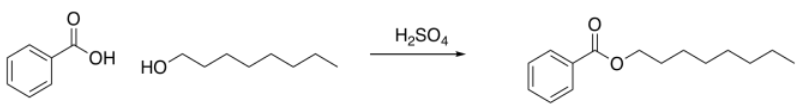
Pero cuando ve los resultados, sospecha que algo anda mal. Todos los picos están ahí —los aromáticos, el -CH 2 -O, la cadena alifática larga— pero hay algo en ese metileno, ese -CH 2 -O, que le molesta. Se muestra justo alrededor de 3.5 ppm, exactamente donde lo haría en el alcohol de partida. Cree que debería estar solo un poco a la izquierda en el éster, tal vez alrededor de 4 ppm, debido a la influencia del carbonilo que retira electrones. Cree que tal vez la reacción no procedió. Se le ocurre buscar evidencia de los protones OH, tanto en el alcohol como en el ácido benzoico, pero sabe que buscar que en el espectro 1H suele ser un recado tonto, por lo que consulta la evidencia IR en su lugar.
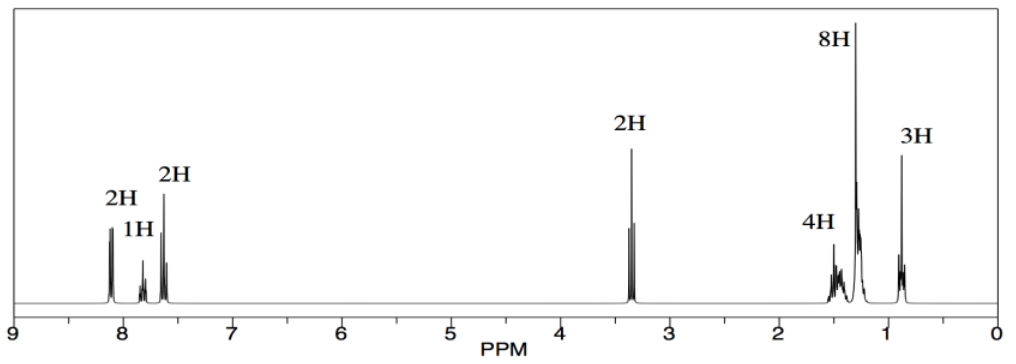
Argumenta en el informe que la reacción no procedió, sino que arrojó materiales de partida sin reaccionar. No se escurre las manos por el error humano, sino que señala que los ésteres pueden formarse y dividirse en presencia de ácido, y sugiere que podría ser preferible una ruta de cloruro de ácido. Aún logra obtener una A en el reporte.
Sugerir picos de RMN diagnósticos que podrían usarse para determinar si cada una de las siguientes reacciones ha procedido.
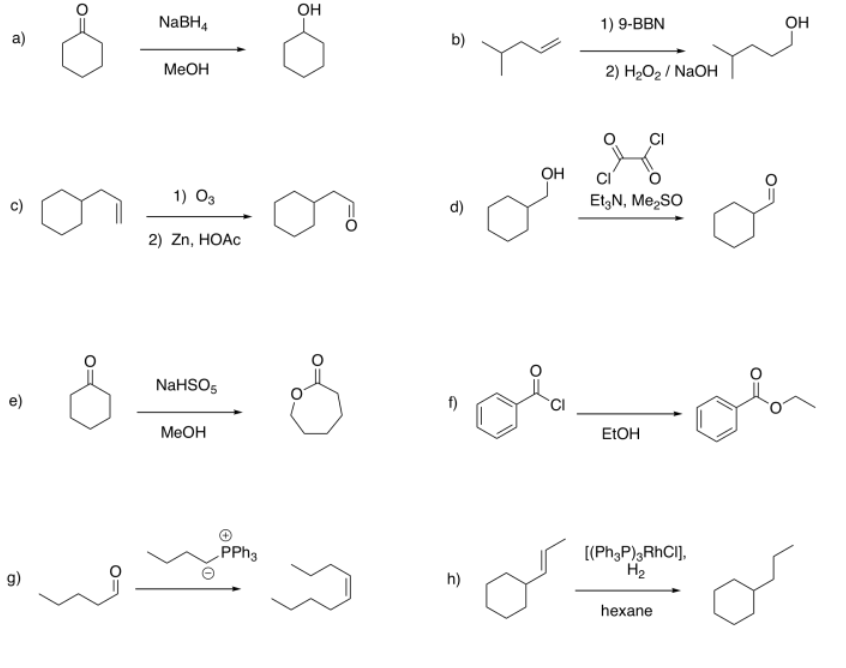
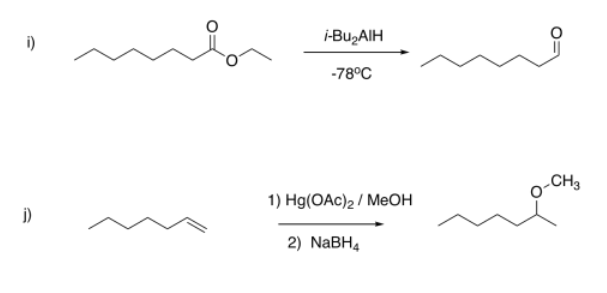
- Contestar
-
a) aparición de CH-O cerca de 3.5 ppm (multiplete, 1H)
b) aparición de CH 2-O cerca de 3.5 ppm (triplete, 2H); desaparición de =CH cerca de 5-6 ppm (multipletes, 3H total)
c) aparición de HC=O cerca de 10 ppm (triplete, 1H); desaparición de =CH cerca de 5-6 ppm (multipletes, 3H total)
d) aparición de HC=O cerca de 10 ppm (triplete, 1H); desaparición de CH 2-O cerca de 3.5 ppm (doblete, 2H)
e) aparición de CH 2 -O cerca de 3.5 ppm (triplete, 2H)
f) aparición de CH 2 -O cerca de 4 ppm (triplete, 2H)
g) aparición de =CH cerca de 5-6 ppm (multipletes, 2H total); desaparición de HC=O cerca de 10 ppm (triplete, 1H);
h) desaparición de =CH cerca de 5-6 ppm (multipletes, 2H total); aparición de patrón triplet:sextet:triplete entre 1-2 ppm
i) aparición de HC=O cerca de 10 ppm (triplete, 1H); desaparición de CH 2-O cerca de 3.5 ppm (doblete, 2H)
j) aparición de CH-O cerca de 3 ppm (singlete, 3H) y 3.5 ppm (sexteto, 1H); desaparición de =CH cerca de 5-6 ppm (multipletes, 2H total)

