7.5: Recristallización
- Page ID
- 79197
La recristalización se utiliza para purificar sólidos. Por lo general, este método funciona mejor cuando solo hay una pequeña cantidad de impurezas en el sólido.
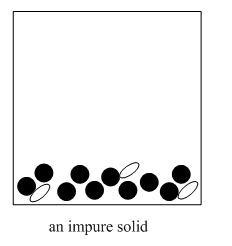
El método implica la adición de un disolvente frío al material.
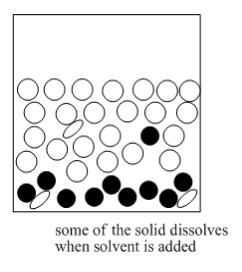
La mezcla que resulta se calienta hasta que los sólidos se disuelven.

La mezcla se vuelve a enfriar lentamente hasta obtener un sólido puro.
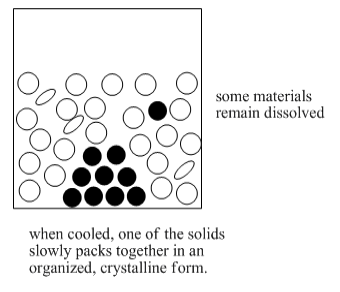
La recristalización depende de diferentes solubilidades del compuesto objetivo y otros compuestos presentes en la mezcla impura. El objetivo de este método es que un compuesto se disuelva en un disolvente mientras que el otro compuesto no se disuelva. Si un compuesto es un sólido no disuelto, se puede filtrar de la solución para separarlo de todas las demás cosas que están en solución.
La solubilidad en un disolvente es una propiedad física de un material, al igual que su punto de ebullición o punto de fusión. El hidróxido de sodio (lejía) tiene una solubilidad particular en agua fría (40 g se disolverán en 100 mL) mientras que el oleato de sodio (que se encuentra en algunos jabones) tiene una solubilidad diferente en agua fría (2 g por 100 mL). Esa diferencia se puede explotar para separar estos dos compuestos.
Supongamos que estaba tratando de entrar en el negocio de las telenovelas. Tal vez encuentres que puedes producir fácilmente una mezcla de partes iguales (peso:peso) de hidróxido de sodio y oleato de sodio. Describe cómo podrías obtener oleato de sodio puro.
- Responder
-
Es posible que una mezcla de hidróxido de sodio y oleato de sodio se pueda purificar mediante la adición de agua. Si se agregara la cantidad correcta de agua y la suspensión resultante se agitara y filtrara, gran parte del hidróxido de sodio se eliminaría porque es más soluble en agua que el oleato de sodio. El oleato de sodio es menos soluble en agua que el hidróxido de sodio, por lo que la mayor parte no se disolvería. Podría ser recolectada o “aislada” por filtración.
Observa las estructuras del hidróxido de sodio y del oleato de sodio. ¿Se puede explicar cualitativamente la diferencia entre sus solubilidades en el agua?
- Responder
-
El oleato de sodio tiene una cadena de hidrocarburo larga y no polar. Las cadenas de hidrocarburos no son muy solubles en agua. Eso es porque se meten entre las moléculas de agua y evitan que las moléculas de agua se unan entre sí.
Es posible que una mezcla de hidróxido de sodio y oleato de sodio se pueda purificar mediante la adición de agua. Si se agregara la cantidad correcta de agua y la suspensión resultante se agitara y filtrara, gran parte del hidróxido de sodio se eliminaría porque es más soluble en agua que el oleato de sodio. El oleato de sodio es menos soluble en agua que el hidróxido de sodio, por lo que la mayor parte no se disolvería. Podría ser recolectada o “aislada” por filtración.
La técnica descrita anteriormente no es la recristalización. Se le conoce como “lavado”. El oleato de sodio se lavó con agua para eliminar el hidróxido de sodio. El lavado es sencillo de hacer. En ocasiones puede aumentar la pureza de un compuesto, pero no siempre es muy efectivo.
A veces en una mezcla los dos compuestos se mezclan muy apretadamente juntos. Supongamos que hay una pila de polvo que contiene oleato de sodio e hidróxido de sodio. En lugar de tener granos individuales de hidróxido de sodio y granos individuales de oleato de sodio, los granos de polvo contienen ambos compuestos. Podría haber una pequeña pepita de hidróxido de sodio rodeada por una capa de oleato de sodio. Esta situación es muy común, sobre todo cuando los dos compuestos se han formado juntos. El lavado podría eliminar la mayor parte del hidróxido de sodio expuesto, pero no tocaría el hidróxido de sodio oculto u “ocluido” que estaba rodeado por moléculas de oleato de sodio.
¿Cómo se puede sacar todo el hidróxido de sodio de esta mezcla? En otras palabras, ¿cómo puedes asegurarte de que no haya hidróxido de sodio cubierto por oleato de sodio?
- Responder
-
La solución contiene agua, mucho hidróxido de sodio y un poco de oleato de sodio.
Sería conveniente si hubiera un interruptor que pudiera encenderse y apagarse para controlar la disolución. Cuando el interruptor está encendido, todo el oleato de sodio se disuelve, y cualquier hidróxido de sodio atrapado en su interior también puede disolverse. Cuando el interruptor está apagado, el oleato de sodio vuelve a salir de la solución para que puedas filtrarlo.
Este interruptor existe. Se encuentra en la parte frontal de tu placa caliente en el laboratorio orgánico. La solubilidad depende de la temperatura. Por ejemplo, la solubilidad del hidróxido de sodio es diferente en agua fría (40 g por 100 mL a 0 °C) que en agua caliente (330 g por 100 mL a 100 °C). En comparación, la solubilidad del oleato de sodio también depende de la temperatura (2 g por 100 mL a 20 °C, vs. 30 g por 100 mL a 30 °C).
Es posible que, en la cantidad adecuada de agua caliente, se disuelva todo el oleato de sodio y todo el hidróxido de sodio. Si la solución resultante se enfría a temperatura ambiente, el oleato de sodio ya no es soluble. El oleato de sodio vuelve a formar un sólido. Este sólido se puede filtrar lejos del agua.
Después de la filtración, enumere el contenido de la solución.
- Responder
-
No. Si se evaporara el agua, el hidróxido de sodio seguiría atascado en el oleato de sodio.
En lugar de filtrar, ¿se puede permitir que la solución se evapore para dejar atrás el oleato de sodio?
Hay una parte más de este proceso que lo convertiría en una recristalización completa. Si el oleato de sodio forma un sólido amorfo cuando vuelve a salir de la solución, tenemos precipitación. Si el oleato de sodio forma un sólido cristalino cuando vuelve a salir de la solución, tenemos recristalización. Un sólido amorfo contiene moléculas que se empaquetan juntas de manera aleatoria. Un sólido cristalino contiene moléculas que se ordenan de una manera específica.
Un sólido amorfo es como un montón de cajas que fueron arrojadas al otro lado de la habitación y apiladas en la esquina. Un sólido cristalino es como un conjunto de cajas que se apilaron ordenadamente en la esquina.
Hay muchos espacios abiertos entre las cajas en la pila “amorfa”. Las impurezas podrían quedar atrapadas en esos espacios; en ese caso estamos de vuelta donde estábamos al principio.
Realmente no hay espacios entre las cajas en la pila “cristalina”. No pueden quedar atrapadas impurezas. La cristalización protege contra la inclusión de impurezas en el material.
Hay muchas variaciones en la mayoría de las técnicas de purificación. Un problema que podría ocurrir en una recristalización es que hay una impureza muy insoluble. ¿Cómo podría separarse esta impureza muy insoluble del resto de la muestra? ¿Qué precauciones se deben tomar al hacerlo?
- Responder
-
Puede que tengas que filtrar esta impureza mientras todo lo demás aún está disuelto. Tal vez tengas que asegurarte de que todo se mantenga caliente mientras haces esto. Si las cosas se enfrían demasiado, la solubilidad disminuirá y los compuestos podrían solidificarse antes de que tú también los quieras. En ocasiones, al filtrar una solución acuosa, ayuda a poner un poco de agua caliente en el matraz filtrante y mantener todo caliente usando vapor.
Supongamos que está tratando de recristalizar una muestra de borneol. Crees que debería ser recristalizado a partir del metanol. Se agrega un par de mL de metanol frío y la muestra se disuelve todo. Evalúa el pronóstico de tu recristalización: ¿está funcionando bien? Si no, ¿qué necesitas hacer?
- Responder
-
El borneol parece demasiado soluble en el metanol. Si ya no tienes borneol, tendrás que evaporar de nuevo el metanol. Esta vez, agrega menos metanol; tal vez solo necesites un cuarto de mL o diez gotas o algo así. Para que una recristalización funcione, desea ver solubilidad parcial; desea que el compuesto se disuelva cuando está caliente pero no cuando está frío.
Supongamos que está tratando de recristalizar una muestra de borneol. Crees que debería ser recristalizado a partir del metanol. Se agrega un par de mL de metanol frío y solo aproximadamente la mitad de la muestra se disuelve. Evalúa el pronóstico de tu recristalización: ¿está funcionando bien? Si no, ¿qué necesitas hacer?
- Responder
-
Esta es una buena señal. Intenta calentar el metanol para ver si más se disuelve. Si se disuelve cuando está caliente, intenta enfriarlo y ver si el sólido vuelve a aparecer.
Supongamos que está tratando de recristalizar una muestra de borneol. Crees que debería ser recristalizado a partir del metanol. Se agrega un par de mL de metanol caliente y solo aproximadamente la mitad de la muestra se disuelve. Evalúa el pronóstico de tu recristalización: ¿está funcionando bien? Si no, ¿qué necesitas hacer?
- Responder
-
Esto sigue siendo una buena señal, pero es posible que necesites agregar más metanol para que todo se disuelva. No olvides agitarlo o removerlo, también; eso ayudará a que se disuelva.

