7.6: Partición de Solvente (Extracción Líquido-Líquido)
- Page ID
- 79191
Este método a menudo se llama “extracción”. Extracción significa extraer un compuesto de una mezcla usando un disolvente. La partición de solventes es más específica. Significa que los compuestos tienen una “opción” de dos solventes en los que pueden disolverse. Algunos compuestos se disuelven en un solo disolvente. Algunos compuestos se disuelven en el otro disolvente. De esa manera los compuestos de la mezcla se separan en dos grupos.
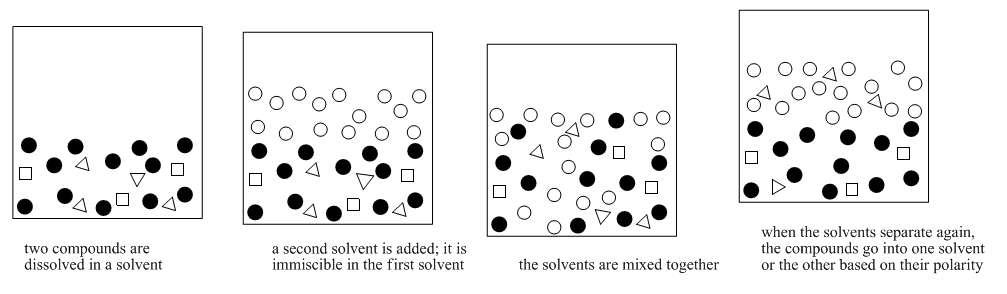
El reparto de solventes depende de la solubilidad. Sin embargo, depende de la solubilidad en dos disolventes diferentes. Depende de un equilibrio: ¿el compuesto se disuelve más en el solvente A, o solvente B?
La partición de solventes requiere dos solventes que no son miscibles entre sí. Por lo general, uno de los solventes es el agua. El otro disolvente es un líquido que no se disuelve muy bien en agua, como el éter dietílico (este es el tipo de éter más común, y a menudo se le llama simplemente “éter”). Si miras de cerca una mezcla de éter y agua, verás dos capas porque los dos compuestos no se disuelven muy bien el uno en el otro.
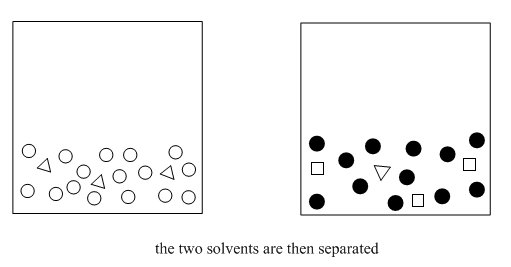
Es importante que los dos disolventes sean inmiscibles, porque entonces es fácil separarlos entre sí. El líquido superior se puede extraer con una pipeta, o la capa inferior se puede drenar a través de una llave de paso. Los compuestos que se disolvieron en el éter se han separado así de los compuestos solubles en agua. Debido a que el éter se evapora muy fácilmente, los compuestos que se disuelven en el éter también se pueden separar del éter (ver “destilación”). Como resultado, se pueden obtener compuestos más puros.
Ahora echemos otro vistazo a todo el proceso y rellenemos algunos detalles. Un reparto de solventes casi siempre implica el uso de agua y un solvente orgánico (basado en carbono e hidrógeno). En la mayoría de los casos, el disolvente orgánico no es lo suficientemente polar como para disolverse en agua. Las pocas excepciones son instructivas de mirar. Metanol, etanol y 2-propanol —es decir, CH 3 OH, CH 3 CH 2 OH y (CH 3) 2 CHOH— se disuelven muy bien en agua. El butanol no, y tampoco el éter común — CH 3 CH 2 CH 2 CH 2 OH y CH 3 CH 2 OCH 2 CH 3. Esa comparación da lugar a una regla general muy aproximada sobre la solubilidad en agua. Es decir, la relación carbono:oxígeno debe estar por debajo de 4:1 para que un compuesto orgánico se disuelva en agua. Hay excepciones, pero esta es una buena regla a tener en cuenta.
Si los dos disolventes no se disuelven el uno en el otro, entonces cuando se mezclan, formarán dos capas diferentes. Eso es exactamente lo que queremos. Si tenemos una mezcla de compuestos polares y no polares, y los mezclamos junto con agua y, digamos, éter dietílico, entonces los compuestos polares deberían migrar a la capa de agua y el compuesto no polar debería migrar a la capa de éter.
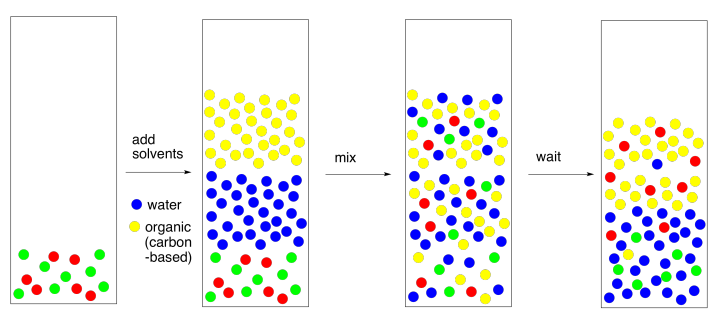
Hay un par de formas diferentes de llevar a cabo este paso. Si estamos trabajando con una cantidad muy pequeña de material (como un par de cientos de miligramos) y necesitamos solo una pequeña cantidad de solventes (tal vez un par de mililitros), podríamos hacer todo esto en un tubo de ensayo. Usaríamos una pipeta para mezclar las dos capas lavando una capa repetidamente a través de la otra.
A mayor escala, usaríamos un embudo separador. Tiene una abertura en cada extremo, con un tapón en la parte superior y una llave de paso en la parte inferior. Simplemente cerramos la llave de paso, vertimos las cosas en la parte superior, nos ponemos el tapón y la agitamos; normalmente la agitamos tres veces, y la ventilamos después de cada vez. Para ventilar, solo lo abrimos para dejar salir el aire, porque la mezcla se pone un poco gaseosa. Eso es porque cuando mezclamos dos líquidos juntos siempre hay cambios de calor y volumen como resultado; la mezcla puede calentarse un poco, o puede expandirse un poco, por lo que necesita más espacio. La mayoría de la gente lo pone boca abajo y abre la llave de paso para desahogarla. Por lo general puedes escuchar un pequeño silbato cuando haces esto.
Después de ventilar por tercera vez, esperamos a que las capas se separen.
En este punto, podemos separar las dos capas. Despegamos el tapón, abrimos un poco la llave de paso y drenamos cuidadosamente cada capa en su propio matraz. Por lo general los trasladamos a dos matraces Erlenmeyer (los en forma de cono). Siempre es una buena idea etiquetar los matraces. Alternativamente, si estamos en una escala de tubo de ensayo, podemos usar una pipeta para transferir la capa orgánica a un tubo de ensayo seco.
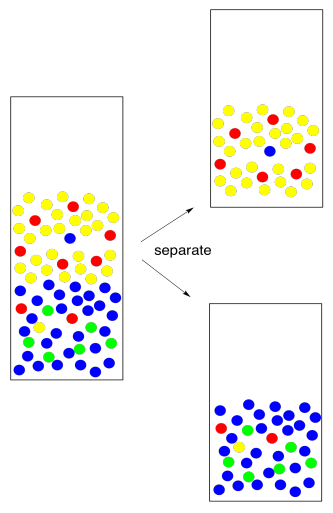
¿Cómo sabemos qué capa es cuál? El hecho de que se formen dos capas depende de diferencias en las atracciones intermoleculares, pero qué capa está en el fondo depende de la densidad. Eso es algo que deberías buscar en una mesa. Sin embargo, aquí también hay algunas reglas generales ásperas. La mayoría de los solventes orgánicos son menos densos que el agua, por lo que flotan en la parte superior. Algunos solventes orgánicos son más densos que el agua, por lo que se hunden hasta el fondo. Por lo general, estos disolventes contienen átomos pesados como halógenos, como el cloro.
Si estás mirando de cerca las fotos, notarás que aquí hay algo mal con ellas. Se suponía que las moléculas rojas iban a entrar en el disolvente amarillo y las moléculas verdes se suponía que iban al disolvente azul. En realidad, nunca funciona a la perfección. Siempre se queda atrás a alguien. Esto no se debe al “error humano”, el pilar de los informes de laboratorio de secundaria. Es por la naturaleza. Cuando esperamos que un compuesto se disuelva en un disolvente y no en otro, rara vez somos recompensados con la perfección. En cambio, es más probable que el compuesto se disuelva en una capa; hay una constante de equilibrio que gobierna cuánto del compuesto va en una capa y cuánto va en la otra. Tal vez el 95% va en la capa correcta, y la constante de equilibrio fuerza al otro 5% a la equivocada.
Así que volvemos y lo intentamos de nuevo. Tomamos la capa de agua y extraemos con disolvente fresco. Si somos capaces de extraer el 95% del 5% restante, eso deja solo 0.25% atrás esta vez. Eso es bastante bueno.
Por cierto, ese término “extraer” suele emplearse para indicar que estamos quitando lo que queremos de algo que no queríamos. Acabamos de extraer el compuesto restante del agua. Ahora tenemos que mantenerlo a salvo. Lo combinamos con la primera fracción que extraemos para que todo el compuesto que queremos esté en un solo lugar.
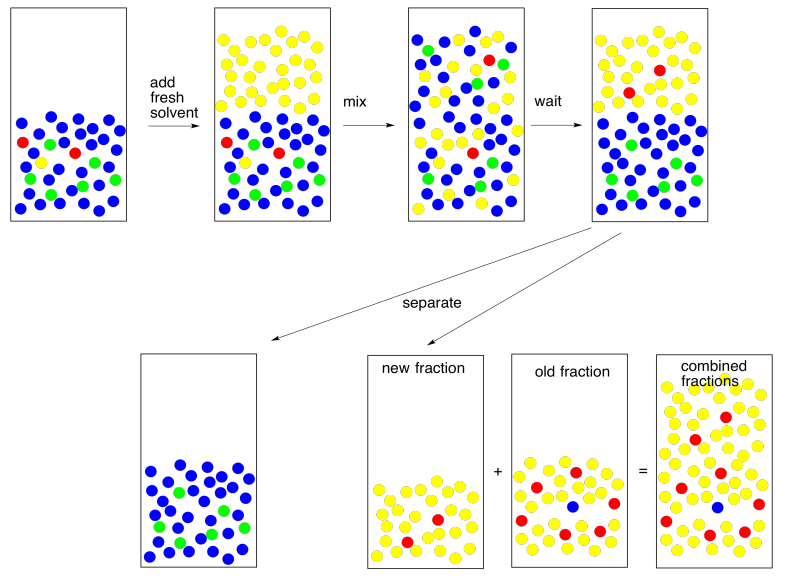
Ahora por otro problema práctico. Por lo general cuando hacemos una extracción, nos gusta ver una buena separación entre dos capas claras. A veces eso no sucede. Las cosas están nubladas, están desordenadas, las últimas no se están separando bien. Esto no siempre se trata del error humano. Esto podría ser más naturaleza. A lo mejor las dos capas no se están separando porque no son lo suficientemente diferentes entre sí.
Una forma de hacer que las capas sean más diferentes es agregar salmuera (agua salada). Esa salmuera toma una capa de agua polar y la hace aún más polar. Ahora hay una elección más clara sobre la separación de fases.
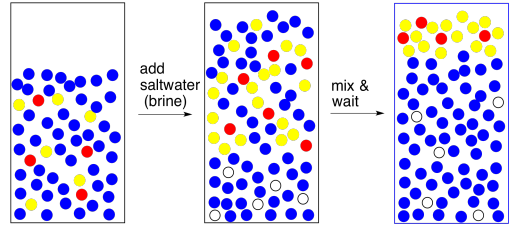
Por cierto, si te preocupa que haya impureza polar en la capa orgánica, podemos manejarla de la misma manera. Agregue salmuera a la capa orgánica para sacar esa impureza polar. Obtendrás dos capas y necesitarás separarlas nuevamente pero la capa orgánica puede ser más pura como resultado. Este paso se llama lavado; lavar es como extracción, pero estamos quitando algo que no queremos en lugar de mantener algo que sí queremos.
Nos estamos acercando al final de un experimento exitoso pero todavía hay otro detalle que tenemos que tratar. La mayoría de los solventes orgánicos pueden disolver un poco de agua. Por lo general, es una cantidad que es lo suficientemente significativa como para contaminar el compuesto que estamos tratando de aislar. Tenemos que sacar esa agua.
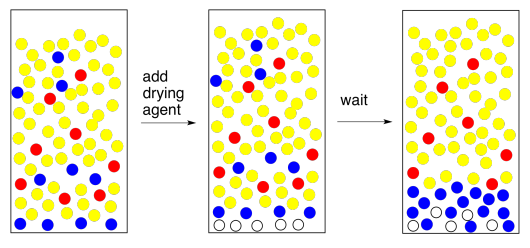
Para eliminar el agua, añadimos un agente secante. Un agente secante es solo una sal que contiene un ion metálico ácido de Lewis; el sulfato de sodio anhidro, el sulfato de magnesio o el cloruro de calcio son los ejemplos más comunes. Estas sales se han secado para eliminar cualquier rastro de agua, pero tienen una afinidad natural por ella, y la esponjarán de solución para nosotros.
El método de uso de un agente de secado es simple. Necesitas poner una capa muy delgada de la misma en el fondo del matraz que contiene tus extractos combinados. Revuelva y espere cinco minutos. Eso son 5 minutos. Espera hasta que la mano grande pase al siguiente número.
Al final de ese tiempo, gira el matraz y mira el agente secante. Lo que debes saber del agente secante es que cuando se moja los granos se pegan en pequeños grumos. Algunos de ellos deberían estar pegados ahora, porque tu capa orgánica entró en contacto con el agua recientemente y ciertamente recogió un poco de humedad. La pregunta es, ¿algunos de los granos están libres? ¿No se apegaron a nadie más? Cuando haces girar la petaca, ¿vuelan libremente como una globo de nieve? Si es así, deben estar secos. Si están secos, también lo es tu solución. ¡Buen trabajo!
¿Y si todos tus granos de agente secante están pegados en pequeños grumos en el fondo del matraz? Todos se mojaron. A lo mejor toda el agua se ha ido, pero tal vez había demasiada agua para el agente secante que agregaste. En ese caso, agregue otra capa de agente secante. Espera cinco minutos. Se entiende la idea.
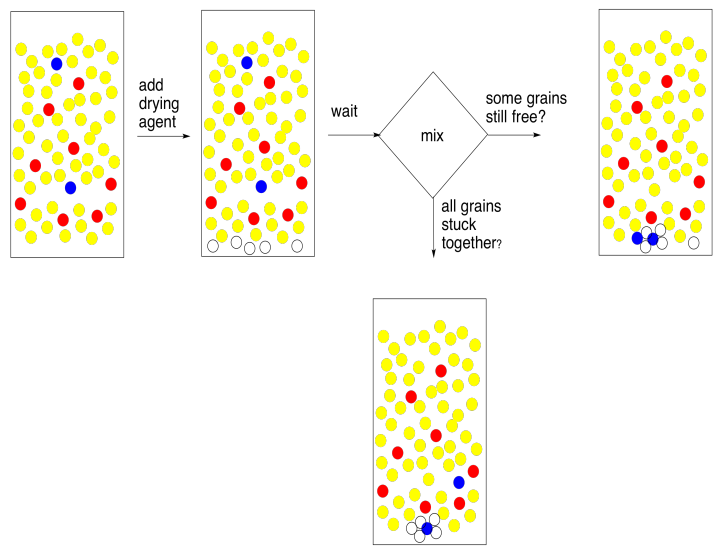
Si eres un genio de laboratorio, encontrarás un atajo para este negocio de secado. Olvídate de la pequeña capa. Solo agrega lotes. Eso va a deshacerse de toda el agua rápidamente. Y tienes razón, lo hará. Probablemente también se deshará de cualquier otra cosa que quieras. El problema es que el agente secante es un ácido de Lewis. Se adhiere a pares solitarios en los átomos de oxígeno en las moléculas de agua. A menos que el compuesto que intentas extraer sea un hidrocarburo, lo más probable es que también contenga átomos de oxígeno; la mayoría de los compuestos en la naturaleza sí. Eso significa que se adhiere al agente secante. Demasiado agente de secado, y has perdido todo el compuesto que necesitabas. En la ciencia, esto podría describirse como una situación no ideal. En términos sencillos, es un completo y absoluto fracaso.
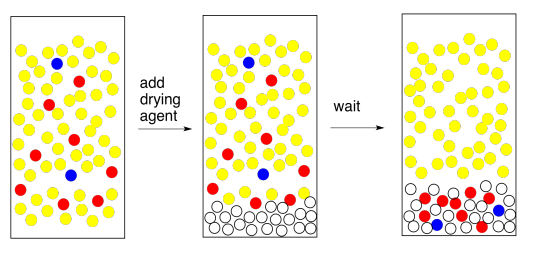
Hay otro problema común que puede aparecer al agregar el agente secante. Si la capa orgánica está realmente, muy húmeda, y le agregas un agente secante, que es una sal, haces agua salada. Ahora tienes una capa orgánica mezclada con salmuera. La capa de salmuera se separa de la capa orgánica. Este es un problema fácil de resolver. Simplemente separe las dos capas y vuelva a secar la capa orgánica. Pero espera — ¿está buscando el TA? Tal vez solo puedas agregar un montón de agente secante y absorber toda esa agua. Si crees que eso suena como una buena idea, regresa y lee el párrafo anterior.
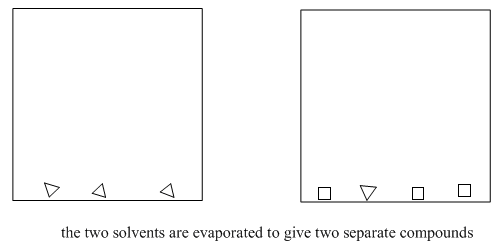
Si todo va bien, y tienes una capa orgánica agradable y transparente, simplemente puedes filtrar el agente secante y evaporar el solvente. Terminado.
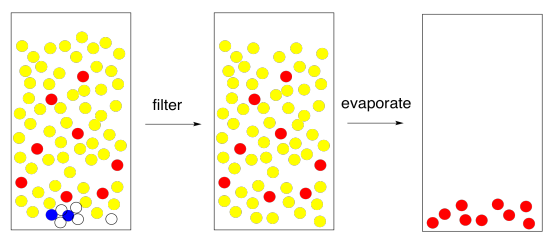
Figura\(\PageIndex{11}\): El resultado final de la partición del disolvente.
Enumere razones por las que el éter y el agua DEBEN y NO DEBEN disolverse En este caso, ¿qué factores prevalecen para determinar si estos dos compuestos son miscibles?
- Responder
-
Tanto el agua como el éter (un apodo común para el éter dietílico) contienen átomos de oxígeno electronegativos. Debido a que ambos oxígenos están unidos a átomos de hidrógeno o carbono menos electronegativos, cada molécula tendrá un dipolo. Podemos esperar interacciones dipolo-dipolo y miscibilidad.
Ambos átomos de oxígeno tienen pares solitarios. Cualquiera de los dos podría actuar como aceptor de enlaces de hidrógeno. Debido a que el éter también contiene un enlace O-H muy polar (recuerde, los enlaces de hidrógeno involucran F, O, N), podemos esperar interacciones de enlaces de hidrógeno y miscibilidad.
Sin embargo, un enlace C-O en éter es menos polar que un enlace H-O en agua. Para que los dos líquidos sean miscibles, las interacciones dipolo-dipolo más fuertes entre las moléculas de agua tendrían que ser abandonadas y comercializadas por interacciones dipolo-dipolo más débiles entre las moléculas de agua y éter. Es posible que los dos líquidos no se mezclen.
El éter tiene un átomo de oxígeno con un par solitario, pero no tiene un enlace O-H muy polar. La posibilidad de enlaces de hidrógeno entre el agua y el éter es menor que entre las moléculas de agua solas. Es posible que los dos líquidos no se mezclen.
El éter tiene dos cadenas hidrocarbonadas hidrofóbicas, aunque son bastante cortas. Al mezclarse, estas cadenas deben acomodarse entre moléculas de agua vecinas, que de esta manera se evita que se unan hidrógeno entre sí. Es posible que los dos líquidos no se mezclen.
El éter y el agua tienen diferentes densidades. El agua tiene una densidad de 1.000 g/mL y una gravedad específica de 1.000. La gravedad específica es la relación entre la densidad de un compuesto y la del agua. No es de sorprender que el agua tenga una gravedad específica de 1.000. Si el éter tiene una gravedad específica de 0.977, ¿qué compuesto es más pesado? ¿Qué compuesto flotará hasta la parte superior y cuál se hundirá hasta el fondo?
- Responder
-
El éter más ligero estaría en la parte superior. El agua más pesada se hundiría hasta el fondo.
- El metanol tiene una gravedad específica de 0.980. Cuando se mezclan metanol y agua, ¿qué compuesto debe flotar hasta la cima?
- Sin embargo, solo se observa una capa de líquido, no dos. ¿Por qué?
- Responder
- Responder a
-
Dadas dos capas separadas, el metanol más ligero estaría en la parte superior. El agua más pesada se hundiría hasta el fondo.
- Respuesta b
-
El metanol y el agua son miscibles. Ambos son completamente capaces de formar enlaces de hidrógeno; cada uno de ellos es donador y aceptor de enlaces de hidrógeno. Aunque el metanol tiene un componente hidrocarbonado no polar, los grupos metilo no son lo suficientemente grandes como para interrumpir significativamente los enlaces de hidrógeno entre las moléculas de agua vecinas.
a) Dibuja tres compuestos que creas que se disolverán mejor en agua que en éter. Explica tu respuesta.
b) Dibuja tres compuestos que creas que se disolverán mejor en éter que en agua. Explica tu respuesta.
- Responder
- Responder a
-
Tal vez los compuestos son sales, que contienen un anión y un catión. Los aniones y cationes podrían ser simples inorgánicos como Li + y F -, pero bien el anión o el catión también podrían ser orgánicos (conteniendo porciones de hidrocarburos). Si los compuestos son orgánicos y no iónicos, o bien las moléculas serían completamente capaces de formar enlaces de hidrógeno (que contienen enlaces O-H o N-H), o bien contendrían enlaces altamente polares como C=O. Además, los compuestos no deberían contener una proporción demasiado grande de hidrocarburo en comparación con la parte polar; para neutros compuestos, eso significa una relación carbono:oxígeno por debajo de aproximadamente 4:1, aunque la relación puede ser significativamente mayor para los compuestos iónicos.
- Respuesta b
-
Los compuestos deben ser neutros, no iónicos. Aunque pueden contener enlaces polares, el compuesto debe ser mayoritariamente no polar; una regla aproximada es que la relación carbono:oxígeno debe ser mayor a 4:1.
Indicar si los siguientes disolventes orgánicos serían de la capa superior o inferior cuando se mezclan con agua (d = 1.0 g/mL).
a) diclorometano, d = 1.33 g/mL b) hexano, d = 0.66 g/mL c) tolueno, d = 0.87 g/mL
d) terc-butil metil éter, d = 0.7404 g/mL e) clorobenceno, d = 1.11 g/mL
f) acetato de etilo, d = 0.902 g/mL g) cloroformo, d = 1.489 g/mL h) cicopentano, d = 0.75
- Responder
- Responder a
-
fondo
- Respuesta b
-
top
- Respuesta c
-
top
- Respuesta d
-
top
- Respuesta e
-
fondo
- Respuesta f
-
top
- Respuesta g
-
fondo
- Respuesta h
-
top
En general, la mayoría de los compuestos orgánicos neutros se disolverán mejor en éter que en agua. La mayoría de los compuestos iónicos se disuelven mejor en agua que en éter. El ácido benzoico se disuelve mejor en éter que en agua, pero el benzoato de sodio se disuelve mejor en agua que en éter. ¿Por qué crees que esto es cierto?
- Responder
-
Los compuestos iónicos pueden formar fuertes interacciones ión-dipolo con las moléculas de agua. Esa interacción mejora su solubilidad en agua.
Describa una serie de pasos que podría tomar en el laboratorio para separar el benzoato de sodio del ácido benzoico mediante la partición con disolvente. Al final, debes tener una muestra de ácido benzoico puro en un vial etiquetado y una muestra de benzoato de sodio en otro.
- Responder
-
Se debe agregar agua y éter a la mezcla y la mezcla debe agitarse hasta que se disuelva. Las capas deben estar separadas. El agua debe extraerse con éter adicional y las capas etéreas combinadas deben lavarse con salmuera. Las capas de éter deben secarse con sulfato de sodio, filtrarse y evaporarse al vacío.
En la pregunta anterior sobre la separación del ácido benzoico del benzoato de sodio, ¿por qué el lavado del sólido es posiblemente un método inadecuado?
- Responder
-
Las moléculas de agua tendrían que entrar en contacto con el benzoato de sodio para disolverlo. Si algo de benzoato de sodio está completamente rodeado por ácido benzoico, permanecería sin disolver.
Hay excepciones a la regla de que la mayoría de los compuestos orgánicos neutros se disuelven mejor en éter que en agua. El ácido acético se disuelve bien en agua. ¿Por qué?
- Responder
-
El ácido acético, CH 3 CO 2 H, contiene un enlace C=O polar, un grupo O-H con enlaces de hidrógeno y una relación carbono:oxígeno de 1:1. Todos estos factores lo hacen relativamente polar.
Algunos compuestos orgánicos se disolverán en éter en algunas circunstancias y en agua en otras. Por ejemplo, supongamos que el THF se mezcla con volúmenes iguales de éter y agua, y la capa de agua se hace más grande.
¿En qué capa está el THF? Si se agrega sal, la capa de agua se hace más pequeña y la capa de éter se hace más grande. ¿En qué capa está ahora el THF? ¿Por qué varía de esta manera la solubilidad del THF?
- Responder
- Responder a
-
El THF está en la capa de agua.
- Respuesta b
-
El THF está en la capa de éter.
- Respuesta c
-
La salmuera hace que la capa de agua sea aún más polar. El THF ya está al borde de ser soluble en agua, porque tiene una relación carbono:oxígeno de 4:1. La polaridad añadida del agua la empuja más allá del punto de inflexión.
Es útil recordar que la partición de solventes siempre implica un equilibrio entre dos solventes; los compuestos a menudo no se disuelven completamente en un solvente u otro. Supongamos que el ácido perfluorobutanoico, miembro de una clase de compuestos utilizados para alfombras resistentes a las manchas, es absorbido en una mezcla de partes iguales de agua y éter. Imagínese que la mitad del ácido perfluorobutanoico (C 3 F 9 CO 2 H) se disuelve en el agua y la mitad en el éter (esto es solo un número confeccionado por el bien del argumento). ¿Qué tendrías que hacer para sacar todo el ácido perfluorobutanoico del agua?
- Responder
-
Después de una extracción, la mitad del ácido perfluorobutanoico permanecería en el agua. Una segunda extracción eliminaría la mitad del resto, dejando solo una cuarta parte de la cantidad original todavía en el agua. Una tercera extracción dejaría 12% del original en el agua; una cuarta extracción dejaría 6%; una quinta extracción dejaría 3%; una sexta extracción dejaría 1.5% una séptima extracción dejaría menos de 1%.
La idea aquí es que las extracciones múltiples suelen ser necesarias. Sin embargo, sería bastante inusual elegir la partición de solventes como método de purificación si un compuesto es así de soluble en agua.
Supongamos que tiene una mezcla de ácido benzoico y benzoato de sodio. Se agregan 2 mL de éter y 2 mL de agua a la mezcla y todo se disuelve. Olvidas qué hacer a continuación, así que vas a leer el Manual de supervivencia de laboratorio de química orgánica de Zubrick por un tiempo. Cuando regresas, notas que la capa superior de líquido es solo la mitad de grande que la capa inferior. También hay flotadores blancos entre las dos capas.
- ¿Qué ha pasado?
- ¿Cuáles son los flotadores blancos?
- ¿Qué debes hacer a continuación?
- Responder
- Responder a
-
Parece que la mitad del éter se ha evaporado.
- Respuesta b
-
Los flotadores blancos son probablemente el ácido bezoico que solía disolverse en el éter. Ya no tienes suficiente éter para mantenerlo disuelto.
- Respuesta c
-
Deberías agregar más éter antes de que este experimento empeore.

