7.7: Extracción ácido-base
- Page ID
- 79169
Una extracción ácido-base es un tipo de extracción líquido-líquido. Generalmente implica diferentes niveles de solubilidad en agua y un disolvente orgánico. El disolvente orgánico puede ser cualquier líquido a base de carbono que no se disuelva muy bien en agua; los comunes son éter, acetato de etilo o diclorometano.
La extracción ácido-base se usa típicamente para separar compuestos orgánicos entre sí en función de sus propiedades ácido-base. El método se basa en el supuesto de que la mayoría de los compuestos orgánicos son más solubles en solventes orgánicos que en agua. Sin embargo, si el compuesto orgánico se vuelve iónico, se vuelve más soluble en agua que en el disolvente orgánico.
Estos compuestos pueden convertirse fácilmente en iones ya sea agregando un protón (un ion H +), convirtiendo el compuesto en un ion positivo, o eliminando un protón, convirtiendo el compuesto en un ion negativo.
Supongamos que tiene una mezcla de dos compuestos. Hay uno neutro que no reacciona con ningún ácido o base. También hay uno básico, que reacciona con los ácidos al recoger un protón.
En este caso, se podría agregar un protón vía reacción con un ácido mineral fuerte (representado por HX en el dibujo). Supongamos que una solución acuosa de ácido mineral, como HCl, se agitaron vigorosamente con una solución etérea de una base orgánica y un neutro orgánico. El protón sería transferido a un compuesto básico, pero no a uno neutro. El compuesto básico se volvería iónico, y más soluble en agua.
Obsérvese que en el dibujo, el éter se representa en amarillo, mientras que el agua se muestra en azul. El agua está en el fondo en este caso porque el agua tiene una densidad mayor que el éter, por lo que se hundirá hasta el fondo (junto con cualquier cosa disuelta en ella). Algunos solventes orgánicos sí tienen una densidad mayor que el agua, por lo que la solución acuosa flotaría hasta la parte superior en esos casos.
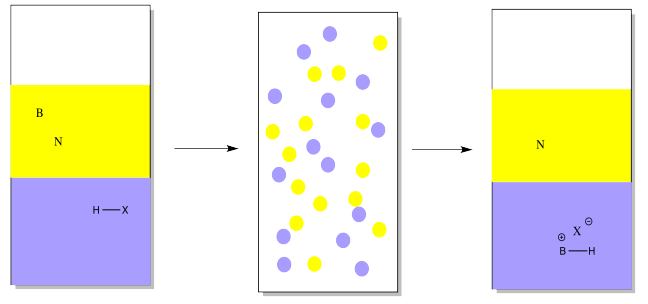
En consecuencia, la solución etérea contendría sólo el compuesto neutro, no el básico. El compuesto neutro podría aislarse simplemente evaporando el éter.
Sin embargo, como cuestión práctica, el éter tendría que secarse primero. ¿Cuál es la diferencia entre evaporar y secar? ¿Alguna vez has estado en la playa o te has dado una ducha? Secado se refiere a la eliminación de agua. Este paso es necesario porque el éter tiende a disolver mucha agua en él. Una vez evaporado el éter, habría algún compuesto neutro, pero se mezclaría con agua.
La eliminación del agua se realiza más fácilmente agregando un agente de secado, como sulfato de magnesio o sulfato de sodio. El agua se adhiere a estos sólidos, que luego se filtran.
Ahora el compuesto neutro está solo en el éter. La evaporación del éter da el compuesto puro y neutro.
Sin embargo, el compuesto básico está atascado en el agua, y ya no es el mismo compuesto. Es un ion, ahora. Si queremos el compuesto original en una forma pura, necesitamos quitarle ese protón. Eso se puede hacer añadiendo una base mineral, como el hidróxido de sodio.
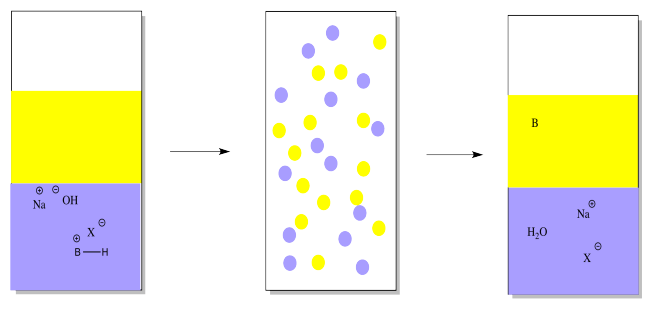
La base mineral eliminará el protón, dejando el compuesto orgánico original. El compuesto orgánico está sin carga y ya no es tan soluble en agua. Volverá a entrar en la capa de éter.
Por el contrario, podríamos tener una mezcla de un compuesto orgánico ácido y un compuesto neutro para comenzar. En ese caso, agregaríamos una base mineral en primer lugar, para alejar un protón del compuesto ácido. La base mineral podría ser algo así como hidróxido de sodio o bicarbonato de sodio. En el dibujo, sólo se representa como Na + B -.
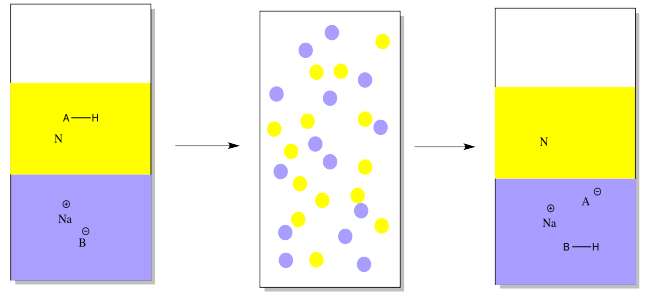
El compuesto ácido se vuelve iónico y soluble en agua cuando pierde un protón. Eso deja solo al compuesto neutro.
Para recuperar ese compuesto ácido, agregaríamos un ácido mineral como el ácido clorhídrico para restaurar el protón faltante.
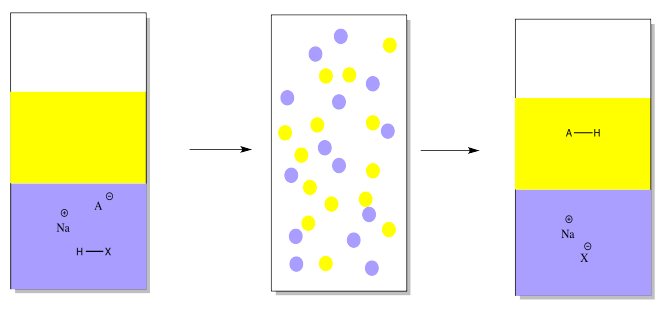
Al igual que en el otro caso, la capa de éter que contiene un compuesto puro podría separarse, secarse y evaporarse para proporcionar el compuesto puro.
Pero, ¿cómo sabemos si algo es un ácido orgánico o una base? Las características estructurales comunes de los ácidos y bases orgánicos se muestran a continuación.
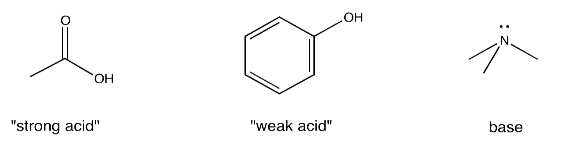
Obsérvese que los términos, “ácido fuerte” y “ácido débil”, son relativos. En ocasiones, el término “ácido fuerte”, designa un compuesto que se ioniza completamente en solución, de manera que automáticamente cede un ion H + y forma un compuesto iónico. El ácido clorhídrico, HCl, en agua es un buen ejemplo. Eso no es cierto aquí; ninguno de estos ácidos se ioniza muy fácilmente por sí solos, y aparecen en solución tal como lo hacen anteriormente, con apenas una pequeña minoría de moléculas formando H + y un anión. En este caso, el término apenas compara un grupo de compuestos ácidos (llamados ácidos carboxílicos) con otro grupo de compuestos ácidos (llamados fenoles). Los ácidos carboxílicos tienen más probabilidades de renunciar a protones que los fenoles, por lo que los ácidos carboxílicos se denominan en este contexto como “fuertes” y los fenoles como “débiles”.
El grupo ácido carboxílico contiene un C=O (un carbonilo) con un grupo OH adicional unido al carbono. A continuación se muestran ejemplos.

Cuando los ácidos carboxílicos se tratan con bases minerales como el hidróxido de sodio, el grupo OH carboxílico cede un protón al hidróxido, formando una molécula de agua. Los electrones en el enlace O-H permanecen atrás, poniendo una carga negativa sobre el anión carboxilato resultante. La sal que forma es mucho más soluble en agua.
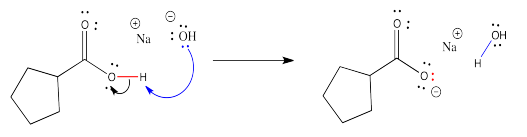
Esta reacción es completamente reversible. Un ácido mineral, tal como HCl, podría proporcionar protones al anión carboxilato. El ion carboxilato usaría un par de electrones para unirse a un protón, y el compuesto volvería a ser un ácido carboxílico neutro (como en el no cargado) nuevamente.
Los fenoles también contienen un grupo OH, pero en lugar de estar unidos a un grupo C=O, el OH está unido a un benceno (un anillo de seis carbonos con tres dobles enlaces). A continuación se muestran ejemplos.
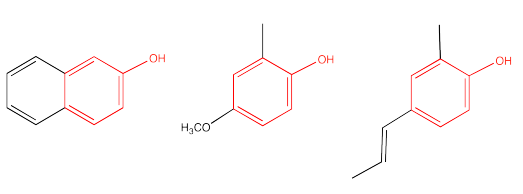
Los fenoles reaccionan con bases de la misma manera que los ácidos carboxílicos. Simplemente no lo hacen tan fácilmente.
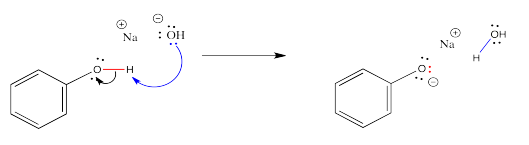
Debido a que los fenoles no reaccionan tan fácilmente como los ácidos carboxílicos, hay situaciones en las que un ácido carboxílico reaccionaría con una base pero un fenol no lo haría. Por ejemplo, los ácidos carboxílicos reaccionan incluso con bases débiles como el bicarbonato de sodio (bicarbonato de sodio).
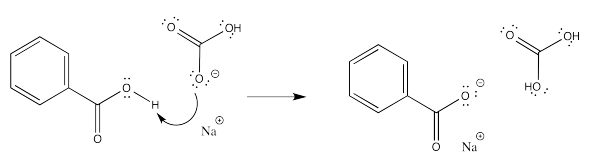
Los fenoles, por otro lado, no hacen tal cosa.
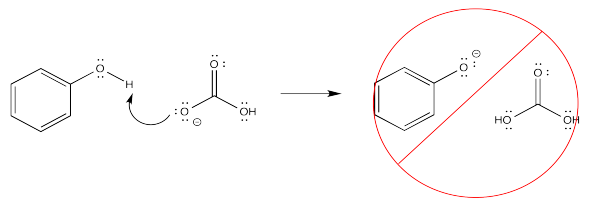
Si el OH está unido a un carbono en un compuesto orgánico, pero no está unido ni a un anillo C=O ni a un anillo de benceno, no es lo suficientemente ácido como para ser eliminado en un grado apreciable. Eso es cierto aunque haya un carbonilo o un benceno en algún otro lugar de la molécula. Como resultado, la extracción ácido-base no es posible en estos casos.
Las bases orgánicas son compuestos que contienen átomos de nitrógeno. Para ser básico, el átomo de nitrógeno debe tener un par solitario. El par solitario es necesario para hacer un vínculo con el protón.
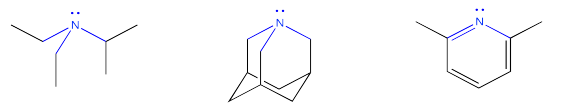
Una vez que el par solitario ha donado al protón para formar un enlace con él, el compuesto de nitrógeno se carga positivamente. Entonces se vuelve más soluble en agua.
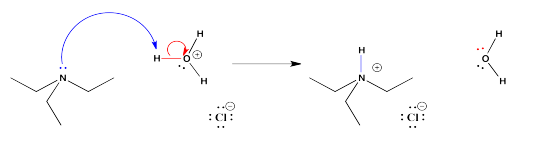
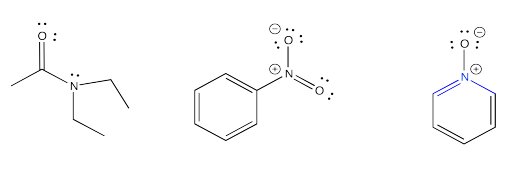
Si el nitrógeno no tiene un par solitario, es incapaz de enlazarse a un protón. Sin embargo, algunos compuestos que sí tienen un par solitario en el nitrógeno aún no pueden donar su par solitario para hacer un enlace al hidrógeno. La mayoría de las veces eso se debe a un átomo de oxígeno muy electronegativo cercano. La atracción del oxígeno para la pareja solitaria hace que la pareja solitaria sea menos capaz de donar a otro átomo. También puede haber otras razones, especialmente las relacionadas con la deslocalización de electrones o aromaticidad que hacen que el par solitario no esté disponible para la unión.
Si las siguientes mezclas fueran absorbidas en éter e hidróxido de sodio 1 M, indicar qué compuesto se encontraría en cada disolvente.
- Contestar
-

Si las siguientes mezclas fueran absorbidas en éter y ácido clorhídrico 1 M, indicar qué compuesto se encontraría en cada disolvente.

- Contestar
-

Si las siguientes mezclas fueran absorbidas en éter y bicarbonato de sodio 1 M, indicar qué compuesto se encontraría en cada disolvente.
- Contestar
-

Indicar qué compuestos se encontrarían en cada disolvente en los siguientes casos.
- Se toma una mezcla de ciclohexanona y ácido octanoico en éter/hidróxido de sodio 1 M.
- Se toma una mezcla de bencilamina y éter dibencílico en éter/ácido clorhídrico 1 M.
- Se toma una mezcla de heptanoato de propilo y fenol en éter/hidróxido de sodio 1 M.
- Se toma una mezcla de 2-octanol y ácido 3-bromobenzoico en éter/hidróxido de sodio 1 M.
- Se toma una mezcla de trioctilamina y heptanal en éter/ácido clorhídrico 1 M.
- Se recoge una mezcla de ácido 4-metoxifenol y 3-nitrobenzoico en éter/bicarbonato de sodio 1 M.
- Contestar
- Contestar a
-
éter: ciclohexanona; agua: octanoato de sodio
- Respuesta b
-
éter: éter dibencílico; agua: cloruro de bencilamonio
- Respuesta c
-
éter: heptanoato de propilo; agua: fenolato de sodio
- Respuesta d
-
éter: 2-octanol; agua: bromobenzoato de sodio
- Respuesta e
-
éter: heptanal; agua: cloruro de trioctilamonio
- Respuesta f
-
éter: 4-metoxifenol; agua: 3-nitrobenzoato de sodio
Indicar qué compuestos se encontrarían en cada capa (superior o inferior) en los siguientes casos.
- Se toma una mezcla de decanal y ácido heptanoico en acetato de etilo/hidróxido de sodio 1 M.
- Se toma una mezcla de alcohol bencílico y 4-bromofenol en diclorometano/hidróxido de sodio 1 M.
- Una mezcla de 3-heptanona y N, N-dimetilbencilamina se recoge en éter metl terc - butílico/ácido clorhídrico 1 M.
- Una mezcla de ácido benzoico y ácido 2-metilhexanoico se recoge en cloroformo/ácido clorhídrico 1 M.
- Se toma una mezcla de ácido 2-etilheptanoico y 4-clorofenol en éter/hidróxido de sodio 1 M.
- Una mezcla de benzonitrilo y N, N-dimetiloctanamida se recoge en diclorometano/ácido clorhídrico 1 M
- Contestar
- Contestar a
-
acetato de etilo (arriba): decanal; agua (abajo): benzoato de sodio
- Respuesta b
-
diclorometano (parte inferior): alcohol bencílico; agua (arriba): 4-bromofenolato de sodio
- Respuesta c
-
éter (arriba): 3-heptanona; agua (abajo): cloruro de N, N-dimetilbencilamonio
- Respuesta d
-
cloroformo (fondo): ácido benzoico, ácido 2-metilhexanoico; agua (arriba): nada
- Respuesta e
-
éter (arriba): nada; agua (abajo): 2-etilheptanoato de sodio, 4-clorofenolato de sodio
- Respuesta f
-
diclorometano (parte inferior): benzonitrilo, N, N-dimetiloctanamida; agua (arriba): nada

