7.8: Cromatografía líquida
- Page ID
- 79196
La partición de solventes implica un equilibrio entre la disolución en un líquido y la disolución en otro. Nuestra primera mirada a la cromatografía implica un equilibrio similar entre disolverse en un líquido y adherirse a un sólido.
El pegado a un sólido, o adhesión, ocurre a través de atracciones intermoleculares entre el sólido y el compuesto que se adhiere a él.
Una mancha de hierba en la rodilla de tus jeans entra en la lavadora y entra en este tipo de equilibrio. La constante de equilibrio que involucra estos materiales (compuestos de manchas de pasto como la clorofila, la celulosa en el algodón de los jeans y el agua jabonosa) determina si tus jeans quedarán limpios o permanecerán manchados.
La gran ventaja de la cromatografía es la flexibilidad. No importa si el compuesto que deseas purificar es sólido o líquido. Incluso los gases pueden ser purificados por cromatografía, como verá en una sección posterior. Siempre y cuando el compuesto sea capaz de disolverse en un líquido y adherirse a un sólido, se puede utilizar la cromatografía para purificarlo.
Existe un tipo de cromatografía muy similar llamada cromatografía en papel. En una demostración típica de cromatografía en papel, una muestra de tinta se mancha sobre un trozo de papel de filtro. El papel de filtro está hecho de celulosa, como jeans. El papel se sumerge en un vaso de precipitados de agua. El agua comienza a mecha a lo largo del papel. A medida que el agua se filtra más allá de la mancha de tinta, la mancha comienza a moverse. Si la tinta está hecha de una mezcla de pigmentos, se separa en diferentes compuestos coloreados.
Observa las estructuras del papel (celulosa) y el agua. ¿Por qué el agua es capaz de extenderse a través de un trozo de papel que se sumerge en él?
- Contestar
-
La celulosa contiene muchos grupos OH y puede formar enlaces de hidrógeno con las moléculas de agua.
¿Por qué la tinta se separa en diferentes componentes a medida que el agua filtra el papel?
- Contestar
-
Diferentes pigmentos tienen diferentes propiedades físicas. Algunos de ellos serán más solubles en agua que otros. Algunos de ellos se adherirán al papel con más fuerza que otros.
En la cromatografía líquida, hay un sólido que permanece puesto, llamado fase estacionaria, y un líquido que se mueve sobre el sólido, llamado fase móvil o eluyente.
El sólido suele ser sílice (SiO2) o alúmina (Al2O3). Ambos son compuestos polares capaces de formar enlaces de hidrógeno. Por lo general, tienen grupos hidroxilo en sus superficies.
El eluyente suele ser un disolvente orgánico o mezcla de disolventes. El eluyente puede ser más polar o menos polar. No debe ser tan polar que disuelva la alúmina o sílice. Si lo hiciera, la fase estacionaria no se quedaría quieta, sino que se movería con la fase líquida. Por esa razón, normalmente no se utilizan metanol y agua como eluyente.
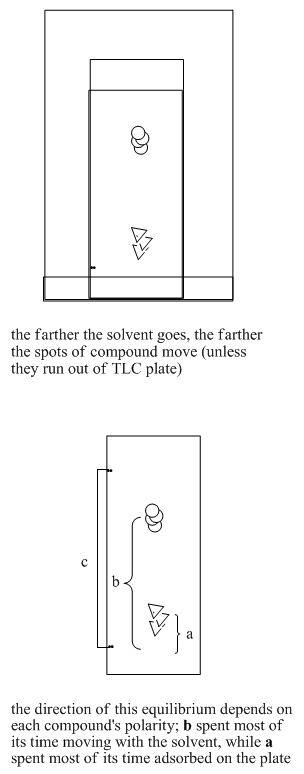
Si la fase sólida es estacionaria, entonces cuando los compuestos son absorbidos sobre el sólido, tampoco se moverán. Si la fase líquida se mueve, entonces cuando los compuestos se disuelven en el líquido, también se moverán a lo largo. Si existe un equilibrio entre la adhesión en fase sólida y la solución en fase líquida, los compuestos pasarán algún tiempo moviéndose y algún tiempo permaneciendo quietos.
Diferentes compuestos pueden tener diferentes equilibrios entre la solución y la adhesión. Eso significa que diferentes compuestos pasarán diferentes cantidades de tiempo moviéndose o permaneciendo quietos. Como resultado, los compuestos se separarán entre sí con el tiempo.
Esquemáticamente, la cromatografía funciona algo así. Se coloca una mezcla en un extremo de la fase sólida estacionaria. En la mayoría de los casos, la fase estacionaria es polar; la polaridad está representada por flechas en el diagrama. Piensa en las flechas como imanes. La cromatografía es un poco como una carrera; ahora mismo, todos están en la línea de salida.
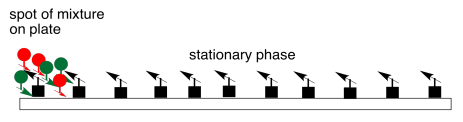
Una fase móvil líquida se hace fluir a través de la fase estacionaria. Si bien los compuestos de la mezcla interactúan con la fase estacionaria y pasan algún tiempo pegándose a ella, también interactuarán con la fase móvil y pasarán algún tiempo disueltos en ella. Mientras se disuelven en la fase móvil, se moverán junto con ella, porque está fluyendo. Comienza la carrera.
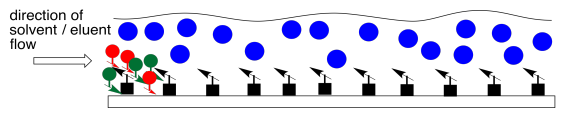
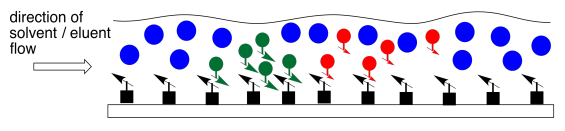
Los dos compuestos en la mezcla tienen diferentes propiedades. Tienen diferentes constantes de equilibrio que rigen cuánto tiempo pasan en la fase líquida, móvil y cuánto tiempo pasan en la fase sólida, estacionaria. Eventualmente, el compuesto menos polar se adelanta al más polar. El compuesto más polar está pasando más tiempo sentado en la fase estacionaria. El compuesto menos polar gana la carrera.
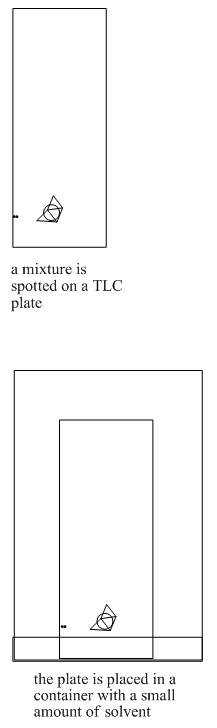
La cromatografía en capa fina a menudo se realiza como un método exploratorio para ver rápidamente si una mezcla de compuestos se puede separar en función de sus equilibrios entre una fase estacionaria, sólida y una fase líquida móvil. La cromatografía en capa fina es como la cromatografía en papel, que a veces se demuestra en la escuela secundaria. Una lámina o placa sólida se sumerge en una solución. A medida que la solución se mueve hacia arriba por la superficie del sólido, los compuestos en la placa se mueven a lo largo en una medida diferente en función de su polaridad.
Una placa de cromatografía en capa fina (TLC) puede estar hecha de metal, vidrio o plástico. La alúmina o sílice se pulveriza sobre la placa y se deja secar, como pintura. Muy a menudo, las placas TLC se compran ya preparadas, con la fase estacionaria ya “pintada” sobre ellas. A veces los estudiantes necesitan hacer los platos ellos mismos.
Los pasos en un experimento de TLC se describen a continuación.
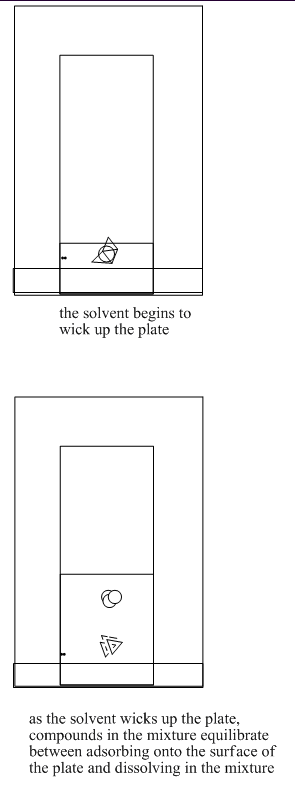
Supongamos que coloca una mancha de muestra en una placa TLC. Tienes pentano y 2-butanona para usar como eluyente. Primero prueba el pentano. Después de que el pentano eluya (o se absorbe) hasta la parte superior del plato, ninguno de los compuestos de su mezcla se ha movido. ¿Qué es lo que pasa? ¿Cómo solucionarás el problema?
- Contestar
-
El pentano no es lo suficientemente polar. Debe agregar un poco de 2-butanona a su sistema de solventes.
Supongamos que coloca una mancha de muestra en una placa TLC. Tienes pentano y 2-butanona para usar como eluyente. Primero prueba la 2-butanona. Después de que la 2-butanona eluya (o se absorbe) hasta la parte superior del plato, todos los compuestos de su mezcla también se han movido a la parte superior de la placa. No se han separado el uno del otro. ¿Qué es lo que pasa? ¿Cómo solucionarás el problema?
- Contestar
-
La 2-butanona es demasiado polar. Debe agregar algo de pentano a su sistema de solventes.
Supongamos que finalmente logras separar tu mezcla en tres manchas en una placa TLC. Se quiere aislar estos tres compuestos puros y ponerlos cada uno en un vial etiquetado. Sube con una serie de pasos que podrías hacer para lograr esta tarea.
- Contestar
-
Siguiendo el método TLC, probablemente querrás comenzar con una placa mucho más grande que la que usaste para tus pruebas iniciales. En lugar de poner un pequeño punto de muestra en el plato, podrías pintar una línea de muestra a lo largo de la placa. Usarías exactamente el mismo sistema de disolventes para eluir la placa, ya que uno que encontraste que funcionaba bien a menor escala. Después de eluir el plato, rasparías las tres líneas (no manchas) que se habían separado en el plato. Se suspendería cada muestra en algún disolvente que sea bastante polar pero que se evapore fácilmente (tal vez la 2-butanona) y filtraría la sílice, luego evaporaría el disolvente. Podrías poner la muestra restante en un vial. repetir con las otras dos muestras separadas
También se puede usar TLC para ayudar a confirmar la identidad de un compuesto. Si sospechamos que una mezcla contiene un determinado compuesto, y tienes a mano una muestra de ese compuesto conocido, podemos cargar la placa TLC con dos manchas, una al lado de la otra. Cuando eluimos la placa, comprobamos para ver si una de las manchas de la mezcla se ha movido a la misma distancia que el compuesto conocido.
Por supuesto, este método no es infalible. Podría ser que uno de los compuestos en la mezcla simplemente pasa a moverse la misma distancia que el compuesto conocido, pero en realidad es otra cosa. Sin embargo, es una manera relativamente fácil de ver si puede tener razón.

