2.3: Simetría orbital
- Page ID
- 72042
El cuadro MO para una molécula se complica cuando hay muchos AO de valencia involucrados. Podemos simplificar enormemente el problema al señalar (sin pruebas aquí) que orbitales de diferente simetría con respecto a la molécula no interactúan. Las operaciones de simetría de una molécula (que pueden incluir rotaciones, planos especulares, centros de inversión, etc.), y las clases de simetría de enlaces y orbitales en moléculas, pueden definirse rigurosamente de acuerdo con la teoría de grupos. Aquí tomaremos un enfoque sencillo de este problema basado en nuestra comprensión intuitiva de la simetría de los objetos tridimensionales como se ilustra en la Fig. \(\PageIndex{1}\).

Los AO deben tener la misma simetría nodal (definida por las operaciones de simetría molecular), o su superposición es cero.
Por ejemplo, en la molécula de HCl, existe un eje de simetría único →, que se define típicamente como el eje z cartesiano, como se muestra en la Fig. \(\PageIndex{2}\).
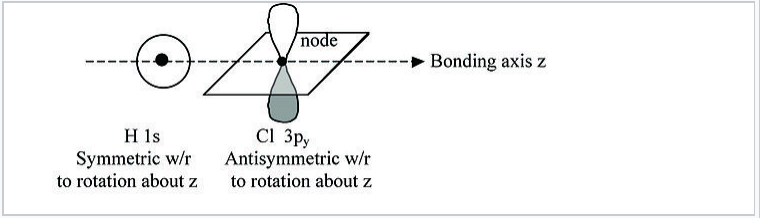
Podemos ver a partir de esta figura que el orbital H 1s se encuentra inalterado por una rotación de 180° alrededor del eje de unión. Sin embargo, la misma rotación invierte el signo de la función Cl 3p y wavefunction. Debido a que estos dos orbitales tienen simetrías diferentes, el orbital Cl 3p y es no enlazante y no interactúa con los H 1s. Lo mismo ocurre con el Cl 3p x orbital. Los orbitales p x y p y tienen simetría π (plano nodal que contiene el eje de unión) y están etiquetados π nb en el diagrama de nivel de energía MO, Fig. \(\PageIndex{3}\). En contraste, los orbitales H 1s y Cl 3p z tienen ambos simetría σ, que es también la simetría de la vasija de barro mostrada en la Fig. \(\PageIndex{1}\). Debido a que estos orbitales tienen la misma simetría (en el grupo puntual de la molécula), pueden hacer las combinaciones de unión y antiunión mostradas en la Fig. 2.1.1.
El diagrama MO de HCl que incluye todos los orbitales de valencia del átomo de Cl se muestra en la Fig. \(\PageIndex{3}\). Dos de los orbitales de valencia Cl (3p x y 3p y) tienen la simetría incorrecta para interactuar con el orbital H 1s. El orbital Cl 3s tiene la misma simetría (σ) que H 1s, pero es mucho menor en energía por lo que hay poca interacción orbital. La energía del orbital de Cl 3s se ve afectada así solo ligeramente al formar la molécula. Los pares de electrones en los orbitales π nb y σ nb son, por lo tanto, no enlazantes.
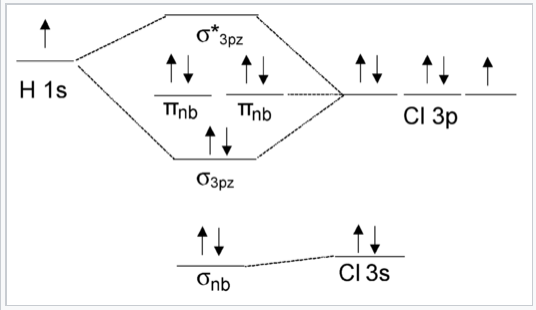
Obsérvese que el resultado MO en la Fig. \(\PageIndex{3}\)(1 enlace y tres pares de electrones no enlazantes) es lo mismo que obtendríamos de la teoría de enlaces de valencia para HCl. Los orbitales no enlazantes se localizan en el átomo de Cl, tal como supondríamos a partir de la imagen del vínculo de valencia.
Para diferenciarlo del orbital de unión σ, se designa con un asterisco el orbital σ antiadhesión, que está vacío en este caso.


