2.4: orbitales σ, π y δ
- Page ID
- 72088
Los compuestos inorgánicos utilizan orbitales s, p y d (y más raramente orbitales f) para hacer combinaciones de unión y antiunión. Estas combinaciones dan como resultado enlaces σ, π y δ (y antienlaces).
Ya está familiarizado con los enlaces σ y π en compuestos orgánicos. En química inorgánica, los enlaces π se pueden hacer a partir de orbitales p- y/o d-. Los enlaces δ son más raros y ocurren por superposición cara a cara de orbitales d-, como en el ion Re 2 Cl 8 2 -. El hecho de que los átomos de Cl estén eclipsados en este anión es evidencia de unión δ.
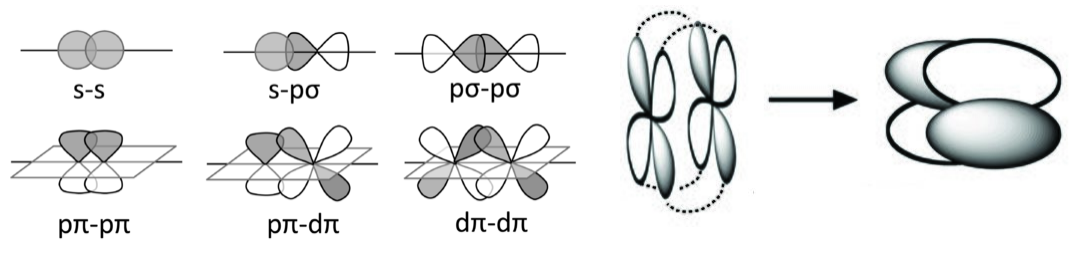
Algunas posibles combinaciones de unión σ (fila superior), π (fila inferior) y δ (derecha) de orbitales s, p y d se esbozan a continuación. En cada caso, podemos hacer combinaciones de unión o antiadhesión, dependiendo de los signos de las funciones de onda AO. Debido a que la unión pπ-pπ implica la superposición lateral de los orbitales p, se observa más comúnmente con elementos de la segunda fila (C, N, O). Los compuestos unidos por π de elementos más pesados son raros porque los núcleos más grandes de los átomos evitan una buena superposición π. Por esta razón, los compuestos que contienen dobles enlaces C=C son muy comunes, pero aquellos con enlaces Si=Si son raros. Los enlaces δ son generalmente bastante débiles en comparación con los enlaces σ y π. Los compuestos con enlaces δ metal-metal ocurren en la mitad de la serie de transición.
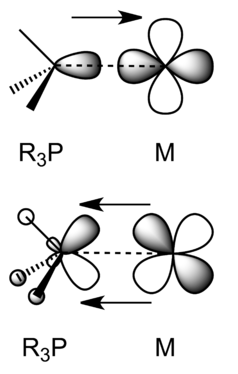
Los orbitales d de metales de transición también pueden formar enlaces σ, típicamente con orbitales híbridos s-p de simetría apropiada sobre ligandos. Por ejemplo, las fosfinas (R 3 P:) son buenos donantes σ en complejos con metales de transición, como se muestra a continuación.
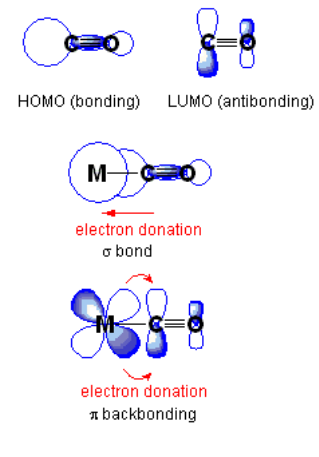
La unión pπ-dπ también es importante en los complejos de metales de transición. En los complejos carbonílicos metálicos como Ni (CO) 4 y Mo (CO) 6, existe solapamiento lateral entre los orbitales d metálicos rellenos y los orbitales n-antienlace vacíos (el LUMO) de la molécula de CO, como se muestra en la siguiente figura. Esta interacción fortalece el enlace metal-carbono pero debilita el enlace carbono-oxígeno. La frecuencia de estiramiento infrarrojo C-O es diagnóstica de la fuerza del enlace y se puede utilizar para estimar el grado en que los electrones se transfieren del orbital d metálico al orbital antienlace de CO π.
El mismo tipo de backbonding ocurre con los complejos de fosfina, que tienen orbitales π vacíos, como se muestra a la derecha. Los complejos de metales de transición que contienen ligandos de haluro también pueden tener un enlace pπ-dπ significativo, en el que un orbital pπ relleno en el ligando dona densidad electrónica a un orbital dπ metálico no relleno. Nos encontraremos con estas situaciones de vinculación en el Capítulo 5.


