2.5: Moléculas diatómicas
- Page ID
- 72020
La teoría del enlace de valencia falla para varias de las diatómicas de la segunda fila, la más famosa para O 2, donde predice una molécula diamagnética doblemente unida con cuatro pares solitarios. O 2 sí tiene un doble enlace, pero tiene dos electrones desapareados en el estado fundamental, una propiedad que puede ser explicada por la imagen MO. Podemos construir los diagramas de nivel de energía MO para estas moléculas de la siguiente manera
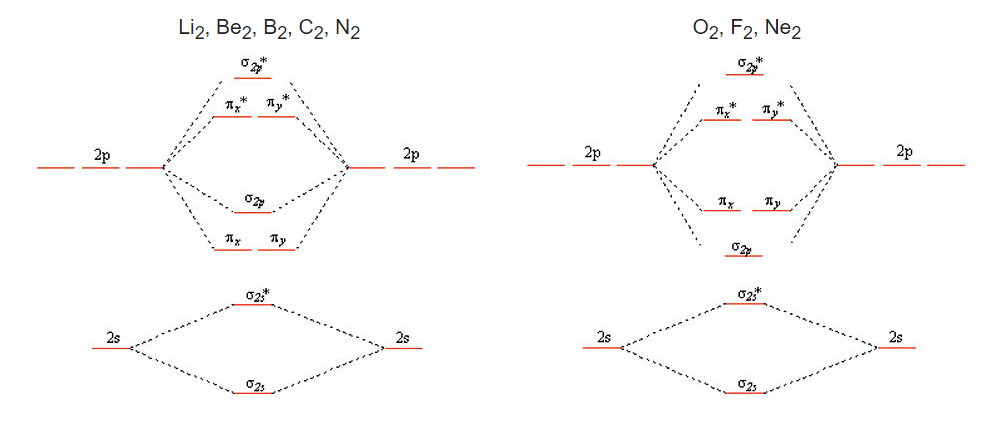
Obtenemos la imagen de MO diatómica más simple a la derecha cuando los AO 2s y 2p están bien separados en energía, como lo son para O, F y Ne. La imagen de la izquierda es el resultado de la mezcla de las MO σ 2s y σ 2p, que son cercanas en energía para Li 2, Be 2, B 2, C 2 y N 2. El efecto de esta mezcla es empujar el σ 2s * hacia abajo en energía y el σ 2p hacia arriba, hasta el punto donde los orbitales pπ están por debajo de los σ 2p. Las moléculas diatómicas asimétricas y los iones como CO, NO y NO + también tienen el orden de los niveles de energía que se muestran a la izquierda debido a la mezcla de sp. Una buena animación de los orbitales moleculares en la molécula de CO se puede encontrar en el sitio web de la Universidad de Liverpool Structure and Bonding.
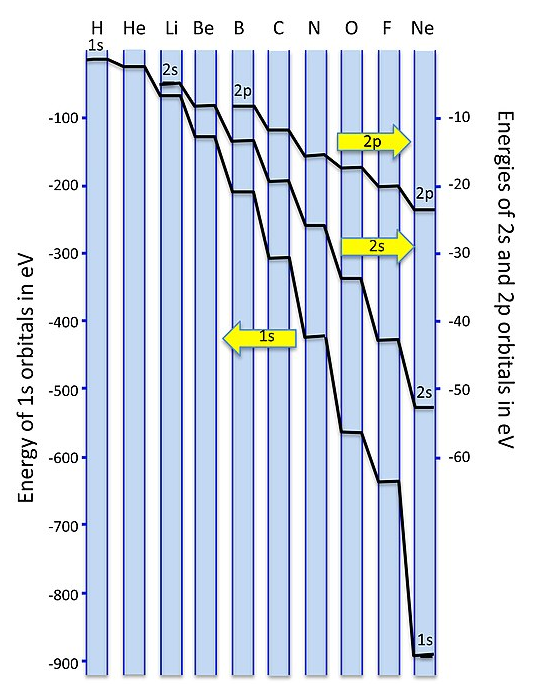
¿Por qué no obtenemos mezcla sp-orbital para O 2 y F 2? El motivo tiene que ver con las energías de los orbitales, que no se dibujan a escala en el simple cuadro de arriba. A medida que avanzamos por la segunda fila de la tabla periódica de Li a F, vamos añadiendo progresivamente protones al núcleo. El orbital 2s, que tiene amplitud finita en el núcleo, “siente” la carga nuclear aumentada más que el orbital 2p. Esto significa que a medida que avanzamos a través de la tabla periódica (y también, como veremos más adelante, cuando bajemos por la tabla periódica), la diferencia de energía entre los orbitales s y p aumenta. A medida que las energías 2s y 2p se separan más en energía, hay menos interacción entre los orbitales (es decir, menos mezcla).
A continuación se muestra una gráfica de las energías orbitales. Debido a la gran diferencia de energía entre los orbitales 1s y 2s/2p, los trazamos en diferentes escalas de energía, con los 1s a la izquierda y los 2s/2p a la derecha. Para los elementos del lado izquierdo del 2do periodo (Li, Be, B) las energías 2s y 2p están a solo unas pocas eV de distancia. La diferencia de energía se vuelve muy grande -más de 20 electrón voltios- para O y F. Dado que las energías de enlace simple suelen ser de aproximadamente 3-4 eV, esta diferencia de energía sería muy grande en la escala de nuestros diagramas MO. Para todos los elementos de la 2ª fila de la tabla periódica, los orbitales 1s (núcleo) son muy bajos en energía en comparación con los orbitales 2s/2p (valencia), por lo que no necesitamos considerarlos al dibujar nuestros diagramas MO.