2.7: Tendencias periódicas en la vinculación π
- Page ID
- 72085
Como señalamos en la Sección 2.3, la vinculación pπ-casi siempre implica un elemento de segunda fila.
En los diagramas MO de la diatómica de la segunda fila (B 2... O 2) encontramos unión π-bonding a partir del solapamiento lateral de orbitales p. Es importante recordar que los enlaces π son más débiles que los enlaces σ hechos de los mismos AO, y son especialmente débiles si involucran elementos más allá de la segunda fila.
Ejemplo:
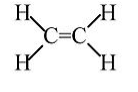 Etileno: Molécula estable, no polimeriza sin catalizador.
Etileno: Molécula estable, no polimeriza sin catalizador.
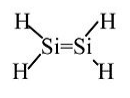 Silileno: Nunca aislado, polimeriza espontáneamente. Los cálculos indican 117 kJ/mol de estabilidad en la fase gaseosa con relación a H 2 Si-SiH 2 de unión simple (triplete).
Silileno: Nunca aislado, polimeriza espontáneamente. Los cálculos indican 117 kJ/mol de estabilidad en la fase gaseosa con relación a H 2 Si-SiH 2 de unión simple (triplete).
El gran núcleo de Ne de átomos de Si inhibe la superposición lateral de orbitales 3p → enlace π débil.
Otros ejemplos: P 4 vs N 2
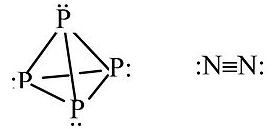
El P no puede hacer enlaces π consigo mismo, por lo que forma una molécula tetraédrica con una tensión sustancial del anillo. Este alótropo de P sufre combustión espontánea en el aire. El fósforo blanco sólido se convierte muy lentamente en fósforo rojo, un alótropo más estable que contiene láminas de átomos de P piramidales, cada una con enlaces a tres átomos vecinos y un par solitario.
|
El fósforo blanco (P 4) es un sólido ceroso suave que se enciende espontáneamente en el aire, ardiendo con una llama brillante y generando copioso humo blanco P 4 O 10. La muestra que se muestra aquí es fotografiada bajo el agua para evitar la reacción de oxidación |
N puede hacer enlaces π, por lo que N 2 tiene un triple enlace muy fuerte y es un gas diatómico relativamente inerte.
(CH 3) 2 SiO vs. (CH 3) 2 CO
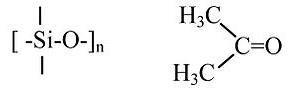
Polímero de silicona “RTV” (4 enlaces simples a Si) vs acetona (doble enlace C=O). Las siliconas son polímeros blandos y flexibles que se pueden calentar a altas temperaturas (>300 °C) sin descomponerse. La acetona es un líquido molecular inflamable que hierve a 56 °C.
|
Los polímeros de silicona (R 2 SiO) n se utilizan en utensilios de cocina antiadherentes como estos muffins, en Silly Putty, robótica blanda y muchas otras aplicaciones. |
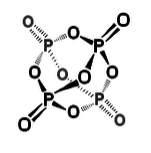
Excepciones:
Los elementos de la segunda fila pueden formar enlaces π razonablemente fuertes con el más pequeño de los elementos de la tercera fila, P, S y Cl. Así encontramos enlaces S=N en compuestos azufre-nitrógeno como S 2 N 2 y S 3 N 3 -, enlaces P=O en ácido fosfórico y P 4 O 10 (mostrado anteriormente), y un orbital π-molecular deslocalizado en SO 2 (como en ozono).




