3.3: Ácidos y bases duros y blandos
- Page ID
- 72113
Los ácidos y bases de Lewis se pueden clasificar designándolos como duros o blandos.
Ácidos/Bases Duros:
Los ácidos y bases “duros” tienen una alta relación de carga (positiva para ácidos, negativa para bases) a radio iónico junto con estados de oxidación más altos. Los ácidos duros no son muy polarizables y tienen altas densidades de carga. Así, los iones metálicos con altas cargas positivas y tamaños iónicos más pequeños tienden a ser ácidos duros. Los iones de metales de transición tempranos en la serie 3d tienden a ser ácidos de Lewis duros. Las bases duras son típicamente aniones pequeños y moléculas neutras. Algunos ejemplos de ácidos duros y bases incluyen: H +, O 2-, OH -, F -, Fe 3 + y Al 3 +.
Ácidos/Bases Blandas:
Los ácidos o bases “blandos” tienen una relación de carga a radio baja, con estados de oxidación bajos. Normalmente son iones más grandes que son polarizables. Por ejemplo, I - y S2- son bases blandas y los metales de transición de baja densidad de carga, como Ag +, se consideran ácidos blandos. Los ácidos blandos suelen incluir metales de transición en la segunda y tercera fila de la tabla periódica que tienen una carga +1 o +2, así como metales de transición tardía (especialmente los de las series 4d y 5d) con orbitales d llenos o casi completamente llenos.
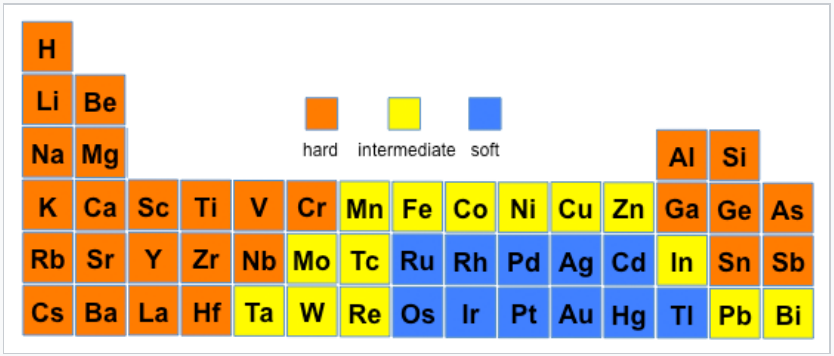
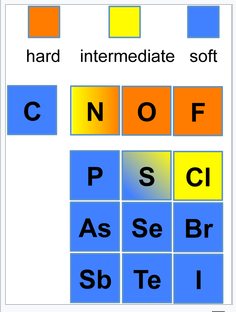
Los ácidos y bases no son estrictamente duros ni blandos, con muchos iones y compuestos clasificados como intermedios. Por ejemplo, los cationes trimetilborano, Fe 2 + y Pb 2 + son ácidos intermedios, y piridina y anilina son ejemplos de bases intermedias. Un elemento también puede cambiar su carácter duro/blando dependiendo de su estado de oxidación. El ejemplo más extremo es el hidrógeno, donde H + es un ácido duro y H - es una base blanda. Ni 3 + (como en el compuesto estratificado NiOOH) es un ácido duro, pero Ni 0 (como en Ni (CO) 4) es un ácido blando. Las siguientes cifras muestran tendencias duro/blando para ácidos (izquierda) y bases (derecha) en la tabla periódica. Para las bases, la mayor discontinuidad dura/blanda es entre la 2da fila (N, O, F) y las filas de abajo.
|
Tendencias duras y blandas para los ácidos |
|
Tendencias duro-suaves para bases |
Like se une con Like Los ácidos
duros interactúan más fuertemente con bases duras que con bases blandas, y los ácidos blandos interactúan más fuertemente con bases blandas que con bases duras. Así, los complejos más estables son aquellos con interacciones duro-duro y blando-blando. Esta tendencia se ilustra en la siguiente tabla, que muestra la tendencia en las constantes de formación para ácidos duros y blandos. Los ácidos duros se unen a los haluros en el orden F - > Cl - > Br - > I -, mientras que los ácidos blandos siguen la tendencia opuesta.
| Log K 1 | fluoruro | cloruro | bromuro | yoduro | clasificación ácida |
|---|---|---|---|---|---|
| Fe 3 + | 6.0 | 1.4 | 0.5 | - | Duro |
| Pb 2 + | 1.3 | 0.9 | 1.1 | 1.3 | Intermedio |
| Ag + | 0.4 | 3.3 | 4.7 | 6.6 | Suave |
| Hg 2 + | 1.0 | 6.7 | 8.9 | 12.9 | Suave |
El ion metálico más blando en la tabla periódica es Au + (aq). Forma complejos estables con bases blandas como fosfinas y CN -, pero no con bases duras como O 2- o F -. La afinidad de Au + por la base blanda CN - es alta, y el complejo resultante [Au (CN) 2] - es tan estable que el oro (que normalmente es muy difícil de oxidar) puede ser oxidado por el oxígeno en el aire:
\[\ce{4Au_{(s)} + 8CN^{-}_{(aq)} + O2_{(g)} + 2H2O = 4[Au(CN)2]^{-}_{(aq)} + 4OH^{-}}\]
Esta reacción se utiliza en la minería de oro para separar pequeñas escamas de Au de grandes volúmenes de arena y otros óxidos. El Ag se disuelve de manera similar por oxidación al aire en soluciones de cianuro. Los metales preciosos se aíslan de la solución utilizando agentes reductores químicos o mediante galvanoplastia. El uso de iones cianuro a gran escala en la minería, sin embargo, crea un peligro ambiental potencialmente grave. En 2000, un derrame en Baia Mare, Rumanía, resultó en el peor desastre ambiental en Europa desde Chernobyl. El cianuro, que es altamente tóxico, se oxida gradualmente por el aire al ion cianato (OCN -) menos tóxico. A escala de laboratorio, las soluciones de recubrimiento de cianuro se desechan típicamente mediante el uso de lejía para oxidar CN - a OCN -, y el metal se recupera como una sal de cloruro insoluble.
|
Estanque de solución en red junto a lixiviación en pilas de cianuro de mineral de oro cerca de Elko, Nevada (1992). |
El ion Au 3 +, debido a su mayor carga positiva, es un ácido más duro que el Au + y puede formar complejos con bases más duras como H 2 O y aminas. De acuerdo con el principio de “como se une como”, el compuesto AuI (suave-blando) es estable, pero se desconoce el AuI 3 (duro-blando). Por el contrario, AuF nunca se ha aislado pero AuF 3 (duro duro) es estable.