10.1: Adición Oxidativa y Eliminación Reductiva
- Page ID
- 69208
Objetivos de aprendizaje
En esta conferencia aprenderás lo siguiente
- Las reacciones de adición oxidativa.
- Las reacciones de eliminación reductora.
- Diversas vías mecanicistas prevalentes para estas reacciones.
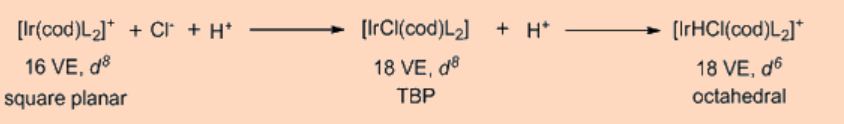
La adición oxidativa (OA) es un proceso que agrega dos ligandos aniónicos e. g. A y B, que originalmente forman parte de una molécula A-B, como en H 2 o Me-I, sobre un centro metálico y es de importancia significativa desde la perspectiva tanto de la síntesis como de la catálisis. El reverso exacto del mismo proceso, en el que los dos ligandos, A y B, se eliminan del centro metálico formando de nuevo la molécula A-B, se denomina eliminación reductiva (RA). Como A y B son ligandos aniónicos de tipo X, la adición oxidativa va acompañada de un incremento en el número de coordinación, recuento de electrones de valencia así como en el estado de oxidación formal del centro metálico en dos unidades. La etapa de adición oxidativa puede proceder por una variedad de vías. Requiere que el centro metálico sea coordinativamente insaturado y deficiente en electrones.
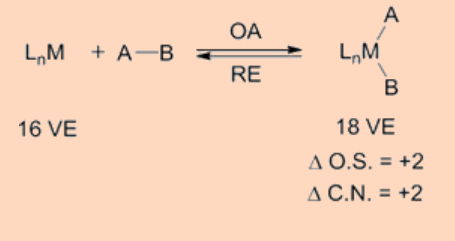
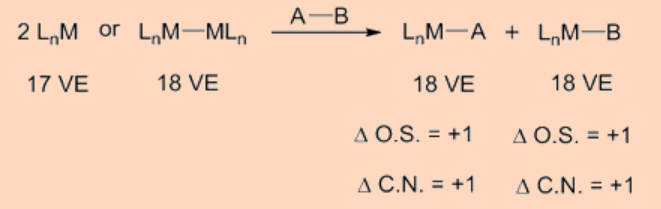
La adición oxidativa transfiere un solo centro de metal mononuclear que tiene 16 VE a una especie de 18 VE tras la adición oxidativa. Otra vía frecuentemente observada es que un complejo de 18 VE pierde un ligando para convertirse en una especie de 16 VE que luego se somete a una adición oxidativa. Aparte de los dos tipos anteriores, otra posible vía para la adición oxidativa procede como una adición oxidativa binuclear en la que cada uno de los dos centros metálicos experimentan cambios en el estado de oxidación, recuento de electrones y número de coordinación por una unidad en lugar de dos. Este tipo de adición oxidativa binuclear se observa para un complejo metálico de 17 VE o para un complejo metálico binuclear de 18 VE que tiene un enlace metal-metal y, para el cual el metal tiene un estado de oxidación estable en un estado de oxidación positivo superior por una unidad.
Es interesante observar que en la adición oxidativa la rotura del enlace A-B σ−se produce como resultado de una transferencia neta de electrones desde el centro metálico a un σ*−orbital del enlace A-B, resultando así en la formación de los dos nuevos enlaces M−A y M−B. La adición oxidativa se ve facilitada por centros metálicos ricos en electrones que tienen bajo estado de oxidación, mientras que la eliminación reductora es facilitada por centros metálicos en estado de oxidación superior.
Mesa\(\PageIndex{1}\). Tipos comunes de reacciones de adición oxidativa.

Abreviaturas: Lin. = lineal, Tet. = tetraédrico, Oct. = octaédrico, Sq. Pl. = plano cuadrado, TBP = bipiramidal trigonal, Sq. Pyr. = piramidal cuadrado: 7-c, 8-c = coordenadas 7 y 8.
En principio, la adición oxidativa es la inversa de la eliminación reductiva, pero en la práctica una puede dominar sobre la otra. Así, la favorabilidad de uno sobre el otro depende de la posición de equilibrio, que depende además de la estabilidad de los dos estados de oxidación del metal y de la diferencia de fuerzas de unión de A-B frente a la de los enlaces M−A y M−B. Por ejemplo, los complejos de hidruro metálico frecuentemente experimentan eliminación reductora para dar alcanos, pero raramente un alcano se somete a adición oxidativa para dar un complejo de hidruro de alquilo. A lo largo de la misma línea, los haluros de alquilo frecuentemente experimentan adición oxidativa a un metal dando complejos de metal—haluro de alquilo, pero estos complejos rara vez eliminan reductivamente para devolver haluros de alquilo. Por lo general, la adición oxidativa es más común para los metales de transición de la tercera fila porque tienden a poseer fuerzas de enlace de ligando metálico más fuertes. La adición oxidativa también se ve favorecida por ligandos donantes fuertes, ya que estabilizan el estado de oxidación más alto del metal. La reacción de adición oxidativa puede expandirse más allá de los metales de transición como se observa en el caso de los reactivos de Grignard así como para algunos elementos del grupo principal.
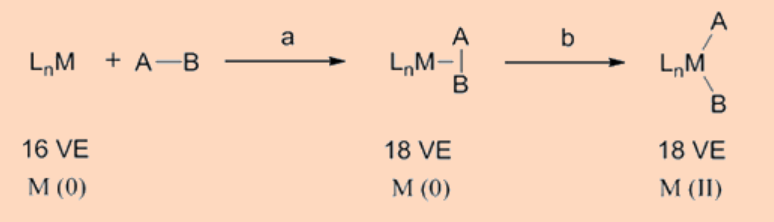
La adición oxidativa puede proceder por varias vías como se discute a continuación.
Vía de adición oxidativa concertada
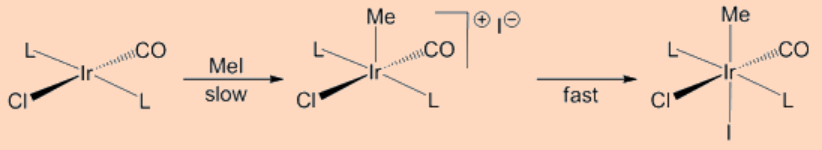
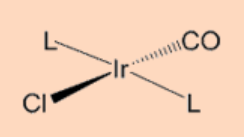
La adición oxidativa puede proceder mediante un mecanismo asociativo concertado centrado en 3 que involucra al ligando entrante con el centro metálico. Específicamente, la adición procede por la formación de un complejo σ—tras la unión de un ligando entrante, digamos, H2, seguido de la escisión del enlace H-H como resultado de la retrodonación de electrones del metal al orbital σ*−del enlace H-H. Tal tipo de adición es común para los enlaces H-H, C-H y Si-H. Como se esperaba, estos proceden por dos etapas (i) la formación de un complejo σ−y (ii) la etapa de oxidación. Por ejemplo, la adición oxidativa de H 2 al complejo de Vaska (PMe 3) 2 Ir (CO) Cl procede por estas vías.
Vía S N 2
Esta vía de adición oxidativa es operativa para el tipo AB polarizado de sustratos de ligando como los haluros de alquilo, acilo, alilo y bencilo. En este mecanismo, el fragmento LnM dona directamente electrones al σ*−orbital del enlace A−B atacando el átomo menos electronegativo, digamos A, de la molécula AB e iniciando simultáneamente la eliminación del átomo más electronegativo de la molécula AB en su forma aniónica, B − . Estas reacciones proceden a través de un estado de transición polar que se acompaña de una inversión de la estereoquímica en el átomo de ataque por el centro metálico y generalmente se aceleran en disolventes polares.
Vía radical
Este tipo de adición oxidativa procede a través de una vía radical que generalmente son vulnerables a la presencia de impurezas. Los procesos radicales pueden ser de tipo no cadena y cadena. En un tipo de mecanismo sin cadena, el metal (M) transfiere un electrón al σ*−orbital del enlace RX dando como resultado la formación de un catión radical M+• y un anión radical RX −•. La generación de los dos fragmentos de radicales se produce por medio de la eliminación del anión X − del radical anión RX −• dejando atrás el radical R • mientras que la reacción posterior del anión X − con el catión radical M+• genera el otro radical MX • en el curso de la reacción. Dicho tipo de adición oxidativa sin cadena se observa para la adición del haluro de alquilo a complejos de Pt (PPh 3) 3.
\[\ce{PtL3 ->[fast] PtL2}\]
\[\ce{PtL2 + RX -> ^{•}PtL2 + ^{•-}RX ->[slow] ^{•}PtXL2 + ^{•}R}\]
\[\ce{^{•}PtXL2 + ^{•}R ->[fast] RPtXL2}\]
El otro tipo en esta categoría es la reacción de tipo radical en cadena que se suele observar para la adición oxidativa de EtBr y PhCh 2 Br al complejo (PMe 3) 2 Ir (CO) Cl. Para este proceso se requiere un iniciador de radicales y la reacción avanza a lo largo de una serie de etapas conocidas comunes a un proceso radical.
\[\ce{R^{•} + IR^{I}Cl(CO)L2 -> RIr^{II•}Cl(CO)L2}\]
\[\ce{RIr^{II•}Cl(CO)L2 + RX -> RXIr^{III}Cl(CO)L2 + R^{•}}\]
\[\ce{2R^{•} -> R2}\]
Vía iónica
Esta es una especie de vía para la reacción de adición oxidativa que es común a la adición de haluros de hidrógeno (HX) en sus formas H + y X − disociadas. Las vías iónicas suelen ser de los siguientes dos tipos (i) aquellos en los que el complejo metálico de partida se añade a H + antes de la adición del haluro X − y (ii) el otro tipo, en el que el anión haluro X − se añade al complejo metálico de partida primero, y luego se produce la adición de protón H + en el complejo metálico.

Eliminación Reductiva
Las r eliminaciones educativas son inversas de las reacciones de adición oxidativa y van acompañadas de la reducción del estado de oxidación formal del metal y los números de coordinación en dos unidades. Las eliminaciones reductoras se observan comúnmente para los sistemas d 8, como los iones Ni (II), Pd (II) y Au (III) y los sistemas d 6, como los iones Pt (IV), Pd (IV), Ir (III) y Rh (III). La reacción puede proceder por la eliminación de varios grupos.
\[\ce{L_{n}MRH -> L_{n}M + R-H}\]
\[\ce{L_{n}MR2 -> L_{n}M + R-R}\]
\[\ce{L_{n}MH(COR) -> L_{n}M + RCHO}\]
\[\ce{L_{n}MR(COR) -> L_{n}M + R2CO}\]
\[\ce{L_{n}MR(SiR3) -> L_{n}M + R-SiR3}\]
Eliminación reductiva binuclear
Similar a lo que se ha observado en el caso de la adición oxidativa binuclear, también se observa en algunos casos la eliminación reductiva binuclear. Como era de esperar, el estado de oxidación y el número de coordinación disminuyen en una unidad en la vía de eliminación reductiva binuclear.
\[\ce{2MeCH=CHCu(PBu3) ->[heat] MeCH=CHCH=CHMe}\]
\[\ce{ArCOMn(CO)5 + HMn(CO)5 -> ArCHO + Mn2(CO)10}\]
Problemas
1. ¿Qué tipo de centros metálicos favorecen la adición oxidativa?
Ans: Centros metálicos de baja valencia ricos en electrones.
2. Completa la oración correctamente.
(a) La eliminación reductiva se observa frecuentemente en complejos metálicos saturados/insaturados coordinadamente.
(b) La eliminación reductiva va acompañada de aumento/disminución en el estado de oxidación del metal.
c) La adición oxidativa va acompañada de aumento/disminución en el número de coordinación del metal
Ans:
(a) Saturadas.
b) Disminución del estado de oxidación en dos unidades.
c) Incremento del número de coordinación en dos dependencias
3. Indicar las diversas vías mecanicistas involucradas en las reacciones de adición oxidativa.
Respuesta: Adición oxidativa concertada, mecanismo S N 2, mecanismo radical e iónico.
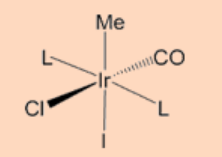
4. Completar la reacción.
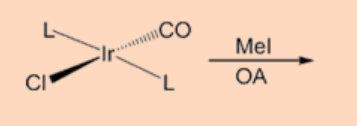
Ans:
Prueba de autoevaluación
1. ¿Qué tipo de centros metálicos favorecen la eliminación reductora?
Ans: Centros metálicos de alta valencia deficientes en electrones
2. Completa la oración correctamente.
(a) La adición oxidativa se observa frecuentemente en complejos metálicos saturados/insaturados coordinadamente.
(b) La adición oxidativa va acompañada de aumento/disminución en el estado de oxidación del metal.
c) La eliminación reductiva va acompañada de aumento/disminución en el número de coordinación del metal.
Ans: a
) No saturados.
b) Incremento en el estado de oxidación en dos unidades.
c) Disminución de los números de coordinación en dos dependencias.
3. ¿Cómo cambia la geometría de los complejos planos cuadrados tras las reacciones de adición oxidativa?
Ans: Cuadrado plano a octaédrico.
4. Completar la reacción.
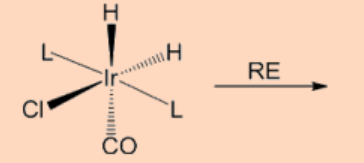
Ans:
Resumen
La adición oxidativa y las reacciones de eliminación reductiva son como la observación y el reverso de una misma moneda. La adición oxidativa se observa generalmente para centros metálicos con bajo estado de oxidación y suele ir acompañada por el aumento en el estado de oxidación, el recuento de electrones de valencia y el número de coordinación del metal por dos unidades. Al ser opuesto, la eliminación reductiva se observa en el caso de los centros metálicos con mayor estado de oxidación y se acompaña de la disminución en el estado de oxidación, el recuento de electrones de valencia y el número de coordinación del metal por dos unidades. La adición oxidativa puede proceder por una variedad de vías que involucran mecanismos concertados, iónicos y basados en radicales. Lo más interesante es que las reacciones de adición oxidativa y eliminación reductiva no se restringen únicamente a los complejos metálicos mononucleares, sino que también se pueden observar para los complejos binucleares.


