2.2.4: Blindaje
- Page ID
- 81228
Introducción
La Ley de Coulomb es de la física clásica; nos dice que las partículas con carga electrostática opuesta son atraídas entre sí, y cuanto mayor es la carga en cualquiera de las partículas o cuanto más cerca es la distancia entre ellas, más fuerte es la atracción. La ley de Coulomb explica por qué el tamaño atómico disminuye a medida que aumenta la carga sobre el núcleo, pero no puede explicar los matices y variaciones de tamaño a medida que vamos a través de la tabla periódica. La Ley de Coulomb también explica por qué los electrones en diferentes conchas (n), a diferentes distancias del núcleo, tienen diferentes energías. Pero por sí sola, la ley de Coulomb no explica del todo por qué las subcapas de electrones dentro de una concha (como 2s vs. 2p) tendrían diferentes energías. Para explicar estas cosas, debemos considerar cómo tanto el blindaje electrónico como la penetración dan como resultado variaciones en la carga nuclear efectiva (Z*) que dependen de la carcasa y la subcapa.
Carga Nuclear Efectiva (Z*)
|
La ley de Coulombs funciona bien para predecir la energía de un electrón en un átomo de hidrógeno (porque H tiene solo un electrón). También funciona para átomos similares al hidrógeno: cualquier núcleo con exactamente un electrón (un ion He +, por ejemplo, tiene un electrón). Sin embargo, la ley de Coulomb es insuficiente para predecir las energías de los electrones en átomos e iones de múltiples electrones.
Los electrones dentro de un átomo de múltiples electrones interactúan con el núcleo y con todos los demás electrones. Cada electrón en un átomo multielectrón experimenta tanto atracción hacia el núcleo como repulsión por interacciones con otros electrones. La presencia de múltiples electrones disminuye en cierta medida la atracción nuclear. Cada electrón en un átomo de múltiples electrones experimenta una magnitud diferente de (y atracción hacia) la carga nuclear dependiendo de qué capa y subcapa específicas ocupe el electrón. La cantidad de carga nuclear positiva experimentada por cualquier electrón individual es la carga nuclear efectiva (Z*).
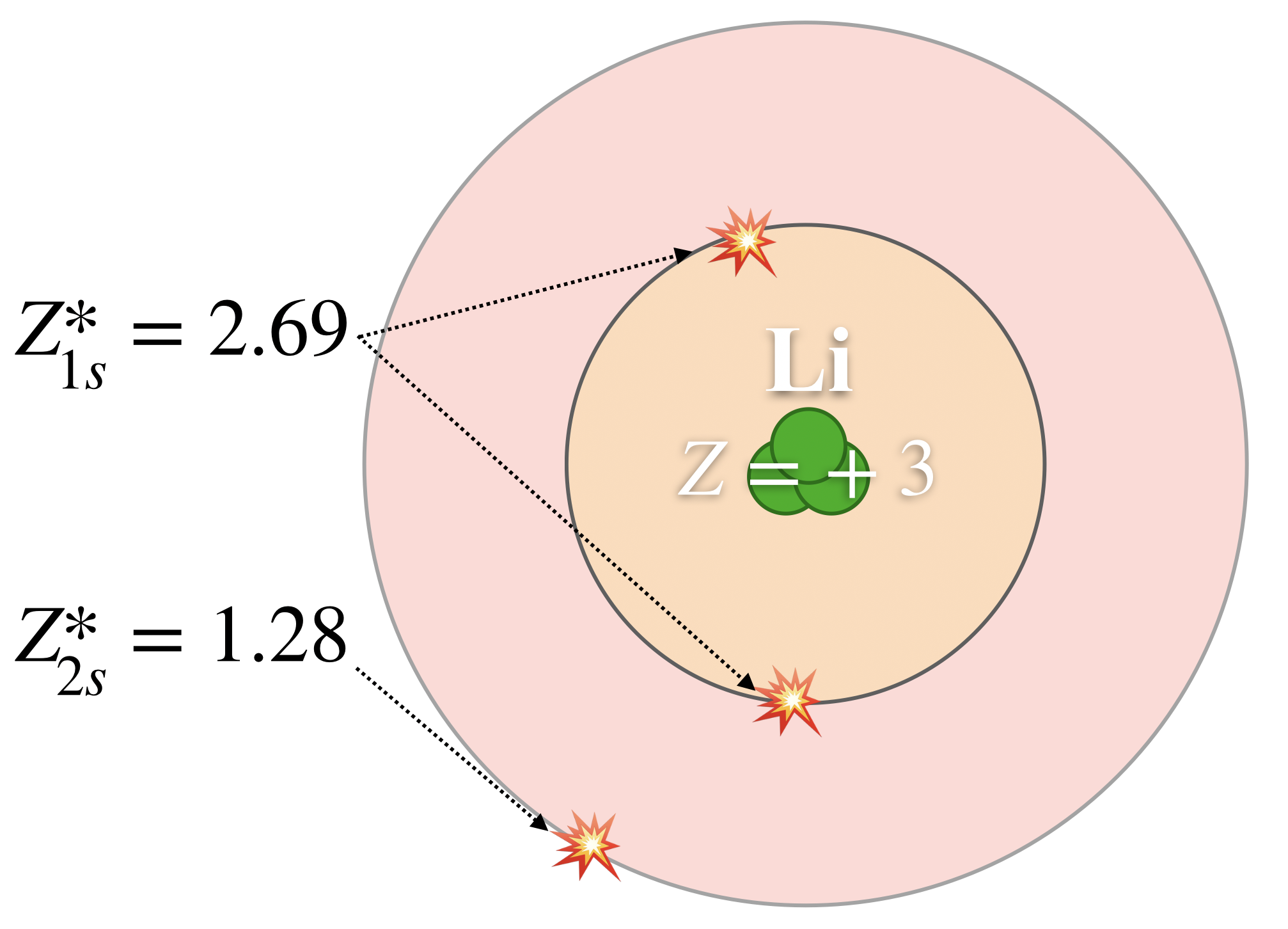
Por ejemplo, en el litio (Li), ninguno de los tres electrones “siente” la carga +3 completa del núcleo (ver Figura\(\PageIndex{1}\)). Más bien, cada electrón “siente” una Z* que es menor que la Z real y que depende de la órbita del electrón. La carga nuclear real en Li es\(Z=+3\); los electrones 1s experimentan a\(Z^* =+2.69\), y el electrón 2s experimenta a\(Z^* = +1.28\). En general, los electrones centrales (o los electrones más cercanos al núcleo), “sienten” una Z* que está cerca, pero menor que Z. Por otro lado, los electrones de valencia externa experimentan una Z* que es mucho menor que Z.
En resumen:
- Electrones de núcleo:\(Z^* \lessapprox Z\)
- Electrones de valencia:\(Z^* \ll Z\)
Blindaje:
El blindaje es la reducción de la carga nuclear verdadera (Z) a la carga nuclear efectiva (Z*) por otros electrones en un átomo o ion multi-electrón. El blindaje ocurre en todos los átomos e iones que tienen más de un electrón. H es el único átomo en el que no se produce blindaje.
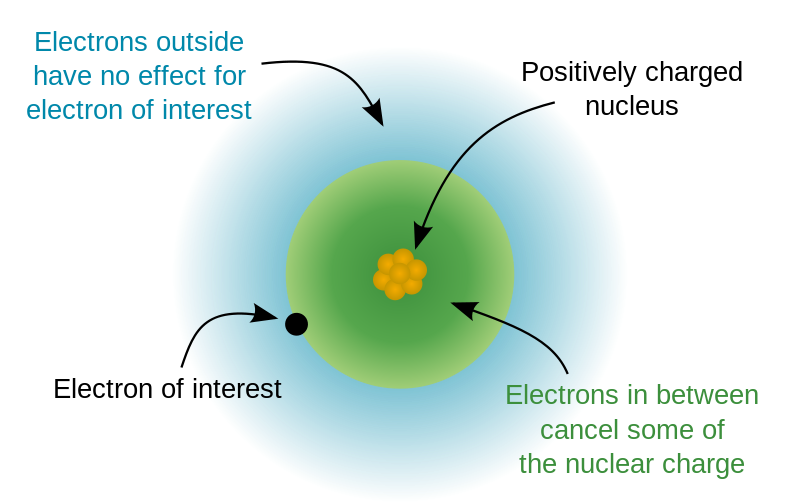
Explicación del blindaje: Los electrones en un átomo multielectrónico interactúan con el núcleo y todos los demás electrones en el átomo. Para describir el blindaje, podemos usar un modelo simplificado del átomo: elegiremos un electrón de interés en un átomo multielectrónico y trataremos a todos los “otros” electrones como un grupo de carga negativa distribuida esféricamente. La electrostática clásica nos permite tratar la distribución esférica de carga como un punto de carga en el centro de la distribución. Así, consideramos a todos los “otros” electrones de nuestro átomo como un punto de carga negativa en el centro del átomo. Si bien la carga positiva del núcleo proporciona una fuerza atractiva hacia nuestro electrón, la distribución de carga negativa en el centro del átomo proporcionaría una fuerza repulsiva. Las fuerzas atractivas y repulsivas se cancelarían parcialmente entre sí; pero como hay menos “otros” electrones que protones en nuestro átomo, la carga nuclear nunca se cancela por completo. Los “otros” electrones bloquean parcialmente, o blindan, parte de la carga nuclear para que nuestro electrón de interés experimente una carga nuclear parcialmente reducida, la Z*.
En realidad, no hay una “cancelación” uno por uno de la carga nuclear por cada electrón. En parte debido a la penetración, ningún electrón solo puede blindar completamente una unidad completa de carga positiva. Los electrones centrales blindan los electrones de valencia, pero los electrones de valencia tienen poco efecto sobre la Z* de los electrones centrales. La capacidad de blindar, y ser blindado por, otros electrones depende fuertemente de la distancia promedio del orbital electrónico desde el núcleo y su penetración; por lo tanto, el blindaje depende tanto de shell (\(n\)) como de subshell (\(l\)).
El blindaje depende de la penetración de electrones
La ley de Coulomb nos muestra que la distancia de un electrón a su núcleo es importante para determinar la energía del electrón (su atracción hacia el núcleo). El número de concha (\(n\)) determina aproximadamente qué tan lejos está un electrón del núcleo en promedio. Así, todos los orbitales en la misma concha (s, p, d) tienen tamaños similares y una distancia promedio similar de sus electrones desde el núcleo. Pero hay otro factor relacionado con la distancia que juega un papel crítico en la determinación de los niveles de energía orbital: la penetración. La penetración describe la capacidad de un electrón en una subcapa dada para penetrar en otras conchas y subconchas para acercarse al núcleo. La penetración es la medida en que un electrón puede acercarse al núcleo. La penetración depende tanto del caparazón (\(n\)) como del subcaparazón (\(l\)).
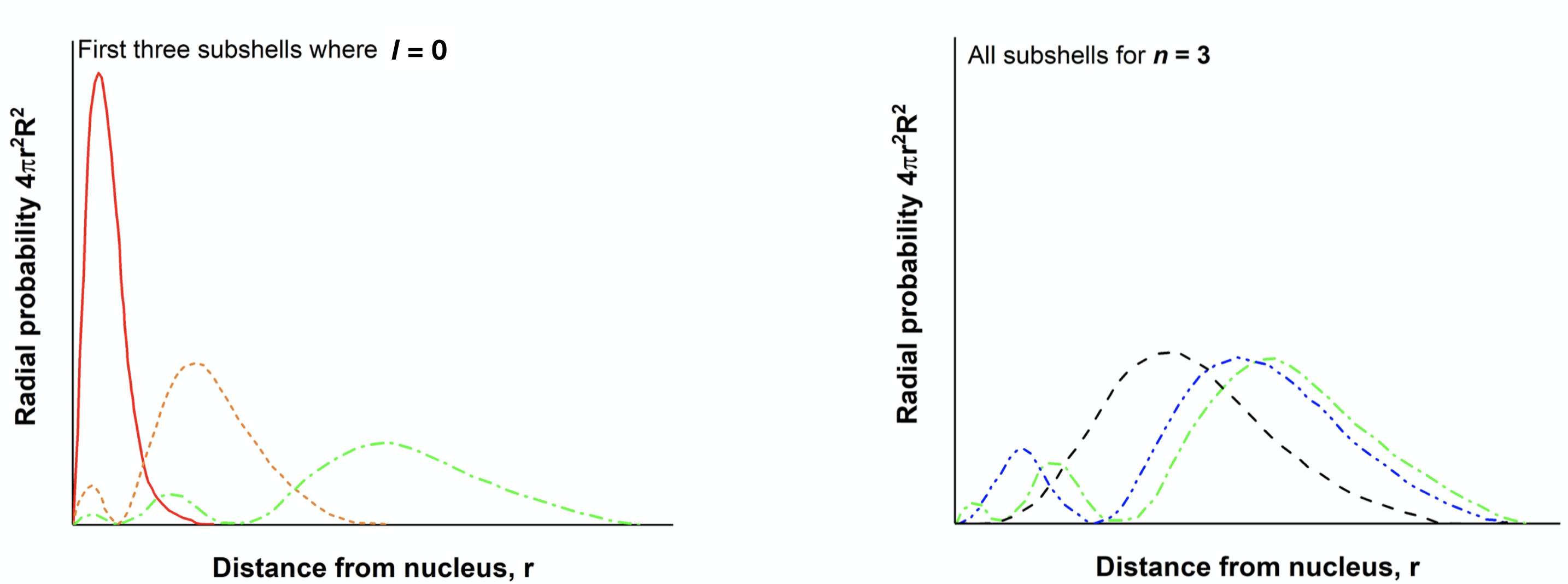
La penetración de orbitales individuales se puede visualizar utilizando las funciones de probabilidad radial. Por ejemplo, la figura\(\PageIndex{2}\) siguiente muestra gráficas de la función de probabilidad radial de los orbitales 1s, 2s y 2p. A partir de estas parcelas, podemos ver que el orbital 1s es capaz de acercarse al más cercano al núcleo; así es el más penetrante. Mientras que los 2s y 2p tienen la mayor parte de su probabilidad a una distancia más alejada del núcleo (en comparación con 1s), el orbital 2s y el orbital 2p tienen diferentes grados de penetración. Observe que el orbital 2s es capaz de penetrar el orbital 1s debido al lóbulo central de 2s. El orbital 2p penetra algo en los 1s, pero no puede acercarse al núcleo tan cerca como lo puede hacer el orbital 2s. Mientras que el orbital 2s penetra más de 2p (el orbital 2s puede acercarse más cerca del núcleo), el 2p está ligeramente más cerca en promedio que 2s. El orden de Z* en subconchas 2s y 2p depende de qué factor (distancia promedio o penetración) es más importante. En las dos primeras filas de la tabla periódica, la penetración es el factor dominante que da como resultado 2s que tienen una energía menor que 2p (ver Figura\(\PageIndex{4}\) para valores).

La penetración de un orbital electrónico afecta su capacidad para blindar a otros electrones y afecta la medida en que está blindado por otros electrones. En general, los orbitales de electrones que tienen mayor penetración experimentan una atracción más fuerte hacia el núcleo y menos blindaje por otros electrones; estos electrones experimentan así una Z* más grande. Los electrones en orbitales que tienen mayor penetración también blindan a otros electrones en mayor medida.
Dentro del mismo valor de concha (n), el poder de penetración de un electrón sigue esta tendencia en subconchas (m l):
>p>d>f
Ejercicios
- Compara los orbitales 2s y 2p: a
) ¿Cuál está más cerca del núcleo en promedio?
b) ¿Cuál es más penetrante?
(c) ¿Cuál orbital experimenta una Z* más fuerte y, por lo tanto, es menor en energía (considere su experiencia, pero también inspeccione las Figuras 1.1.2.3 y 1.1.2.4 de la página anterior)? Por favor explique. - Revise la página de Hiperfísica (clic) que muestra las funciones de probabilidad radial de varios orbitales (haga clic en varios orbitales). Compara los orbitales 2p y 3s:
(a) ¿Cuál está más lejos del núcleo en promedio?
b) ¿Cuál es más penetrante?
c) ¿Cuál orbital es menor en energía? - ¿Qué átomo, Li, o N, tiene una valencia más fuerte Z*? Explique por qué.
- Explica por qué las subcapas 2s y 2p están completamente degeneradas en un átomo de hidrógeno.
- ¿Qué átomo tiene un radio menor: Be o F? Explique.
- ¿Qué electrones blindan a otros de manera más efectiva: 3p o 3d?
- Utilice las pistas dadas en las figuras a continuación para etiquetar las funciones de distribución radial mostradas.
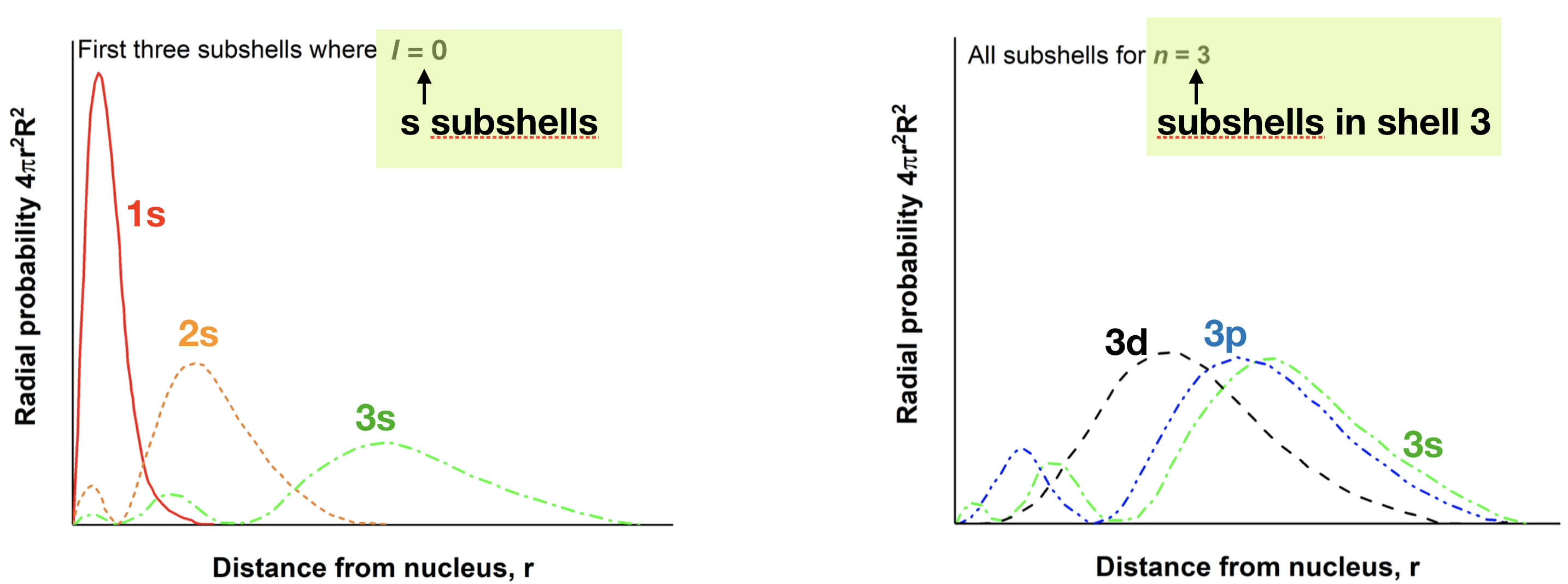
8. Examine la trama a continuación. Observe que las gráficas de densidad de probabilidad para las subcapas 3s, 3p y 3d están resaltadas.
(a) ¿Para cuál de estas tres funciones es la densidad de probabilidad más alta en el\(r\) valor más pequeño (cuál es el más cercano al núcleo en promedio)? ¿Es este el mismo subcaparazón que más penetra?
(b) Utilice este ejemplo para describir cómo la penetración y el blindaje resultan en una división del nivel de energía de la subcapa en átomos de múltiples electrones.
9. Explique por qué la configuración electrónica del estado fundamental (más favorable energéticamente) de Be es 1s 2 2s 2 en lugar de configuraciones alternativas como 1s 2 2s 1 2p 1 o 1s 2 2p 2.
- Respuesta 1
-
(a) La órbita 2s está más cerca del núcleo en promedio.
b) El orbital 2s es más penetrante que 2p.
(c) Usted podría “saber” que el orbital 2s es menor en energía que 2p porque 2s se llena primero. Pero una inspección minuciosa de las Figuras 1.1.2.3 y 1.1.2.4 de la página anterior indica que mientras los elementos 2s y 2p están degenerados en Ne (elemento 10), para los elementos con número atómico 11 y mayor 2p tiene una Z* mayor que 2s! Este ejemplo ilustra que tanto la distancia promedio como la penetración son factores para determinar Z*, y el factor que es más importante puede cambiar a medida que aumentemos en número atómico.
- Respuesta 2
-
(a) El orbital 3s se aleja más del núcleo y se encuentra en promedio más alejado del núcleo que 2p.
(b) El orbital 3s es más penetrante que 2p, ¡aunque 3s está más lejos en promedio!
(c) El orbital 2p es menor en energía que 3s; esto se debe a que 2p todavía está significativamente más cerca del núcleo en promedio y experimenta una Z* más fuerte. (¡La penetración no es la única consideración!)
- Respuesta 3
-
Un átomo de nitrógeno tiene una carga nuclear efectiva (Z*) más fuerte que el litio debido a su mayor número de protones; aunque el N también tiene más electrones que blindarían la carga nuclear, cada electrón solo protege parcialmente cada protón. Esto significa que los átomos con mayor número atómico siempre tienen mayor Z* para cualquier electrón dado.
- Respuesta 4
-
El átomo de hidrógeno tiene un solo electrón; así no hay blindaje a considerar. Cuando no hay otros electrones para blindar el núcleo, la penetración y el blindaje son irrelevantes, y las subconchas dentro de un caparazón son degeneradas.
- Respuesta 5
-
El flúor tiene un radio menor que el berilio porque F tiene una mayor valencia Z* y por lo tanto tira de los electrones de valencia más cerca del núcleo y proporciona un radio atómico más pequeño.
- Respuesta 6
-
3p blinda mejor que 3d porque p orbitales penetran más de d orbitales dentro del mismo caparazón.
- Respuesta 7
-
- Respuesta 8
-
3d es el más cercano en promedio, pero 3s penetra más. Las tres subcapas de\(n=3\) difieren en su distancia promedio y en su capacidad de penetración; estos factores dan como resultado diferencias en la Z* experimentada por los electrones en cada orbital. Esperaríamos que 3s fueran los más bajos en energía seguidos de 3p y luego 3d.
- Respuesta 9
-
Esta pregunta se pregunta por qué el orbital 2s llena Be antes de que se ocupe 2p. Se trata de un átomo de múltiples electrones, por lo tanto, los electrones centrales blindan los orbitales 2s y 2p en diferentes grados. En Be esperamos que el orbital 2s se llene antes de 2p porque 2s penetra más y experimenta una Z* más alta.
Reglas de Slater para estimar Z*
|
El Z* se puede estimar usando varios métodos diferentes; probablemente el método más conocido y más comúnmente utilizado se conoce como Reglas de Slater. Slater desarrolló un conjunto de reglas para estimar Z* en función de cuántos otros electrones existen en el átomo y en la ubicación orbital del electrón de interés. Estos dos factores son determinantes importantes en el blindaje, y se utilizan para calcular una constante de blindaje (S) utilizada en la fórmula de Slater:
\[Z*=Z-S \nonumber \]
donde Z es la carga nuclear real (el número atómico) y Z* es la carga nuclear efectiva.
En el cálculo de S, se supone que los electrones más cercanos al núcleo que nuestro electrón de interés cancelan parte de la carga nuclear; los más alejados del núcleo no tienen ningún efecto. Para calcular S, se escriben todos los orbitales relevantes en un átomo en orden de aumentar la energía, separándolos en “grupos”. Cada cambio en el número de shell es un nuevo grupo; los subshells s y p están en el mismo grupo pero los orbitales d y f son su propio grupo. Escribes todos los orbitales usando paréntesis hasta llegar al grupo del electrón de interés, así:
(1s) (2s,2p) (3s,3p) (3d) (4s,4p) (4d) (4f) (5s,5p) etc.
**Crítico: ¡Los orbitales deben escribirse en orden de aumentar la energía!
- Electrones en el mismo Grupo (): Cada uno de los otros electrones (sin contar el electrón de interés) en el mismo grupo () que el electrón elegido, aporta 0.35 a S.
Conceptualmente, esto significa que los electrones del mismo grupo se blindan entre sí 35%. - Electrones en Grupos () a la izquierda:
- Si el electrón de interés está en una subcapa d o f, cada electrón en grupos () a la izquierda contribuye 1.00 a S.
Conceptualmente, esto significa que los electrones d y f están protegidos al 100% por todos los electrones en la misma capa con un valor menor de\(l\), así como todos los electrones en conchas inferiores (\(n\)). - Si el electrón de interés está en una subcapa s o p, todos los electrones en la siguiente capa inferior (n - 1) contribuyen 0.85 a S. Y todos los electrones en conchas aún más bajas contribuyen 1.00 a S.
Conceptualmente, esto significa que los electrones s y p están protegidos 85% por los electrones una capa menor, y 100% por todos los electrones en conchas n - 2 o inferiores.
- Si el electrón de interés está en una subcapa d o f, cada electrón en grupos () a la izquierda contribuye 1.00 a S.
- electrones 1s: S de un electrón 1s es solo S=0.3, sin importar el elemento.
Un video explicando cómo usar las Reglas de Slater
¿Qué es el Z* experimentado por los electrones de valencia en las tres especies isoelectrónicas: anión flúor (F -), átomo de neón neutro (Ne) y catión de sodio (Na +)?
Solución
Cada especie tiene 10 electrones, y el número de electrones centrales es de 2 (10 electrones totales - 8 de valencia), pero la carga nuclear efectiva varía porque cada uno tiene un número atómico diferente (Z). El Z* aproximado se puede encontrar con las Reglas de Slater. Para todas estas especies, calcularíamos el mismo valor sigma:
Calculando\(S\): (1s) (2s,2p),\(S = 2(0.85) + 7(0.35) = 1.7 + 2.45 = 4.15 \)
anión Flúor:\(Z*= 9 - S = 9 - 4.15 = 4.85\)
Átomo de neón:\(Z*= 10 - S = 10 - 4.15 = 5.85\)
Catión de sodio:\(Z*= 11 - S = 11 - 4.15 = 6.85\)
Entonces, el catión de sodio tiene la mayor carga nuclear efectiva.
Calcular Z* para un electrón 3D en un átomo de zinc (Zn).
- Contestar
-
Escriba los orbitales relevantes: (1s) (2s,2p) (3s,3p) (3d)
(4s)Observe que aunque 4s está completamente ocupado, no lo incluimos porque en Zn, 4s es mayor en energía que 3d. Por lo tanto, 4s está a la derecha de los electrones d que estamos considerando. El electrón de interés está en 3d, por lo que los otros nueve electrones en 3d cada uno aportan 0.35 al valor de S. Los otros 18 electrones aportan cada uno 1 al valor de S.
\(S=18(1)+9(0.35)=21.15\)
\(Z*=30-21.15=8.85\)
Entonces, aunque la carga nuclear del Zn es de 30, los electrones 3d solo experimentan una\(Z* \approx 8.85\)!
“Mejores” valores para Z*
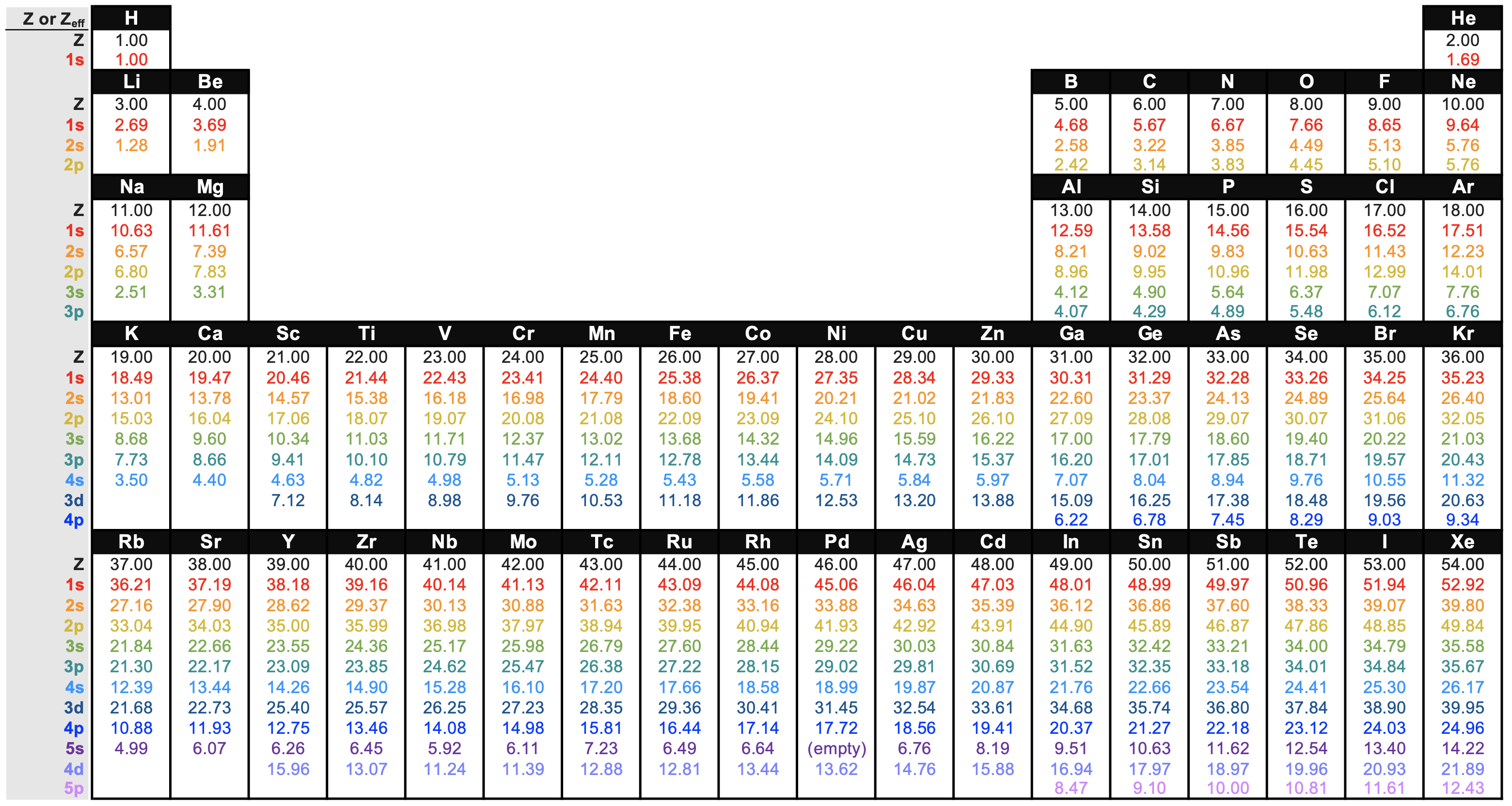
Las reglas de Slater son un conjunto de reglas simples para predecir\(S\) y Z* basadas en evidencia empírica de cálculos mecánicos cuánticos. Es decir, los Z* calculados a partir de las reglas de Slater son valores aproximados. Los valores considerados como los más precisos se derivan de cálculos mecánicos cuánticos directamente. Estos valores se pueden encontrar en un bonito gráfico en el artículo de Wikipedia de Carga Nuclear Efectiva. El gráfico se recrea aquí en Figura\(\PageIndex{3}\) para mayor comodidad:
Z* modula la atracción
Cuando los electrones de valencia experimentan menos carga nuclear que los electrones centrales, diferentes electrones experimentan diferentes magnitudes de atracción hacia el núcleo. A continuación se escribe una forma modificada de la Ley de Coulomb, donde\(e\) está la carga de un electrón, Z* es la carga nuclear efectiva que experimenta ese electrón, y\(r\) es el radio (distancia del electrón desde el núcleo).
\[ F_{eff}=k \dfrac{Z*e^2}{r^2} \nonumber \]
Esta fórmula sugiere que si podemos estimar Z*, entonces podemos predecir la fuerza atractiva experimentada por, y la energía de, un electrón en un átomo multi-electrón (ex. Li).
La atracción del núcleo a los electrones de valencia determina el tamaño atómico o iónico, la energía de ionización, la afinidad electrónica y la electronegatividad. Cuanto más fuerte es la atracción, y cuanto más fuerte Z*, más cerca se acercan los electrones hacia el núcleo. Esto a su vez resulta en un tamaño más pequeño, mayor energía de ionización, mayor afinidad electrónica y electronegatividad más fuerte.
Tendencias periódicas generales en Z*
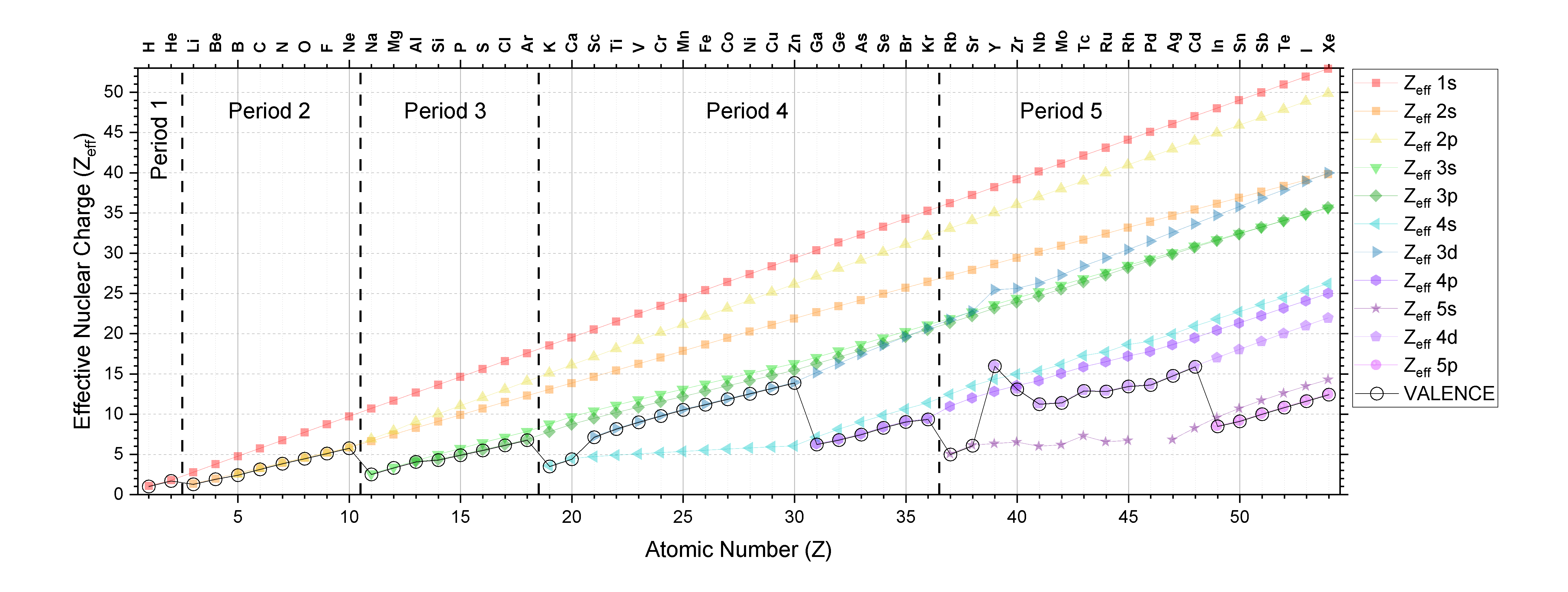
La inspección minuciosa de la Figura\(\PageIndex{3}\) y el análisis de las reglas de Slater indican que hay algunas tendencias predecibles en Z*. Los datos de la Figura\(\PageIndex{3}\) se representan a continuación en la Figura\(\PageIndex{4}\) para proporcionar una ayuda visual a la discusión a continuación.
Tendencias en Z* para electrones en una carcasa y subcapa específicas
El Z* para electrones en un shell y subshell dado generalmente aumenta a medida que aumenta el número atómico; esta tendencia se mantiene verdadera yendo a través de la tabla periódica y bajando la tabla periódica. Convénzase de que esto es cierto para cualquier subshell examinando Figura\(\PageIndex{4}\). (CC-BY-NC-SA; Kathryn Haas)
- ¿Observa alguna excepción a esta tendencia general?
-
La inspección de la Figura\(\PageIndex{4}\) debería confirmar por usted que el Z* aumenta a medida que Z aumenta para los electrones en cualquier subcapa (como la subcapa 1s por ejemplo, que se grafica arriba como una línea roja con puntos cuadrados). Se puede ver esta tendencia como la pendiente positiva en cada serie. Hay una excepción obvia en el Período 5 en los elementos 39 (Y) a 41 (Nb; el Z* de 4s realmente disminuye a través de estos tres elementos a medida que aumenta el número atómico. También hay una excepción entre Y y Zr en el subshell 3d, y entre Tc y Ru en el subshell 5s.
Para electrones de valencia:
Es útil entender las tendencias en valencia Z* porque la valencia Z* determina las propiedades atómicas/iónicas y la reactividad química. Las tendencias en la valencia Z* no son simples porque a medida que aumenta el número atómico, el shell y/o subshell de valencia también cambia. La valencia Z* se indica en la Figura\(\PageIndex{4}\) como una línea negra con círculos abiertos.
Abajo de la tabla: A medida que bajamos una columna de la tabla periódica, la valencia Z* aumenta. Esta es una tendencia simple porque el tipo de subshell es consistente y hay un aumento solo en shell y en número atómico, Z. Esta tendencia se ilustra mejor mediante la inspección de la Figura\(\PageIndex{3}\).
Al otro lado de la tabla: la tendencia depende de shell y subshell, pero generalmente Z* aumenta a lo largo de un periodo.
Periodos 1-3 (s y p solamente): A medida que recorremos la tabla en los periodos 1-3, el shell permanece constante a medida que Z aumenta y la subcapa cambia de s a p. En estos periodos, hay un incremento gradual de valencia Z* a medida que avanzamos a través de cualquiera de los tres primeros periodos.
Períodos 4 y 5 (s, p, y d): Ahora tenemos algunas tendencias más complejas porque la subcapa de valencia y la concha están cambiando a medida que aumentamos en número atómico. Observe que la valencia Z* generalmente aumenta pasando por un período siempre que el subshell no cambie; la excepción está dentro del subshell 4d (elementos 39-44 o Y-Ru). En general, pasando de un\((n)s\) subshell a un\((n-1)d\) subshell, hay un aumento relativamente grande en la valencia Z*. Y al pasar de un subshell\((n-1\) d\) a un\((n)p\) subshell, hay una disminución relativamente grande en Z*.
De un periodo a otro: De la Figura\(\PageIndex{4}\), podemos ver que a medida que aumentamos Z en un protón, pasando de un periodo a otro, hay una disminución relativamente grande en Z* (de Ne a Na, por ejemplo). Esto se debe a que a medida que Z aumenta en un pequeño intervalo, el número de conchas aumenta, y así los electrones en la capa de valencia están mucho más lejos del núcleo y están más protegidos por todos los electrones en los números de caparazón más bajos.
Ejercicios
- Comparar tendencias en Z* y tamaño atómico. Explicar cómo y por qué el tamaño atómico depende de Z*.
- Comparar tendencias en Z* y energía de ionización. Explicar cómo y por qué la energía de ionización depende de Z*.
- Contestar
-
1. En la tabla periódica, el radio atómico generalmente disminuye a través de los períodos (de izquierda a derecha) y aumenta hacia abajo en los grupos. A medida que aumenta el número atómico a través de la tabla periódica, la carga nuclear (Z) aumenta y Z* aumenta. A su vez, el radio atómico disminuye debido a que la mayor carga nuclear (y por lo tanto mayor Z*) acerca los electrones al núcleo. El radio atómico aumenta en la tabla periódica debido a que aumenta el número de proyectiles. A pesar de un aumento en Z* bajando por la tabla periódica, los radios atómicos más grandes resultan de electrones que ocupan conchas más altas.
2. Las energías de ionización (IE) están inversamente relacionadas con el radio atómico; IE aumenta a lo largo de los períodos y disminuye en los grupos. Dado que el núcleo contiene electrones de valencia con mayor fuerza (debido al mayor Z*) a lo largo de los períodos, IE aumenta porque los electrones de valencia son más difíciles de eliminar. Abajo de la tabla periódica, radios atómicos más grandes hacen que los electrones en los orbitales de valencia sean protegidos por electrones centrales. Recordemos que el blindaje reduce la carga nuclear disponible para los electrones en niveles orbitales más altos, resultando en una Z* más baja. Con más blindaje y menor Z*, los electrones de valencia se mantienen menos apretados por el núcleo de tal manera que la energía de ionización disminuye (es decir, los electrones de valencia son más fáciles de eliminar).
Referencias
- Petrucci, Ralph H., William S. Harwood, F. Geoffrey Herring y Jeffry D. Madura. Química General: Principios y Aplicaciones Modernas, Novena Edición. Pearson Education Inc. Upper Saddle River, Nueva Jersey: 2007.
- Raymond Chang. Química Física para Ciencias Biológicas. Sausalito, California: Libros de Ciencias Universitarias, 2005
- R. S. Mulliken, Estructuras Electrónicas de Moléculas y Valencia. II Consideraciones Generales, Revisión Física, vol. 41, pp. 49-71 (1932)
- Anastopoulos, Charis (2008). Partícula u onda: La evolución del concepto de materia en la física moderna. Princeton University Press. pp. 236—237. ISBN 0691135126. http://books.google.com/?id=rDEvQZhpltEC&pg=PA236.
Colaboradores y Atribuciones
- Sidra Ayub (UCD), Alan Chu (UCD)
Emily V Eames (City College of San Francisco)
Modified by Kathryn Haas (khaaslab.com)

