2.2.3: Principio Aufbau
- Page ID
- 81229
Introducción
El Principio Aufbau (también llamado principio de acumulación o regla de Aufbau) establece que, en el estado fundamental de un átomo o ion, los electrones llenan orbitales atómicos del nivel de energía más bajo disponible antes de ocupar niveles de energía más altos. En general, un electrón ocupará un orbital atómico con el valor más bajo de\(n, l, m_l\), en ese orden de prioridad. Al valor de\(m_s\) para un electrón desapareado se le asigna convencionalmente un valor de\(+\frac{1}{2}\). Cada electrón en un átomo/ion debe tener un conjunto único de valores para los cuatro números cuánticos.
El estado fundamental de los átomos/iones hidrogénicos
En un átomo/ion hidrogénico, solo hay un electrón. En este caso, el único factor determinante de la energía es el valor de\(n\). El estado fundamental siempre será el orbital 1s (\(n=1, l=0, m_l=0, m_s=+\frac{1}{2}\)).
El estado fundamental de los átomos/iones de electrones múltiples
En átomos/iones con dos o más electrones, la configuración electrónica del estado fundamental (1) minimiza la energía total de los electrones, (2) obedece al principio de exclusión Pauli, (3) obedece a la regla de Hunds de máxima multiplicidad, y (4) considera la interacción de intercambio. Estas “reglas” se describen a continuación.
| (1) Los electrones ocuparán los orbitales de menor energía para minimizar la energía total. Los dos números cuánticos que están relacionados con la energía en los átomos de múltiples electrones son\(n\), y\(l\). Así, los orbitales con los valores más bajos de\(n\) y\(l\) se llenarán primero. |

|
|
(2) La regla de Hund de multiplicidad máxima establece que para una configuración de electrones dada, la disposición de energía más baja de los electrones en orbitales degenerados es la que tiene la mayor “multiplicidad”, donde la multiplicidad es el número de electrones desapareados (n) más 1 (multiplicidad = n + 1 ). Esta regla se utiliza para predecir el estado fundamental de un átomo o molécula con una o más conchas electrónicas abiertas. La regla de Hund se basa en la observación empírica de los espectros atómicos, y es una consecuencia de la energía requerida para emparejar dos electrones en un mismo orbital. Esta energía de repulsión entre dos electrones en los mismos orbitales es una energía coulómbica de repulsión\(\Pi_c\), causada por dos electrones con carga similar que comparten la misma área del espacio (un orbital). Cuando más de un electrón ocupa un conjunto de orbitales degenerados, la disposición más favorable es aquella en la que se minimiza el número de electrones emparejados. Una definición simplificada de la regla de Hund es que la disposición de energía más baja es la que tiene el mayor número de electrones desapareados. Esto implica que si se dispone de dos o más orbitales de igual energía, los electrones los ocuparán individualmente antes de llenarlos en pares. Ejemplos de disposiciones de estado fundamental de electrones en tres orbitales p degenerados se dan en la figura que se muestra aquí. |
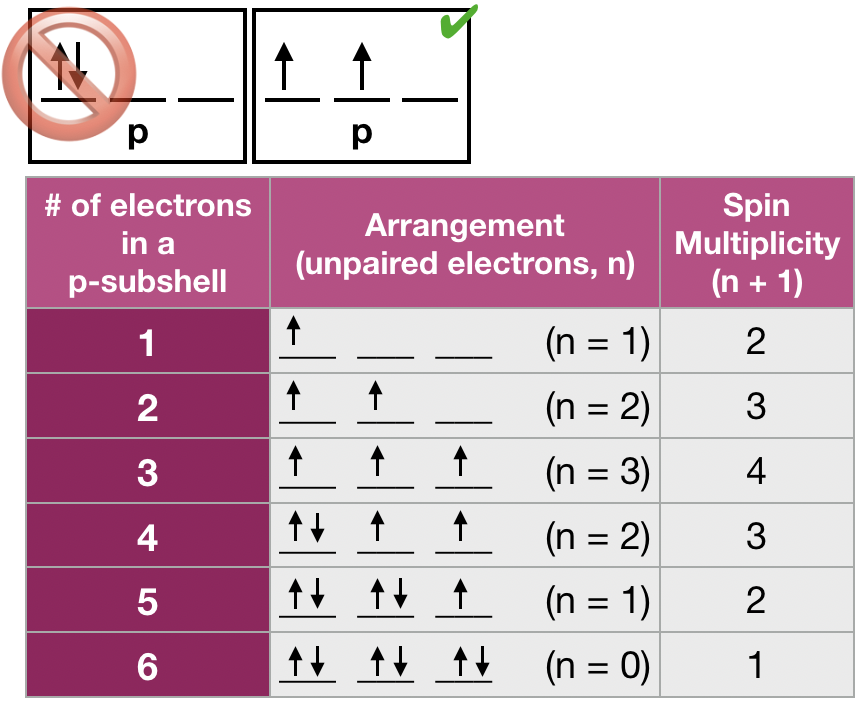 Figura\(\PageIndex{2}\). La regla de Hund es que la multiplicidad de espín debe maximizarse en el estado fundamental. (CC-BY-NC-SA; Libretextos) Figura\(\PageIndex{2}\). La regla de Hund es que la multiplicidad de espín debe maximizarse en el estado fundamental. (CC-BY-NC-SA; Libretextos) |
| (3) El principio de exclusión de Pauli establece que es imposible que dos electrones de un átomo de múltiples electrones tengan el mismo conjunto de valores para los cuatro números cuánticos. Dos electrones en diferentes orbitales tendrán un conjunto diferente de\(n, l\), y\(m_l\) valores. Cuando dos electrones residen en un mismo orbital, poseen el mismo\(n, l\), y\(m_l\) valores, por lo tanto sus m s deben ser diferentes. Así, dos electrones en el mismo orbital deben tener proyecciones de espín medio entero opuestas de\(+\frac{1}{2}\) y\(-\frac{1}{2}\). | 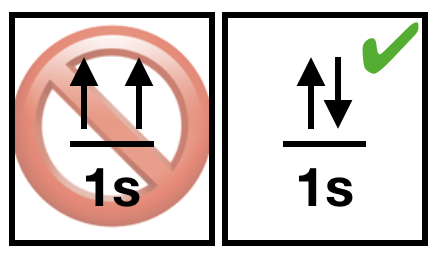 Figura\(\PageIndex{3}\). El principio de Pauli nos dice que los electrones emparejados deben tener giro opuesto. CC-BY-NC-SA; Libretextos) Figura\(\PageIndex{3}\). El principio de Pauli nos dice que los electrones emparejados deben tener giro opuesto. CC-BY-NC-SA; Libretextos) |
| (4) La interacción de intercambio a veces se denomina energía de intercambio o fuerza de intercambio. Sin embargo, no es una verdadera energía o fuerza. Más bien, es un efecto mecánico cuántico que tiene lugar entre partículas idénticas. La interacción de intercambio da como resultado una configuración electrónica de estado fundamental con electrones desapareados que son todos del mismo giro. Los electrones desapareados se escriben convencionalmente en la dirección de “giro hacia arriba”. | 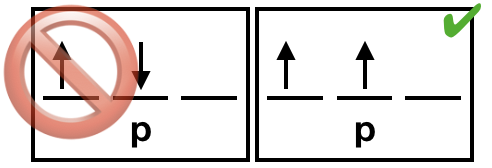 Figura\(\PageIndex{4}\). Los electrones desapareados deben tener giros idénticos debido a la interacción de intercambio. CC-BY-NC-SA; Libretextos) Figura\(\PageIndex{4}\). Los electrones desapareados deben tener giros idénticos debido a la interacción de intercambio. CC-BY-NC-SA; Libretextos) |
Tendencias en la configuración esperada de electrones
Las cuatro “reglas” anteriores pueden usarse como pautas para predecir la configuración electrónica del estado fundamental de los átomos, el llenado de subconchas y la configuración de electrones en orbitales degenerados. Sin embargo, la utilidad de estas pautas para predecir configuraciones electrónicas reales requiere un conocimiento más matizado de los niveles de energía relativa de los orbitales.
Generalmente, los niveles de energía orbital corresponden directamente a su número de proyectiles. Adicionalmente, los orbitales dentro de un caparazón generalmente siguen la tendencia energética donde s<p<d<f. Aunque estas tendencias generales para los niveles de energía orbital relativos son ciertas para la mayoría de los elementos del bloque principal (los bloques s y p), existen excepciones importantes en los niveles de energía orbital del metal de transición átomos e iones de los bloques d y f.
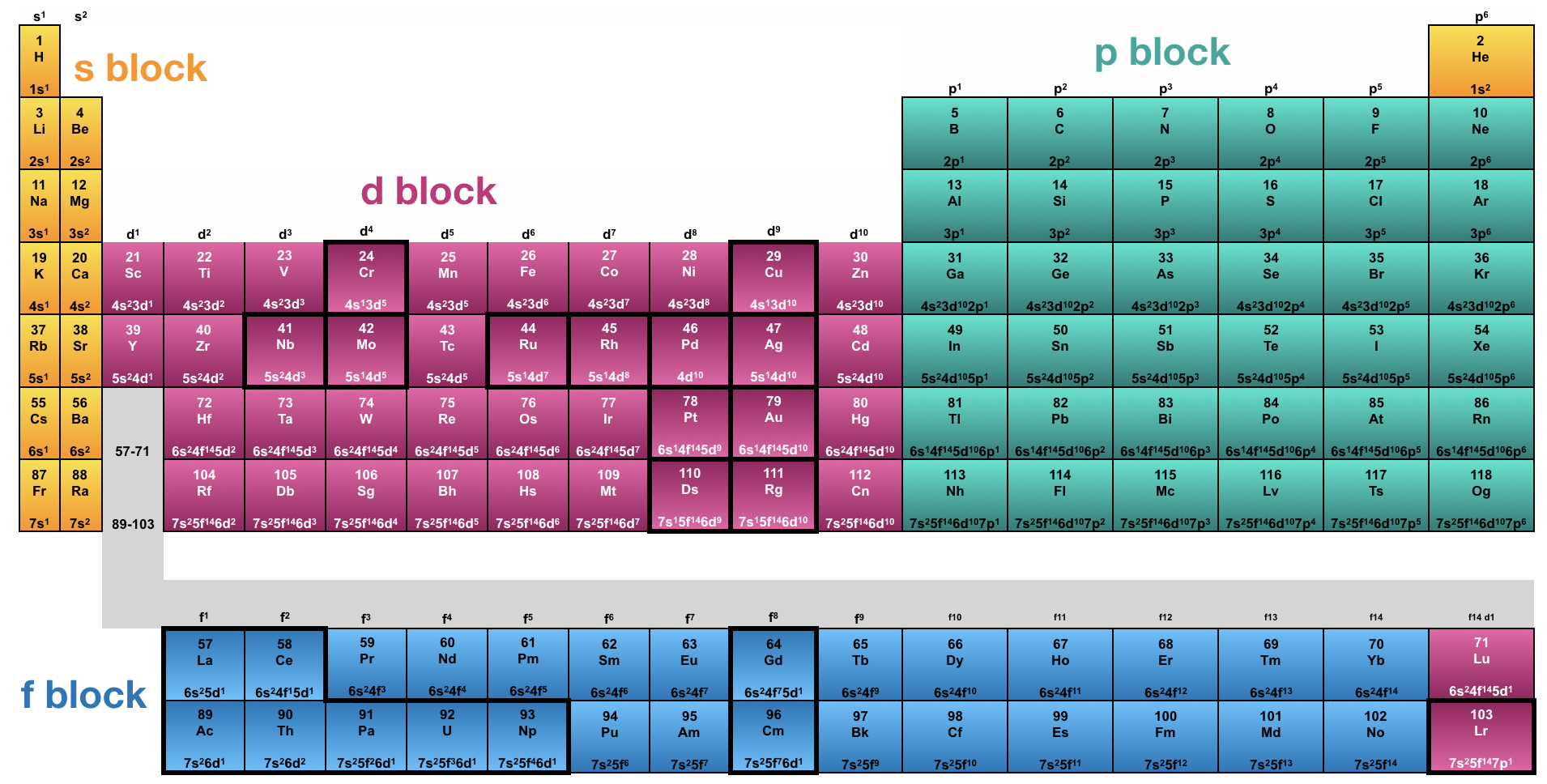
Los elementos que violan las tendencias generales en la configuración electrónica se perfilan con una línea oscura en la Figura\(\PageIndex{5}\). Todas las excepciones están dentro de los bloques d y f, y las violaciones son causadas por un orden inesperado de los niveles de energía orbitales.
En la siguiente sección aprenderá por qué los niveles de energía orbitales se correlacionan con el número de proyectiles y por qué las subconchas dentro de una concha suelen seguir la tendencia que s<p<d<f También aprenderá por qué hay excepciones ocasionales a esta tendencia y cómo estas excepciones influyen en las propiedades elementales.
Referencias
- Miessler, Gary L. y Donald A. Tarr. Química Inorgánica. Upper Saddle River, NJ: Pearson Prentice Hall, 2010. Imprimir.
-
Brown, Ian David. El Enlace Químico en Química Inorgánica el Modelo Bond Valence. Oxford: Oxford UP, 2006. Imprimir.


