3.1.2: Rompiendo la regla del octeto con mayores recuentos de electrones (átomos hipervalentes)
- Page ID
- 81295
La regla del octeto se aplica bien a los átomos en la segunda fila de la tabla periódica, donde una capa de valencia completa incluye ocho electrones con una configuración electrónica de\(s^2p^6\). Incluso los elementos de la tercera y cuarta fila son conocidos por seguir esta regla a veces, pero no siempre. En átomos más grandes, donde\(n\geq3\) la capa de valencia contiene subconchas adicionales: las\(d, f, g...\) subconchas. Por lo tanto, los átomos con\(n\geq3\) pueden tener mayores recuentos de conchas de valencia al “expandirse” en estas subconchas adicionales. Cuando los átomos contienen más de ocho electrones en su caparazón de valencia, se dice que son hipervalentes. La hipervalencia permite que\(n\geq3\) los átomos con rompan la regla del octeto al tener más de ocho electrones. Esto también significa que pueden tener cinco o más enlaces; algo que es casi inaudito para los átomos con\(n\leq2\). Completa los ejercicios a continuación para ver ejemplos de moléculas que contienen átomos hipervalentes.
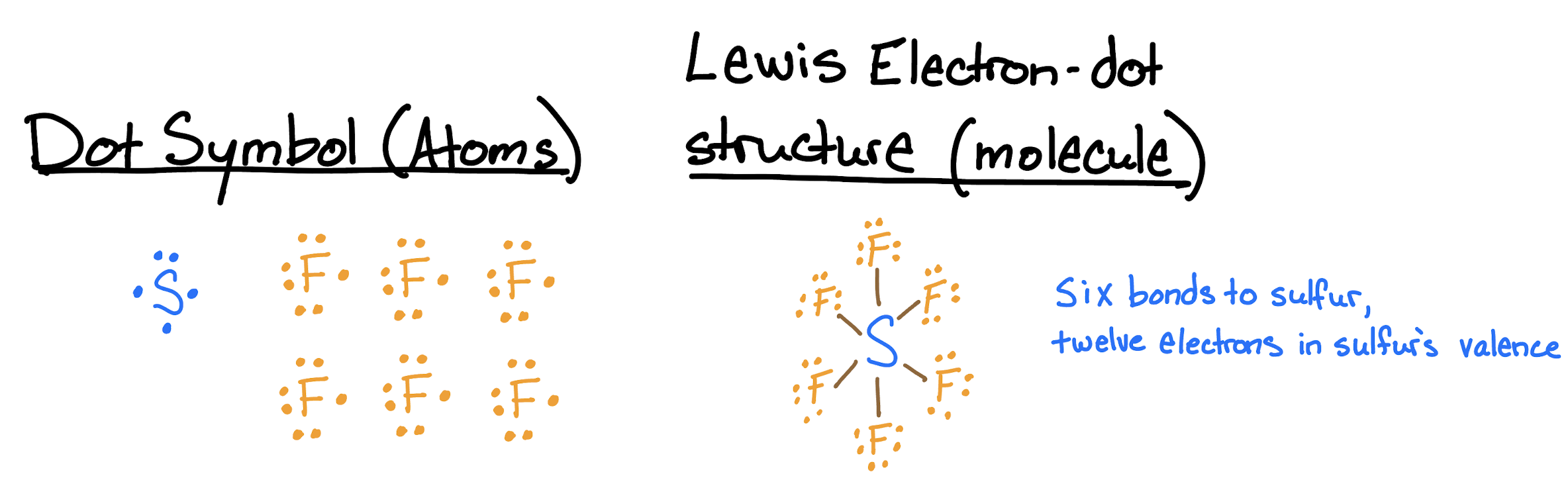
Dibuje las estructuras de Lewis para hexafluoruro de azufre (\(\ce{SF6}\)).
- Contestar
-
Cada átomo de flúor tiene un electrón de valencia y hará un enlace cada uno. El azufre tiene seis electrones de valencia, y debe formar seis enlaces para formar una molécula con los seis átomos de flúor. La estructura molecular tiene seis enlaces al azufre, con doce electrones de valencia. El azufre es hipervalente.
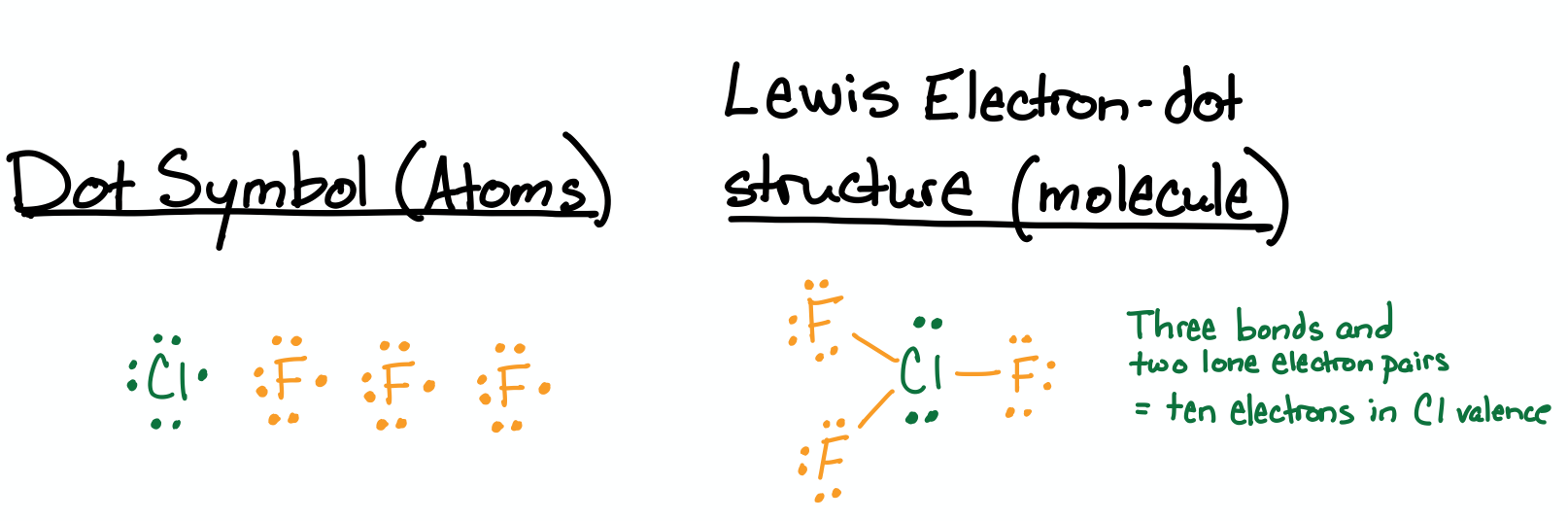
Dibuja la estructura de Lewis para trifluoruro de cloro (\(\ce{ClF3}\).
- Contestar
-
Todos los átomos son halógenos y cada uno tiene siete electrones de valencia. El cloro es capaz de hipervalencia porque está en la tercera fila de la tabla periódica; sin embargo, el flúor no puede tener más de ocho electrones de valencia en su valencia porque está en la segunda fila. La estructura tiene los tres átomos de flúor unidos a un átomo central de cloro. El cloro tiene una valencia de diez electrones debido a sus tres enlaces y dos pares solitarios.
 .
.
¿La hipervalencia es real? No exactamente. La hipervalencia es un concepto asociado con la teoría orbital híbrida y la teoría de Lewis. Es útil para algunas cosas simples, como predecir cómo están conectados los átomos y predecir la forma molecular. Pero la idea de que los orbitales d están involucrados en la unión no es precisa según la mecánica de las olas.
Para las moléculas del grupo principal, los químicos (como Pauling) pensaron hace mucho tiempo que la hipervalencia se debe a la expansión de s 2 p 6 octetos. El consenso ahora es claro que los d orbitales NO están involucrados en la unión en moléculas como SF 6 más que en SF 4 y SF 2. En los tres casos, hay una participación pequeña y aproximadamente idéntica de los orbitales d en las funciones de onda. Esto se ha establecido tanto en la teoría MO como en la VB. Sin embargo, el uso de orbitales híbridos con contribuciones d-orbitales nos dota de un lenguaje que puede describir pragmáticamente las geometrías de sustancias altamente coordinadas.
Mientras que los orbitales híbridos son una poderosa herramienta para describir las geometrías y la forma de moléculas y complejos metálicos. Sin embargo, en moléculas “reales”, su significación puede ser debatida. A menudo con un enfoque de orbitales moleculares más realista es necesario. Sin embargo, desde un punto de vista epistemológicamente simple, las teorías de vinculación solo pueden ser juzgadas por sus predicciones. En la medida en que la hibridación puede explicar las formas de PF 5 y SF 6, la teoría del enlace de valencia es una teoría perfectamente buena. En la medida en que si escribes la función de onda del enlace de valencia usando orbitales hibridados y calculas energías y otras propiedades à la Pauling (es decir, energía de ionización y afinidades electrónicas) y encuentras que están fuera de los resultados experimentales (por decenas de kcals/mol), entonces la teoría del enlace de valencia no es precisa.
Las teorías de vinculación sólo pueden ser juzgadas por sus predicciones.
Una explicación simple que se puede dar es que las funciones de onda molecular construidas a partir de orbitales atómicos hibridados son lo suficientemente precisas como para predecir algunas cosas, pero no otras. Las predicciones de cualquier teoría deben compararse con la evidencia empírica para evaluar cuándo funcionan y cuándo fallan. Cuando una teoría da la respuesta equivocada, al menos una suposición no debe sostenerse. En este caso, la función de onda de enlace de valencia no es lo suficientemente precisa como para capturar algunas características importantes de la estructura electrónica de un sistema. Puede que no sea la respuesta intelectualmente más satisfactoria, pero decir más resultaría en una respuesta mucho más complicada y ciertamente mucho más allá del nivel razonablemente esperado de las discusiones generales de química.


